外切异麦芽三糖水解酶的产酶条件及酶学性质*
岳晓婧,戴玲,夏强,汪晶晶
(安徽大学生命科学学院,安徽合肥,230039)
外切异麦芽三糖水解酶的产酶条件及酶学性质*
岳晓婧,戴玲,夏强,汪晶晶
(安徽大学生命科学学院,安徽合肥,230039)
从土壤中筛选出1株产外切型异麦芽三糖水解酶的黄绿青霉,可特异性地水解右旋糖酐只产生异麦芽三糖。该菌株产酶最优条件为:培养液中淀粉、葡聚糖、NH4Cl、酵母膏的质量分数分别为1%、1%、0.1%、0.1%,pH 6.0,接种量1%,装液量50 mL/250 mL,转速120 r/min。25℃培养13 d酶活达到176.80 U/mL。酶的最适作用温度为55℃,在50℃半衰期为3 h,最适作用pH为6.5,在pH 4.0~pH 6.5范围内稳定;金属离子K+、Ba2+显著促进酶活,Ca2+、Fe2+强烈抑制酶活;150 mmol/L NaCl所产生的离子强度促进酶活。
右旋糖酐酶,异麦芽三糖,青霉菌,酶学性质
右旋糖酐(dextran)是某些细菌合成的生物高聚物,主要是葡萄糖通过α-1,6糖苷键连接而成的大分子,其在医药、食品及石油工业上有广泛的应用。已发现一些微生物能合成水解dextran的酶类,泛称右旋糖酐酶(dextranases,dex)。依据催化反应类型,右旋糖酐酶又可分为内切酶和外切酶。内切糖酐水解酶(EC3.2.1.11)随机内切水解dextran的1,6糖苷键,水解产物主要是异麦芽糖、异麦芽三糖、葡萄糖和异麦芽寡糖的混合物,视产酶微生物的来源和右旋糖酐底物不同而有差别。外切酶是从右旋糖苷链的还原端或非还原端依次顺序移去末端1~3个葡萄糖,产物分别为葡萄糖、异麦芽糖、异麦芽三糖,对应的酶分别为葡萄糖右旋糖酐酶(glucodextranase,EC 3.2.1.70),异麦芽糖右旋糖酐酶(isomaltodextranase,EC 3.2.1.94)和异麦芽三糖右旋糖酐酶(isomaltotriodextranase)(EC3.2.1.95)[1]。上述酶类分属于糖苷酶数据库中糖苷水解酶的不同家族(GH 49、66、13、15、27)[2]。
右旋糖酐酶有多方面的应用,在防治龋齿,制糖工艺过程中葡聚糖的去除,以及酶解法生产低分子量的药用右旋糖酐等方面有着重要用途[3-4]。右旋糖酐酶和右旋糖酐在构建药物载体和药物释放系统领域亦颇受关注[5-6]。右旋糖酐酶主要由微生物产生,包括丝状真菌、细菌和酵母。目前对这些酶的研究以内切右旋糖酐酶较为活跃,涉及Dex基因的克隆,酶学性质及应用研究[7-8],酶解产物为葡萄糖和寡糖的混合物。其他类型的酶报道较少。
异麦芽三糖右旋糖酐酶(isomaltotriodextranase)(EC3.2.1.95)最早由Sugiura报道[9],是由褐色短杆菌产生的外切酶。该酶的底物特异性较强,只降解具有连续1,6糖苷键的dextran,产物为异麦芽三糖,又称外切异麦芽三糖水解酶。该酶比较稀有,仅在少数细菌中发现,如Pulkownik[10]报道的链球菌内切酶和程秀兰[11]报道的产碱杆菌外切酶,其他尚未见报道。褐色短杆菌的产酶基因已克隆并在大肠杆菌中表达[12],纯化的重组酶表现出与天然酶相同的最适pH和作用方式。
该酶的底物特异性和产物均一性,使其能够从右旋糖酐生产均一寡聚糖,具有潜在的应用前景。本文首次报道从丝状真菌发现1株产酶菌株,其酶解dextran产物经薄层层析分析为单一的异麦芽三糖,证明为外切异麦芽三糖水解酶,并在前期工作基础上对该菌产酶条件和粗酶性质进行了研究。
1 材料
1.1 菌株
黄绿青霉D5菌株(Penicillium citreoviride)为实验室保存菌株,筛选自土壤并经形态及ITS rDNA序列鉴定。
1.2 主要试剂
Dextran T70(上海润捷化学试剂有限公司);Blue Dextran 2000(Solarbio);Isomaltotriose(Sigma);Isomaltotetraose(USBiological);薄层层析板HPTLCPlatten Nano-sil 20(Merck)。
1.3 培养基
基础培养基(g/100 mL):葡聚糖1、酵母膏0.2、NaNO30.2、NaH2PO40.05、K2HPO40.05、MgSO40.02、CaCl20.01、pH值自然。
2 方法
2.1 酶活力测定
将D5菌株摇瓶培养的发酵液离心除去菌体后作为酶液。取10 μL适当稀释的酶液,加入到90 μL用pH 5.0的醋酸缓冲液配制的2%葡聚糖溶液中,50℃反应10 min,以100℃灭活5 min的酶液加底物溶液为反应对照。反应液DNS法测还原糖。在上述条件下,每分钟释放1 μmol还原糖所需的酶量定义为一个酶活力单位(U)。
2.2 产酶条件研究
2.2.1 碳源的影响
在基础培养基中,采用葡聚糖及其分别与淀粉、葡萄糖、蔗糖的组合作为碳源,25℃摇床培养72 h,测酶活。过滤菌丝球,蒸馏水洗涤后烘干称重测生物量。
2.2.2 氮源的影响
在基础培养基中,采用最优碳源,以酵母膏、蛋白胨、牛肉膏、NaNO3、(NH4)2SO4、NH4Cl作氮源,摇床培养72 h,测酶活和生物量。
2.2.3 初始pH的影响
在基础培养基中,分别采用最优碳氮源,调节初始pH值分别为pH 3~8,25℃摇床培养72 h,测酶活。
2.2.4 装液量、转速、接种量的影响
根据单项预试验结果,选择影响真菌液态发酵的3个重要因素:装液量、转速、接种量进行正交实验L9(33)得出产酶最佳条件。

表1 正交优化因素水平表
2.2.5 产酶时间曲线
采用优化的培养基,接种后于25℃摇床培养,每隔24 h测酶活。
2.3 酶学性质研究
2.3.1 酶促反应产物分析
将酶液加入到2%葡聚糖溶液中,50℃反应30 min后,煮沸5 min中止反应,反应液用薄层色谱法分析。展层剂为V(甲酸)∶V(正丁醇)∶V(水)=6∶4∶1,显色剂为1 mL HCl、2 mL苯胺、2 g二苯胺、10 mL 85%H3PO4溶于100 mL丙酮中。
2.3.2 最适作用温度及热稳定性
将粗酶液与底物溶液分别在25~65℃条件下反应10 min后测酶活,研究最适作用温度;将酶液分别于25~60℃保温,每隔一定时间取样1次,取出的样品立即冰浴,在最适作用温度下测酶活,测量酶的热稳定性。
2.3.3 最适作用pH及pH稳定性
在pH 3.6~10.0的不同缓冲液中测酶活力研究最适作用pH;用pH 4.0~9.0的缓冲液将酶液稀释2倍,于4℃保存6 h后测酶活,研究pH稳定性。
2.3.4 金属离子对酶活的影响
用底物溶液分别配制K+、Ba2+、Mg2+、Ca2+、Fe2+溶液,使各金属离子终浓度分别为5,10,20 mmol/L。以不加金属离子的反应体系为对照,在最适反应条件下测酶活。
2.3.5 离子强度对酶活的影响
用底物溶液分别配制浓度在50~300 mmol/L的NaCl溶液,以不加NaCl的反应体系为对照,在最适反应条件下测酶活。
3 结果与分析
3.1 青霉D5产酶条件研究
3.1.1 碳源的影响
可溶性碳源对产酶有较明显的影响(图1)。单一碳源组中,葡聚糖作碳源时酶活最高,蔗糖和葡萄糖作碳源时产酶较低。加葡聚糖的组合碳源组产酶分别比相应的单一碳源组高,且随着葡聚糖含量增加产酶提高,证明葡聚糖对菌株的产酶有诱导作用。组合碳源中,1%淀粉+1%葡聚糖对促进产酶效果最好,1.5%蔗糖+0.5%葡聚糖促产酶的效果最差。从生物量上看,单一碳源组中葡聚糖作碳源时生物量最低,组合碳源组的生物量普遍比相应的单一碳源组低,说明葡聚糖不易被该菌株利用。生物量与产酶无相关性。
3.1.2 氮源的影响
氮源对产酶的影响见图2。0.1%NH4Cl+0.1%酵母膏作氮源时菌株产酶最高,其次为0.2%NH4Cl,且这2组生物量最高,说明NH4Cl对该菌株的菌体生长和产酶有促进作用。
3.1.3 初始pH值的影响
调整培养基至不同pH值,测上清液中酶活,结果见图3。
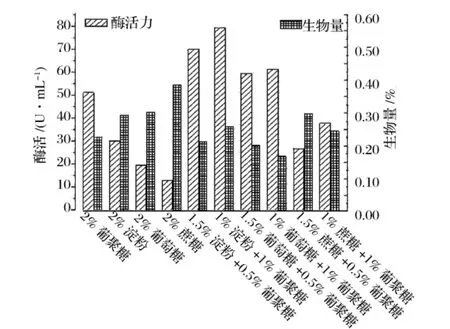
图1 碳源对产酶的影响
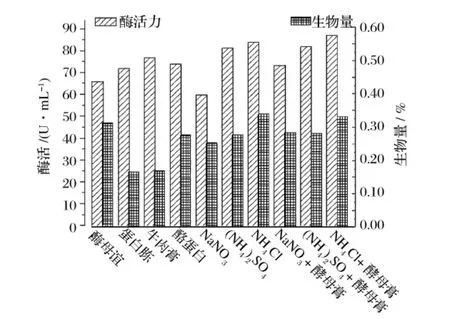
图2 氮源对产酶的影响

图3 初始pH值对产酶的影响
3.1.4 装液量、转速、接种量的影响
从预试验研究发现,装液量、转速和接种量3因素对该菌株产酶影响较大,若装液量过高,摇瓶内溶氧不能满足该菌发酵产酶的需要;若过低则营养物质减少,酶活同样达不到最大值;对于丝状真菌,转速若过高,菌体不易形成菌丝球,若过低则通气量低不适宜生长。因此在单因素试验基础上用正交方法对其进行优化。根据L9(33)正交实验结果的极差值分析,各因素对D5产Dex影响大小依次为转速,装液量,接种量;最佳组合为转速120 r/min,装液量50 mL/250 mL,接种量0.5 mL(1%)。
3.1.5 产酶时间曲线
产酶时间曲线(图4)表明,菌株在培养初始产酶增加,至3 d达到短暂的高峰(73.47 U/mL)后开始下降,至6 d产酶再一次迅速上升,13 d上升至最大值(176.80 U/mL)。因此,以培养13 d为宜,菌株至1 w左右次生代谢产物积累产酶快速上升。

图4 培养时间对产酶的影响
3.2 Dex酶学性质研究
3.2.1 Dex酶解产物分析
酶液催化底物Dextran T70后,采用薄层层析法分析降解的产物,并以标准低聚糖作阳性对照,结果如图5所示,根据迁移率的比较判定,酶解产物仅有异麦芽三糖,分析该右旋糖酐酶为外切型异麦芽三糖水解酶。
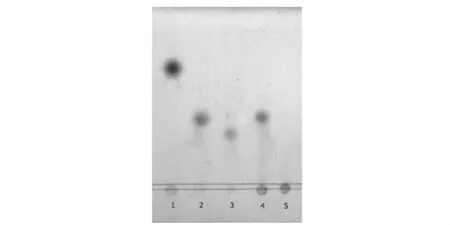
图5 酶解产物的薄层层析图谱
3.2.2 最适作用温度及温度稳定性
以所测最高酶活为100%,图6,图7表明,D5产Dex酶在反应温度55℃下酶活最高,至65℃酶活降至先前的63%;在25~40℃有较好的热稳定性;在50℃酶的半衰期为3 h;在55℃只能保存10 min,保温20 min时酶活降至38%。由此可见该酶可以在55℃有最高的催化效率,只能维持10 min。
3.2.3 最适作用pH值及pH值稳定性
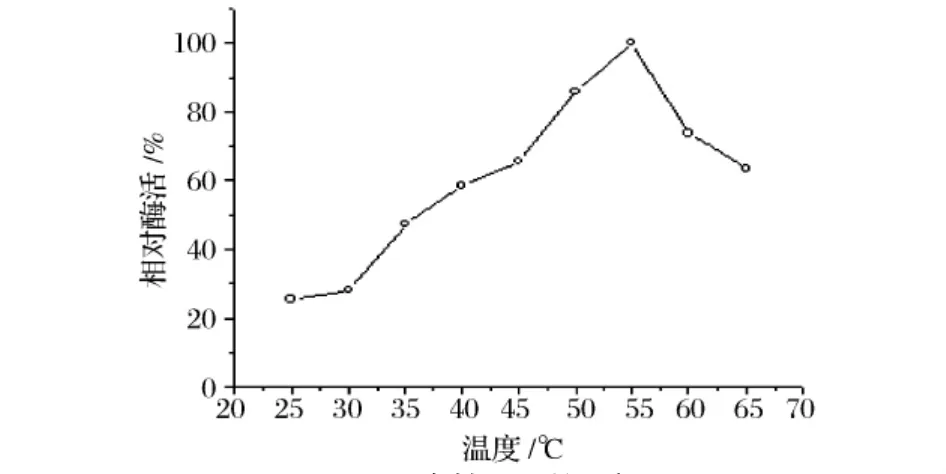
图6 酶的最适温度
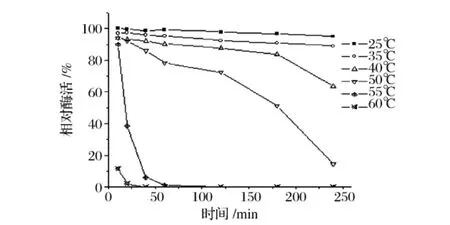
图7 酶的热稳定性
图8 ,图9表明,该Dex酶在酸性条件下酶活较高,pH值6.5时酶活最高;在pH值4~6.5维持83%以上酶活,在pH 5.5时稳定性最好。在最适作用pH值下有良好的稳定性。
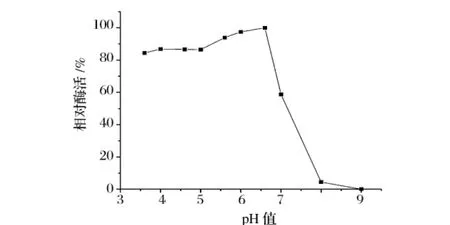
图8 酶的最适pH值

图9 酶的pH值稳定性
3.2.4 金属离子对酶活的影响
以不加金属离子所测酶活为100%,测定了5种金属阳离子对酶活的影响,结果见图10。K+和低浓度的Ba2+对酶活有显著的促进作用;高浓度的Ca2+、Fe2+明显抑制酶活;5 mmol/L的Mg2+对酶活力有促进作用,但随离子浓度增大,酶活下降。
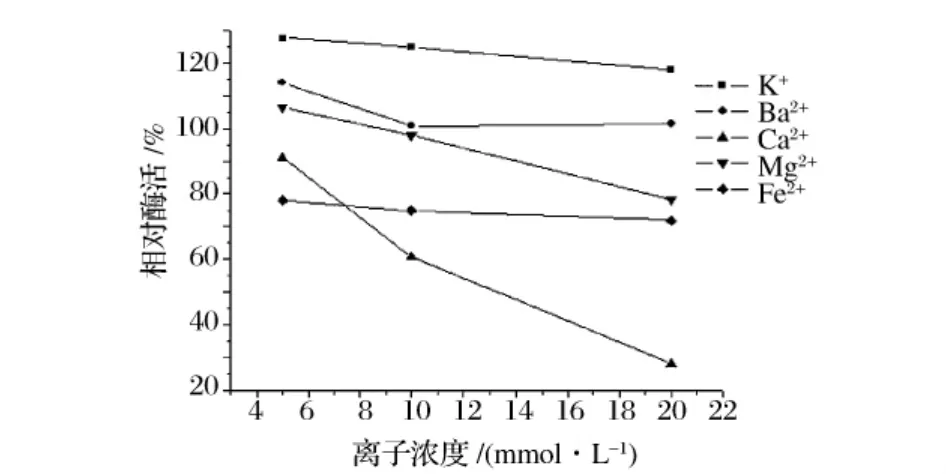
图10 金属离子对酶活的影响
3.2.5 离子强度对酶活的影响
不同浓度NaCl所产生的离子强度对酶活的影响见图11。低浓度的离子对酶活有促进作用,从150 mmol/L起酶活缓慢下降,高浓度的离子抑制酶活。

图11 NaCl离子浓度对酶活的影响
4 结论
本实验分离出的D5菌株为未见报道的产外切异麦芽三糖水解酶的真菌,经形态和分子鉴定为黄绿青霉(另文发表)。经过发酵优化后培养13 d酶活可达到176.80 U/mL。该酶底物专一性很强,对普鲁蓝糖、淀粉和羧甲基纤维素底物没有作用(结果未列),说明只水解连续的α-1,6糖苷键。
许多文献均报道Dex为诱导酶,使用其他可溶性碳源时菌株不产酶或无法高产。Garcia等人证明碳源对Dex酶合成的调控是在转录水平上。mRNA丰度显示了葡聚糖在转录水平上促进Dex基因的表达;而当在培养基中同时加入葡聚糖与葡萄糖时,Dex基因的转录滞后了24 h[13]。提示酶的合成受底物葡聚糖的诱导和葡萄糖的阻遏作用双重调控。Khalikova[1,14]认为,在dexA基因的5'非编码区存在一些序列,其与构巢曲霉(Aspergillus nidulans)葡萄糖阻遏因子CRE A的结合位点相似,有可能受到CRE A同源物的调控。一些产Dex酶菌株的产酶量普遍受到葡萄糖的抑制。但也有例外,Arnold[15]报道申克孢子丝菌(Sporotrix schencki)在用葡萄糖替换葡聚糖作碳源的条件下,产酶提高10倍。
本试验中葡聚糖对D5菌株的产酶有诱导作用,仅使用淀粉、葡萄糖、蔗糖作碳源时菌株产酶明显下降。与大多数已报道菌株不同的是,1%葡萄糖对D5菌株的产酶没有明显阻遏作用,相反1%葡萄糖加1%葡聚糖组合碳源产酶甚至比单独2%葡聚糖作碳源高。可能是少量葡萄糖有利于菌株起始生长,增加生物量,因此产酶优于全葡聚糖作碳源。又由于该酶外切葡聚糖特异性地产生异麦芽三糖,不会增加培养液的葡萄糖浓度,不同于一些文献报道的菌株,其酶解产物是葡萄糖,容易产生阻遏效应。
[1]Khalikova E,Susi P,Korpela T.Microbial dextran-hydrolyzing enzymes:fundamentalsand applications[J].Micorobiology and Molecular Biology Reviews,2005,69(2):306-325.
[2]Aoki H,Sakano Y.A classification of dextran-hydrolyzing enzymes based on amino-acid-sequence similarities[J].Biochem,1997,323:859-861.
[3]Eggleston G,Monge A.Optimization of sugarcane factory application of commercial dextranases[J].Process Biochemistry,2005,40:1881-1189.
[4]蒋丹,仇元新,胡涛,等.口腔链球菌右旋糖酐酶分子结构和功能的研究进展[J].国际口腔医学杂志,2008(3):249-251.
[5]Basan H,Gumusderelioglu M,Tevfik O M.Release characteristics of salmon calcitonin from dextran hydrogels for colon-specific delivery[J].Eur J Pharm Biopharm,2007,65(1):39-46.
[6]Pitarresi G,Casadei M A,Mandracchia D.Photocrosslinking of dextran and polyaspartamide derivatives:a combination suitable for colon-specific drug delivery[J].J Control Release,2007,119(3):328-338.
[7]Finnegan P M,Brumbley S M,O'Shea M G,et al.Isolation and characterization of genes encoding thermoactive and thermostable dextranases from two thermotolerant soil bacteria[J].Current Microbiology,2004,49:327-333.
[8]Kang H K,Kim S H,Park J Y,et al.Cloning and characterization of a dextranase gene from Lipomyces starkeyi and its expression in Saccharomyces cerevisiae[J].Yeast,2005,22:1239-1248.
[9]Sugiura M,Ito A,Yamaguchi T.Studies on dextranase II.New exo-dextranase from Brevibacterium fuscum var dextranlyticum[J].Biochim Biophys Acta,1974,350:61-70.
[10]Pulkownik A,Walker G J.Purification and substrate specificity of an endo-dextranase Streptococcus mutans K1-R[J].Carbohydr Res,1977,54:237-251.
[11]程秀兰,凌嵩,杨敬,等.产碱菌外切异麦芽三糖水解酶的产生和性质[J].微生物学报,1994,34(2):124-130.
[12]Mizuno T,Mori H,Ito H,et al.Molecular cloning of isomaltotrio-dextranase gene from Brevibacterium fuscum var.dextranlyticum strain 0407 and its expression in Escherichia coli[J].Biosci Biotechnol Biochem,1999,63(9):1582-1588.
[13]Garcia B,Rodriguez E.Carbon source regulation of a dextranase gene from the filamentous fungus Penicillium minioluteum[J].Current Genetics,2000,37(6):396-402.
[14]Dowzer C E A,Kelly J M.Analysis of the CreA gene from Aspergillus nidulans:a gene involved in carbon catabolite repression[J].Molecular and Cellular Biology,1991,11:5701-5709.
[15]Arnold W N,Nguyen T B P,Mann LC.Purification and characterization of a dextranase from Sporothrix schenckii[J].Arch Microbiol,1998,170:91-98.
ABSTRACTA strain of Penicillium citreoviride was screened from soil to produce exo-isomaltotriodextranase,which specifically released isomaltotriose as main products from dextran T70.The optimum condition for Isomaltotriodextranase production consisted of 1%starch,1%dextran,0.1%NH4Cl and 0.1%yeast extract,the initial pH for 6.0,1%inoculating quantity,rate of shaking flask with 50 mL liquid in a 250 mL flask was 120 r/min.After fermentation for 13 days at 25℃,the enzyme activity was 176.80 U/mL.The enzyme displayed maximum activity at 55℃.The half-life of the enzyme was3h at 50℃.The optimum pH was pH 6.5,and the enzyme activity was stable from pH4.0~6.5.The enzyme was enhanced by K+and Ba2+,but was inhibited by Ca2+,Fe2+.The enzyme activity could be improved by the ionic strength of NaCl at 150 mmol/L.
Key wordsdextranase,isomaltotriose,Penicillium,enzymatic character
Conditions for Enzyme Production and Enzymatic Characters of Exo-isomaltotriodextranase
Yue Xiao-jing,Dai Ling,Xia Qiang,Wang Jing-jing
(School of Life Science,Anhui University,Hefei 230039,China)
硕士研究生(戴玲为通讯作者,E-mail:dailing2@ah163.com)。
*安徽大学211工程学术创新团队资助项目(02203109)
2010-01-08,改回日期:2010-04-22

