酵母提取液中谷胱甘肽定量测定方法的比较
李从军,谢爱娣
1(湖北生物科技职业学院生物工程系,湖北武汉,430070)
2(湖北工业大学工程技术学院生化系,湖北武汉,430068)
酵母提取液中谷胱甘肽定量测定方法的比较
李从军1,谢爱娣2
1(湖北生物科技职业学院生物工程系,湖北武汉,430070)
2(湖北工业大学工程技术学院生化系,湖北武汉,430068)
对ALLOXAN法、DTNB法和亚硝基铁氰化钠3种方法进行了改进与比较。结果表明,DTNB法用于酵母提取液中谷胱甘肽的测定具有显著优势。研究了不同因素对测定结果的影响,得出了合适的测定条件。DTNB法准确度和精确度良好,回收率和理论回收率无显著差异,且添加甲醛后DTNB法能消除半胱氨酸的干扰,是一种低成本、简单、快速的用于酵母提取液中还原型谷胱甘肽测定的方法。
谷胱甘肽,测定,酵母提取液
谷胱甘肽(GSH)作为细胞内唯一的含巯基的三肽在细胞生物学中发挥着非常关键的作用[1],在食品工业、医药临床和运动营养学上具有广泛的应用。目前谷胱甘肽的生产方法主要有萃取法、发酵法、酶法和化学合成法[2]。由于微生物发酵法与其他方法相比具有明显的优越性,是今后生产谷胱甘肽的主要趋势,也是目前为止最具潜力的方法。而测定发酵提取液中谷胱甘肽是一个复杂的问题,谷胱甘肽稳定性受到温度和pH值等环境因素的限制。此外,生物样品的组成往往十分复杂,其中包括各种蛋白质、氨基酸、多肽及其它非蛋白类物质,这些物质对谷胱甘肽的测定常常有很大的影响。谷胱甘肽的这种不稳定性以及生物样品组成成分的复杂性使得它的检测方法必须具有简单、快速、灵敏、稳定的特点。
测定谷胱甘肽含量的方法有多种,主要包括碘量法、纸层析法、差热分析法、高效液相色谱法、分光光度法、酶法、高效毛细管电泳法、荧光法等。分光光度法具有操作简便、灵敏度较高、不需要特殊的设备等优点,在实验室得到了广泛的应用。本文改进和比较了3种基于巯基反应为原理的分光光度测定法,并对其测定条件进行了详细的研究,建立了一种简便、快速、经济的测定酵母提取液中谷胱甘肽含量的方法。
1 实验材料与方法
1.1 实验材料
1.1.1 菌种
产朊假丝酵母、甜酒酵母、啤酒酵母、安琪酵母、面包酵母、酿酒酵母,由本实验室保藏。
1.1.2 种子和发酵培养基
葡萄糖50 g/L,酵母粉5 g/L,KH2PO42 g/L,Mg-SO41 g/L,pH值自然。
1.1.3 GSH提取液的制备
采用温差破碎法提取细胞内的GSH。取酵母发酵液9 mL,4000 r/min离心5 min,收集菌体,加3 mL去离子水搅拌均匀,-20℃冰冻过夜,沸水浴5 min,6000 r/min离心10 min,上清液即待测的GSH提取液。
1.2 主要试剂
GSH标准品;5,5'-二硫代双(2-硝基苯甲酸)(简称DTNB);四氧嘧啶;亚硝基铁氰化钠;甘氨酸,半胱氨酸;Tris。
1.3 主要仪器
UV-240全波段扫描仪;UNICO UV-2100紫外可见分光光度计;Anke TGL-16G高速冷冻离心机;Mettler AE100分析天平;恒温水浴锅;控温摇床;微量移液枪。
1.4 测定方法
1.4.1 ALLOXAN试剂法
1.4.1.1 试剂
ALLOXAN试剂:称取四氧嘧啶1.0 g,用 0 .1 mol/L的HCl溶液定容至1 L,低温保存;0.1 mol/L甘氨酸溶液;0.24 mol/L磷酸盐缓冲液(pH值7.6);200 mg/L GSH标准液(蒸馏水配置,-80℃保存)。
1.4.1.2 操作步骤
[3],改进后按照表1进行。
1.4.2 DTNB法
1.4.2.1 试剂
0.25 mol/L pH8.0 Tris-HCl缓冲液;φ=0.03甲醛溶液(用NaOH调节pH值8.0);0.01 mol/L DTNB储存液:由DTNB加0.05 mol/L pH值7的磷酸盐缓冲液配制,存于棕色瓶中,放于低温暗处备用;DTNB分析液:由1体积0.01 mol/L DTNB储存液加100体积的0.5 mol/L、pH值8.0的Tris-HCl缓冲液配制而成,现用现配;200 mg/L GSH标准液(蒸馏水配置,-80℃保存)。

表1 ALLOXAN试剂法操作步骤
1.4.2.2 操作步骤
按参考文献[4],略作改进后按表2进行。

表2 DTNB法操作步骤
1.4.3 亚硝基铁氰化钠法
1.4.3.1 试剂
亚硝基铁氰化钠试剂:称取亚硝基铁氰化钠1.5 g,溶于饱和硫酸铵溶液中使成100 mL,此试剂仅能保存1 w;固体硫酸铵;8 mol/L NH4OH;200 mg/L GSH标准液(蒸馏水配置,-80℃保存)。
1.4.3.2 操作步骤
按参考文献[3]改进后,按表3进行。

表3 亚硝基铁氰化钠法操作步骤
2 实验结果与讨论
2.1 三种测定方法的比较
采用3种方法测得的谷胱甘肽在不同浓度时的反应曲线如图1所示,对其进行回归分析,得到相应的标准曲线方程(见表4)。ALLOXAN法和DTNB法标准曲线的相关系数较高,R2均能够达到0.99以上,线性相关性良好;而亚硝基铁氰化钠法相关系数较低,仅为0.944,线性相关性较差。产生这种现象的原因是因为亚硝基铁氰化钠法显色后很不稳定,吸光值很快就下降,在测定的过程中就可见明显下降,这给读数带来很大误差。
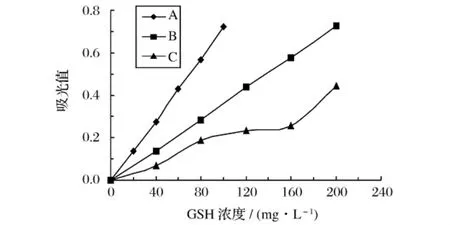
图1 谷胱甘肽在不同浓度时的反应曲线

表4 三种谷胱甘肽测定方法标准曲线的回归方程
在显色稳定性实验中,考察了吸光值随时间的变化情况。表5中列出了用3种方法测定一定浓度的GSH标准液时,吸光值随时间的变化。结果表明,在亚硝基铁氰化钠法中,GSH在反应显色后生成的色泽很不稳定,显色后吸光值在30 s即见明显降低,因此要求在尽可能短的时间内完成测定,而且吸光值在测定过程中不停变动,这给操作的平行性带来很大的难度。ALLOXAN试剂法中,反应显色后30 min以内吸光值未见降低,显色稳定。DTNB法反应显色后能保持稳定20 min。
尽管,ALLOXAN法和DTNB法对标准品的测定都有很好灵敏度、线性相关性和显色稳定性,但是由于ALLOXAN法测定波长在305 nm,酵母提取液中的很多物质(如核酸吸收波长260 nm,蛋白质吸收波长280 nm)吸收波长与305 nm非常接近,对测定会有很大干扰。此外,半胱氨酸与ALLOXAN试剂反应生成的产物在275 nm也有吸收,而且四氧嘧啶本身在305 nm也有少量吸收。因此,在测定酵母提取液中GSH时,ALLOXAN显示出很多不足,而且要减去四氧嘧啶本身的背景吸收,操作起来比较繁琐。DTNB法测定波长在412 nm,可以避免核酸、蛋白质吸收对测定的干扰,而且DTNB本身在412 nm处也没有吸收、操作简便、不需要贵重设备,在测定酵母提取液中谷胱甘肽含量上显示出很大的优势。综合考虑上述因素,选择DTNB法作为实验的测定方法,并对DTNB法作了详细的研究,确定了DTNB法的具体操作条件。

表5 三种谷胱甘肽测定方法显色稳定性
2.2 DTNB法测定酵母提取液中谷胱甘肽含量
2.2.1 显色剂DTNB的用量对体系吸光度的影响
将DTNB储存液配制成浓度分别为(0.4、0.6、0.8、1.0、1.2、1.6、2.0)×10-4mol/L DTNB分析液,测定不同浓度DTNB分析液作为显色剂时体系的吸光度,其余条件均相同。显色剂用量与体系吸光度之间的关系见图2。
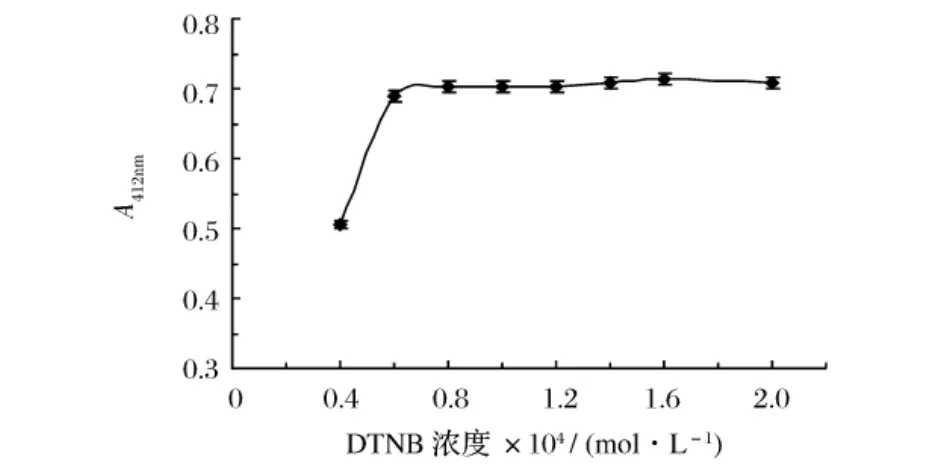
图2 不同DTNB浓度的吸光值
由图2可知,随着显色剂DTNB浓度的增加,体系在412 nm处的吸光度也随之增加,当用量达到0.8×10-4mol/L以后,体系的吸光度基本保持不变。浓度过低,谷胱甘肽不能完全显色;浓度过高,会造成药品的浪费。故实验中选择DTNB分析液的浓度为1.0×10-4mol/L。
2.2.2 显色体系稳定性
取0.5 mL 200 mg/L GSH标准溶液,按DTNB法操作,与甲醛反应2 min后加入2.5 mL分析液,迅速混匀测定不同时间的吸光值,结果见图3。由图3可知,显色反应1.5 min达到最大值,显色体系在1.5~20 min内吸光度基本稳定,超过20 min后,吸光度开始逐渐下降,考虑到由于冬夏室温变化,加入试剂水浴后吸光值达最大所需要的时间可能会有差异,故实验中选择5 min为显色时间,在20 min内完成试样的测定。
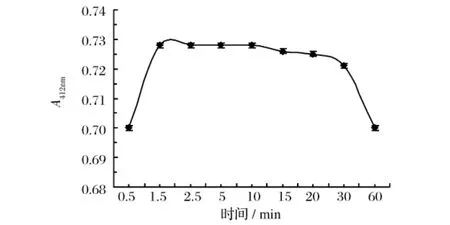
图3 不同显色时间下DTNB法吸光值
2.2.3 标准品和提取液扫描图谱
分别对标准品和提取液进行200~500 nm波段扫描,由扫描图(图4)可知,标准品和提取液最大吸收峰均在412 nm,提取液中还存在260~280 nm的核酸与蛋白的吸收峰,但与412 nm相差较远,不会干扰测定结果。
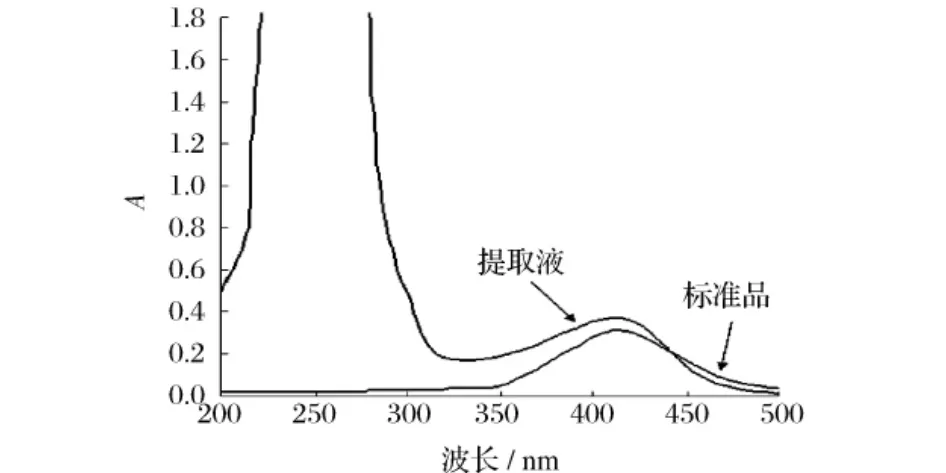
图4 标准品和提取液紫外-可见分光光度计扫描图
2.2.4 标准曲线的制作
按照表2测定不同浓度谷胱甘肽显色后的吸光值,如图1(B),对测定结果进行回归分析得标准曲线方程为y=272.99x+1.5859,相关系数R2=0.9997,说明GSH浓度在0~200 mg/L与412 nm吸光值呈良好线性关系。
2.2.5 半胱氨酸对谷胱甘肽测定的干扰试验
半胱氨酸为谷胱甘肽合成的前体,而且酵母提取液中还存在一些其他的含巯基的物质,这些物质的巯基也能和DTNB反应。本方法根据甲醛与半胱氨酸和GSH反应速率的不同,采用合适的甲醛浓度来消除半胱氨酸等含巯基的化合物对GSH测定的干扰。
2.2.5.1 甲醛同Cys和GSH反应速率
半胱氨酸标准溶液(约1 g/L)和GSH标准溶液(200 mg/L),按照DTNB法分别与φ=0.03甲醛反应不同时间后测定吸光度,以水代替甲醛作为对照。

表6 甲醛同Cys和GSH的反应速率
由表6可知,甲醛与半胱氨酸反应较快,而与谷胱甘肽反应较慢。3%的甲醛在2 min之内,几乎将半胱氨酸完全掩蔽,而谷胱甘肽受影响很小。本文选用φ=0.03的甲醛反应2 min作为反应条件。在此条件下,浓度高达1 g/L的半胱氨酸98%被掩蔽,而仅有1%的GSH被掩蔽,半胱氨酸的存在不会影响GSH的测定。
2.2.5.2 Cys共存时GSH含量分析
各取适量的GSH标准溶液和半胱氨酸标准溶液,按DTNB法测定表7中的样品,同时以等体积水代替其中的半胱氨酸标准溶液作为空白对照。(A样品-0.010)/A对照值与1.00无显著差异,说明在半胱氨酸共存时本分析方法可行。
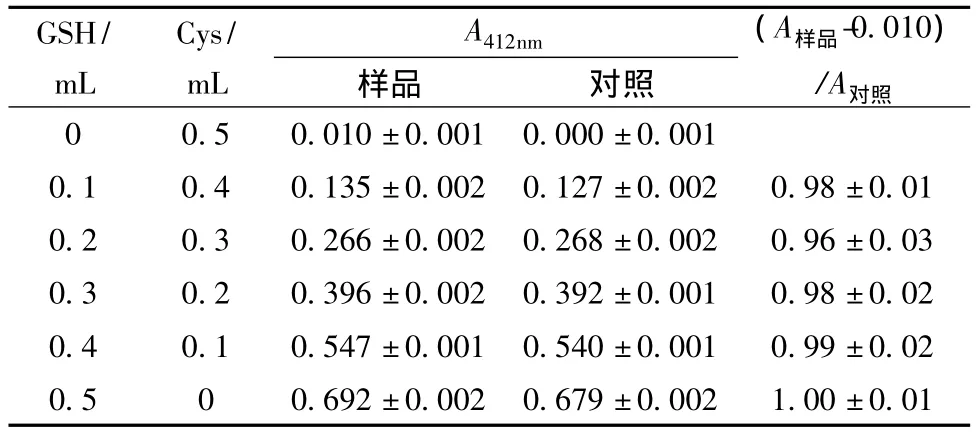
表7 Cys共存时GSH含量分析
2.2.6 测定方法的准确度和精确度
为了考察方法的准确度和精密度,同一酵母提取液样品重复测定8次,计算相对误差和相对标准偏差,由表8可知相对误差和相对标准偏差都很小,方法的准确度和精确度都是令人满意的。

表8 DTNB法相对误差和相对标准偏差
2.2.7 回收率试验
在试样中,加入一定量的待测标准物质,然后与原试样同时进行测定,测得结果之差应等于加入的标准物质的量。通过回收率的测定,可以检验方法的准确度和试样所引起的干扰误差。对不同酵母提取液样品进行了回收实验,回收率按下式计算[5]:
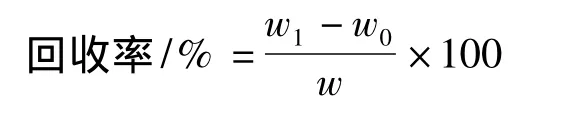
式中,w0为试样中原有GSH的含量;w为试样中加入标准GSH的含量;w1为试样中加入标准GSH后测得的被测物的含量。
采用不同酵母提取液进行了回收率试验,结果见表9。由表9可知,不同酵母提取液,谷胱甘肽回收率在97.254%~101.14%。回收率在置信度95%下经t检验,与理论回收率无显著差异。回收率平均值99.580,t=0.546﹥0.05,与理论回收率100%无显著差异,标准偏差=1.588151。

表9 DTNB法回收率
3 结论
对3种测定谷胱甘肽的方法进行了改进和比较,综合各方面的原因考虑,认为DTNB法对于测定酵母提取液中谷胱甘肽含量具有明显的优势。对DTNB法测定方法的条件进行了研究,其线性度良好,准确度、精确度都很高,平均回收率达到99.58%,与理论回收率无显著差异。且添加甲醛后,DTNB法能消除半胱氨酸等杂质的干扰,是一种简便、经济的用于酵母提取液中还原型谷胱甘肽测定的方法。
参考文献
[1]Heather Jefferies,Jane Coster,Alizan Khalil,et al.Glutathione[J].ANZ Surg,2003,73:517-522.
[2]蔡俊.谷胱甘肽的研究进展[J].粮食与饲料工业,2000(10):41-42.
[3]上海医学化验所.临床生化检验(上)[M].上海:上海科技出版社,1979:86-88.
[4]赵旭东,魏东芝,万群,等.谷胱甘肽的简便测定法[J].药物分析杂志,2000,20(1):34-37.
[5]天津轻工业学院,无锡轻工业学院,大连轻工业学院编著.工业发酵分析(续篇)[M].北京,中国轻工业出版社,1997:3-14.
ABSTRACTThree kinds of determination methods of glutathione were introduced and evaluated.The results showed that the DTNB method had remarkable advantages in determining glutathione of yeast extraction.The influencing factors of determination were studied and the optimum determination conditions were acquired.This method showed good veracity and precision,and had no statistically significant difference compared with theoretical recovery rate.DTNB method can avoid the disturbance of cysteine and is a simple,fast and economic method.
Key wordsglutathione,determination,yeast extraction
Comparative Study on Quantitative Determination Method of Glutathione in Yeast Extraction
Li Cong-jun1,Xie Ai-di2
1(Department of Bioengineering,Hubei Vocational College of Bio-Technology,Wuhan 430070,China)
2(Department of Biochemistry,College of Engineering and Technology,Hubei University of Technology,Wuhan 430068,China)
硕士研究生。
2010-02-06,改回日期:2010-04-08

