酸菜中荚膜酵母产辅酶Q_(10)前体物质添加优化培养条件的研究
魏宝东,马明慧,崔玉灿
(沈阳农业大学食品学院,辽宁沈阳110161)
酸菜中荚膜酵母产辅酶Q_(10)前体物质添加优化培养条件的研究
魏宝东,马明慧,崔玉灿
(沈阳农业大学食品学院,辽宁沈阳110161)
选用酸菜中的荚膜酵母为出发菌株,通过培养基的优化来提高辅酶Q10产量。研究不同的碳源、氮源、前体物质添加对辅酶Q10产量的影响。确定了菌种最佳培养时间为48h,最佳培养基组成为蔗糖4%、酵母浸粉4%、NaCl 0.5%,pH7.0,辅酶Q10产量最大,为46.32mg/L。当添加对羟基苯甲酸浓度为1.2mg/L时,辅酶Q10含量达到最大,为49.58mg/L,比不添加时含量增加了7%。
辅酶Q10,优化,前体物质
Abstract:Selecting sauerkraut as starting yeast strains,the production of coenzyme Q10was improved through the optimization of the culture medium.The influences of different carbon resources,nitrogen resources and precursor substances on the yield of coenzyme Q10were studied.The optimum medium composition was as follows:4%sucrose,4%yeast powder Baptist,0.5%NaCl,pH7.0.The best cultivating time was 48h.The maxium production of Coenzyme Q10was 46.32mg/L.Adding 1.2mg/L of p-hydroxybenzoate to the culture medium,the maxium production of Coenzyme Q10reached 49.58mg/L,which was 7%more than without adding.
Key words:coenzyme Q10;optimization;precursor substances
辅酶Q10,俗称泛醌,维生素的一种,广泛存在于大自然的很多生物体中。辅酶Q10是人体不可缺少的一种辅酶,能作为代谢活性剂激活细胞呼吸、加速呼吸链的产能过程;对心脏、肝脏和肾有良好的保健作用,可预防动脉硬化、中风和高血压;其次还有抗肿瘤和提高免疫力作用,另外还有延缓皮肤衰老的作用[1]。辅酶Q10作为生物体内细胞产生能量的重要酶以及重要代谢反应的底物,具抗肿瘤、抗氧化性,以及作为细胞代谢激活剂,可提高人体免疫力和治疗人体免疫系统疾病,特别在心血管疾病治疗中有重要作用。因此,辅酶Q10可作为一种新型的具有重大医学价值的生化药物或可开发作为保健食品的良好材料[2]。随着对辅酶Q10应用研究的不断深入,其应用范围及其产品开发会进一步发展,辅酶Q10产品的研究生产一定会有美好的前景。相比于动植物组织提取法、化学合成法、植物细胞培养法等生产方式,微生物发酵法比较经济,易于大规模生产、分离纯化,且产品活性好、易被人体吸收,是一种最有前途的方法。迄今为止,国内外报道的辅酶Q10产生菌主要有酵母菌和细菌[3]。本文选用酸菜中的荚膜酵母为出发菌株生产辅酶Q10,通过对培养条件的优化来提高辅酶Q10的产量,以期为工业化生产提供理论依据。
1 材料与方法
1.1 材料与仪器
酸菜荚膜酵母菌 本实验室保存;种子培养基(g/L) 蔗糖20、酵母浸粉 20、NaCl 5、蒸馏水 1,pH7.0;斜面培养基(g/L) 琼脂20、蔗糖20、酵母浸粉20、NaCl 5、蒸馏水 1,pH7.0;发酵培养基(g/L)蔗糖40、酵母浸粉 20、蛋白胨20、NaCl 5,pH7.0。
旋转蒸发仪、紫外分光光度计 沈阳农业大学设备科。
1.2 实验方法
1.2.1 培养方法 在250mL锥形瓶中倒入50mL种子培养基,于0.7×105Pa,115℃条件下灭菌30min。然后从斜面培养基接种倒入锥形瓶中,于27℃,170r/min条件下培养48h,作为种子液。同样装有50mL发酵液的锥形瓶,高压灭菌后接种,接种量为10%。放入恒温摇床中,27℃,170r/min条件下发酵培养。
1.2.2 辅酶Q10标准曲线的绘制 准确称取2.0mg辅酶Q10标准样品,用无水乙醇定容至100mL,配成质量浓度为0.02mg/mL 标准溶液。分别移取 1、2、3、4、5、6、7、8、9mL该标准溶液到10mL 容量瓶中,用无水乙醇定容至10mL,在辅酶Q10最大吸收波长275nm下测定其吸光度。
1.2.3 菌种干重的测定 将称量瓶预先在烘箱105℃烘1d至干重,取10mL发酵液4000r/min离心30min,收集沉淀,用无菌水洗涤一次,将洗涤后的沉淀用无菌水洗入称量瓶,将称量瓶和菌体在50℃烘箱中干燥至恒重后放入干燥器中,冷却30min,称量,并计算菌体干重[4]。
1.2.4 菌体最佳培养时间的确定 在种子培养过程中,每隔4h测定菌体干重并计算发酵液中菌体的浓度,绘制生长曲线。
1.2.5 碳源对发酵产辅酶Q10的影响 基本培养基2%酵母浸粉,0.5%NaCl,pH=7.0;碳源分别为葡萄糖、蔗糖、麦芽糖、可溶性淀粉,浓度均为4%。在基本培养基中添加不同的碳源配成发酵培养基,接种后摇床培养96h,测定菌体干重和辅酶Q10含量并确定最佳碳源。
1.2.6 氮源对发酵产辅酶Q10的影响 基本培养基2%蔗糖,0.5%NaCl,pH=7.0;氮源分别为蛋白胨、酵母浸粉、牛肉膏、玉米浆,浓度均为4%。在基本培养基中添加不同的氮源配成发酵培养基,接种后摇床培养96h测定菌体干重和辅酶源Q10含量,并确定最佳氮源。
首先确定最佳碳源和最佳氮源,最佳浓度即可确定;再进行碳、氮源正交实验,以确定最佳配比[5]。
1.2.7 对羟基苯甲酸对辅酶Q10含量的影响 在优化培养基中添加对羟基苯甲酸浓度分别为0、0.4、0.8、1.2、1.6、2.0mg/L,发酵48h后测菌体干重和辅酶 Q10的含量。
1.2.8 辅酶Q10提取方法 摇床结束后取50mL发酵液,4000r/min离心30min,收集菌体,用蒸馏水充分洗涤。将菌体移入150mL圆底烧瓶内,加入0.7g焦性没食子酸,2.5g氢氧化钾,19mL甲醇,7mL蒸馏水,混匀。在90℃水浴锅中回流30min,用自来水迅速冷却至室温,倒入分液漏斗,加入石油醚40mL,剧烈振荡5min,萃取辅酶Q10,连续萃取3次,合并萃取液,用自来水洗涤至中性,加入5g无水硫酸钠,干燥至液体澄清。用旋转蒸发仪(50℃)浓缩至干,挥发完全,加入5mL无水乙醇,放入冰箱冷冻析出胆固醇等杂质,过滤定容至 100mL,待测[6]。
1.2.9 发酵菌体中辅酶Q10含量的测定 在275nm下测定辅酶Q10吸光度(A),根据标准曲线计算其中辅酶Q10的含量。
2 结果与分析
2.1 辅酶Q10标准曲线的绘制
辅酶Q10的标样为实验室保存。如图1所示,在相同的吸光度条件下,测定不同浓度的标准溶液中辅酶Q10的吸光度。因标准溶液中辅酶Q10的含量不同,所以测出的吸光度大小是不同的,根据吸光度的大小绘制出标准曲线,再根据标准曲线去测定本实验选用的酸菜荚膜酵母产辅酶Q10的含量。
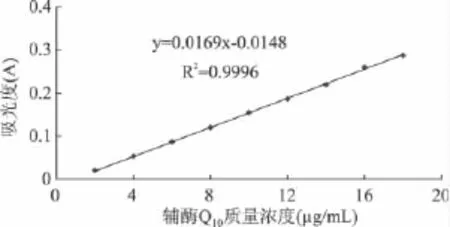
图1 标准曲线
2.2 菌体最佳培养时间的确定
菌体干重在12h以前产量不高,12h后细胞生长速率明显加快,由图2可以看出,48h时菌体干重达到最大值100.78g/L。通常选择到达稳定期前2h的阶段作为最佳菌体培养时间,因为这一阶段是菌体生长对数期,菌体的生长速率常数最大,细胞平衡生长,酶系活跃,代谢旺盛,可作为发酵生产的良好种子。故确定48h为最佳培养时间。
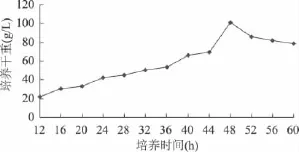
图2 菌体生长曲线
2.3 不同碳源对发酵产辅酶Q10的影响
由图3可看出,蔗糖作为碳源效果是最好的,产量最高,其次是葡萄糖,辅酶 Q10含量分别为41.02mg/L和33.11mg/L,菌体干重分别为98.9g/L和64.7g/L;以麦芽糖和可溶性淀粉作为碳源所产辅酶Q10含量较少,干重也较小。故确定以蔗糖作为发酵碳源。

图3 不同碳源对发酵产辅酶Q10的影响
2.4 蔗糖浓度对发酵产辅酶Q10的影响
以不同的蔗糖浓度配制发酵液,从而确定蔗糖的最佳浓度。由图4可看出,随着发酵液中蔗糖浓度的升高,辅酶Q10产量随之升高,在40g/L时辅酶Q10产量达到最大值 41.023mg/L,菌体干重达到98.94g/L;之后蔗糖浓度再升高,辅酶Q10含量反而下降,干重也跟着减小。故确定蔗糖的最佳浓度为40g/L。
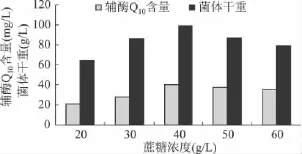
图4 蔗糖浓度对发酵产辅酶Q10的影响
2.5 不同氮源对发酵产辅酶Q10的影响
本实验用了4种氮源进行比较,分别为蛋白胨、酵母浸粉、牛肉膏、玉米浆。由图5可看出,当选择酵母浸粉作为培养基氮源时,辅酶Q10含量最高,为44.71mg/L,菌体干重为99.52g/L;其次是蛋白胨,牛肉膏和玉米浆较差。故选择酵母浸粉作为发酵培养基的氮源。

图5 不同氮源对发酵产辅酶Q10的影响
2.6 酵母浸粉浓度对发酵产辅酶Q10的影响
在培养基中添加不同浓度的酵母浸粉,测定不同浓度条件下辅酶Q10含量和菌体干重,从而确定酵母浸粉的最佳浓度。由图6可以看出,随着酵母浸粉浓度的升高,辅酶Q10含量升高。当酵母浸粉浓度为40g/L时,辅酶 Q10含量最高,为44.71mg/L,菌体干重为99.52g/L;之后,随着浓度的升高,辅酶Q10的含量和干重都减小。故酵母浸粉的最佳浓度确定为40g/L。
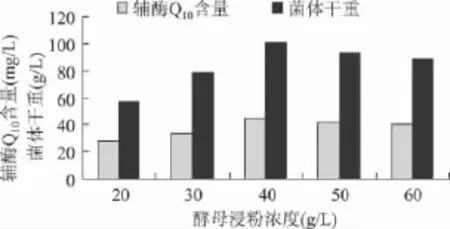
图6 酵母浸粉浓度对发酵产辅酶Q10的影响
2.7 碳氮源最佳配比的选择
通过单因素实验确定出最佳碳、氮源浓度,且碳、氮源同时加入培养基中还会产生相互作用,从更全面的角度考虑,混合的碳、氮源也许更适合菌种的生长。因此,本实验选用了两种不同的碳源,蔗糖和葡萄糖;两种不同的氮源,酵母浸粉和蛋白胨,进行了正交实验,见表1~表3,以确定碳源和氮源的最佳配比,其结果如表2所示。

表1 因素水平表

表2 碳氮源浓度对发酵产辅酶Q10的影响

表3 方差分析表
由表2可知,影响辅酶Q10含量的因素依次为蔗糖>酵母浸粉>葡萄糖>蛋白胨,并且蔗糖、酵母浸粉的极差显著。由表2数据可知,最优方案为A3B3C3D3,当培养基组成为蔗糖4%、酵母浸粉4%时辅酶Q10含量最大,为46.32mg/L。可初步确定在此碳氮浓度配比下发酵产辅酶Q10效果最好。
2.8 对羟基苯甲酸对辅酶Q10含量的影响
由辅酶Q10的生物合成途径可知:对羟基苯甲酸是辅酶Q10合成途径中醌环核心的前体物,它与聚异戊烯基焦磷酸结合,最终生成辅酶Q10。而对羟基苯甲酸作为常用防腐剂对菌体本身有毒害作用,因此针对此矛盾可以设想一定存在一个对羟基苯甲酸的最佳作用浓度,使得在保证菌体生物量有较高值时辅酶Q10的含量达到最大,本节即对对羟基苯甲酸对酵母菌生物量和辅酶Q10合成的影响做了研究。
在优化培养基中添加对羟基苯甲酸浓度分别为0、0.4、0.8、1.2、1.6、2.0mg/L,发酵 48h 后测菌体干重和辅酶Q10的含量,结果如图7。
由图7可以看出,添加对羟基苯甲酸后,菌体干重比不添加前普遍增加。当对羟基苯甲酸浓度为0.8mg/L时,菌体干重达到116.98g/L,直到对羟基苯甲酸浓度为1.6g/L时,菌体干重均维持在116g/L左右,继续增加对羟基苯甲酸浓度,菌体干重开始下降。而辅酶Q10的含量随着对羟基苯甲酸浓度的增加呈先下降再升高而后又降低的趋势。当添加浓度为1.2mg/L时,辅酶Q10含量达到最大为49.58mg/L,比不添加时含量增加了7%。这说明在一定浓度范围内,对羟基苯甲酸有利于酵母菌的生长,并促进辅酶Q10的合成。

图7 对羟基苯甲酸对辅酶Q10发酵的影响
3 结论
确定了菌种最佳培养时间为48h,菌体干重为100.78g/L,最佳碳氮源配比为蔗糖4%、酵母浸粉4%,辅酶Q10含量最大为46.32mg/L。添加对羟基甲酸后,辅酶Q10的含量随着对羟基苯甲酸浓度的增加呈先下降再升高而后又降低的趋势。当添加浓度为1.2mg/L时,辅酶Q10含量达到最大,为49.58mg/L,比不添加时含量增加了7%。
[1]吴祖芳,翁佩芳,陈坚.辅酶 Q10的功能研究进展[J].宁波大学学报:理工版,2001,14(2):85-88.
[2]齐继成.辅酶 Q10保健品的开发应用[J].中国保健食品,2002,15(6):15-16.
[3]张艳静,袁启鹏,梁浩.产辅酶Q10酵母发酵条件的研究[J].微生物学通报,2003,30(2):65-69.
[4]郝素丽,吴越,徐康.测定辅酶 Q10方法的研究[J].中国生化药物杂志,1998(4):167-171.
[5]袁婧,魏宏.光合细菌产辅酶Q10发酵条件的研究[J].氨基酸和生物资源,2003,25(2):24-26.
[6]王春林.辅酶 Q10的提取、分离、鉴定[J].中国医药工业杂志,1996,27(3):102-104.
Study on adding precursor substances to optimize culture conditions of coenzyme Q10produced by yeast during fermentation process
WEI Bao-dong,MA Ming-hui,CUI Yu-can
(Food College,Shenyang Agricultural University,Shenyang 110161,China)
TS255.1
A
1002-0306(2010)08-0183-04
2009-07-20
魏宝东(1969-),男,副教授,研究方向:食品制造与保藏。

