农杆菌介导转化蝴蝶兰遗传体系的研究
郝曜山,杜建中,孙毅
(山西省农业生物技术研究中心,山西 太原 030031)
近年来,基因工程的蓬勃发展为花卉品质的基础研究和育种带来了全新的思路和途径。人们将所钟意的特性的有关外源基因利用各种基因工程手段转入植物细胞获得再生植株,以期获得带有目的性状的转基因花卉新品系[1]。蝴蝶兰(Phalaenopsis)作为在国内外市场最受欢迎的花卉之一,近年来市场需求持续上升,世界各国均对蝴蝶兰的快速繁殖和新品种选育技术进行广泛、深入的研究[2]。
但由于兰科植物同单子叶植物一样对农杆菌侵染不敏感,组织培养也有一定的难度,目前的转化方法仍多采用粒子轰击法[3]。笔者在本研究中通过农杆菌侵染类原球茎体,并在侵染前后辅以超声波及负压处理,以gus为报告基因,用卡那霉素为筛选压进行选择,获得了转化株,并初步建立了农杆菌介导转化蝴蝶兰的遗传体系。
1 材料和方法
1.1 受体材料
植物材料为蝴蝶兰品系ΔB-5,由山西省农科院园艺研究所提供。我们转化所用的受体材料为其花梗腋芽在2/3MS培养基+6-BA 3 mg·L-1+NAA 0.5 mg·L-1+2 g·L-1胰蛋白胨上于(25±3)℃,光照条件不超过2000 lx培养条件下所诱导的类原球茎 (PLB),最好继代1~2次的材料。
1.2 供体材料
将所提取的质粒pBI121通过热击法转入农杆菌LBA4404中。其中有在植物中筛选基因Nos-NPTⅡ和报告基因35S-gus。供试菌的转化制备及质粒的提取参考 《植物基因工程》[4]。
1.3 转化方法及检测
1.3.1 将附有质粒p BI121的农杆菌在含利福平(50 mg·L-1)和卡那霉素 (50 mg·L-1)的YEP液体培养基中,于28℃震荡培养过夜,培养至对数期 (OD600=0.3~0.6),后在4000 g·min-1转速、室温下离心5 min收集菌体,并将菌体用重悬培养基悬浮 (OD600值在0.5左右),在侵染前向重悬液中加入乙酰丁香酮 (AS)100 μmol·L-1[5];
1.3.2 将PLB浸入无菌水中进行超声波处理,处理的参数为频率25 k Hz,强度400 W,时间为100 s;将PLB取出浸没在预先准备好的菌液中,并在负压50 k Pa压力下侵染20 min左右;侵染结束后,用吸水纸快速吸净PLB上多余的菌液,在超净工作台上将侵染过的PLB转移到继代培养基上,然后置于200~600 lx弱光照条件下继续共培养3~4 d。
1.3.3 将共培养的PLB转接到含200 mg·L-1头孢的继代培养基上,于1000~2000 lx光照下培养30 d后挑选新鲜的PLB转移到500 mg·L-1卡那霉素的选择培养基上,继代培养2~3代。
1.3.4 对存活的PLB进行gus染色观察统计[4];并将其接种到含有200 mg·L-1卡那霉素的生根培养基上;60 d后取其叶片进行PCR检测 (提取DNA的方法为CTAB法,参照 《基因工程学原理》)[1]。
2 结果与分析
2.1 蝴蝶兰类原球茎继代培养基条件优化
具有高效稳定的再生能力的受体材料是蝴蝶兰遗传转化成功的关键。由于在转化过程中的一些处理,如农杆菌侵染、超声波负压处理、机械损伤及抗生素的筛选都会使转化的PLB比非转化的PLB的再生频率不同程度的降低[6,7],因此,PLB受体系统必须具有较强的再生能力,只有这样,转化的PLB才能进一步脱分化和再分化。将蝴蝶兰原球茎转接在设置的培养基上,50 d后调查其生长情况,结果见表1。
由表1可见,当6-BA为3 mg·L-1、NAA为0.5 mg·L-1时,蝴蝶兰类原球茎具有较好的增殖效果,增殖系数达4.8。
另外,在笔者在研究中发现,2/3MS培养基+2 g·L-1胰蛋白胨并辅以1000~2000 lx的光照培养条件下所诱导的类原球茎 (PLB)的再生能力较强。含1/3MS培养基+NAA 0.1 mg·L-1+IBA 0.1 mg·L-1+胰蛋白胨2 g·L-1+150 g·L-1的香蕉泥有利于蝴蝶兰原球茎快速生根[8]。

表1 不同激素配比对蝴蝶兰原球茎增殖的影响 (接种数均为30,其中增殖系数为增殖量/接种数)Table 1 Effects of 6-BA and NAA on proliferation from Phalaenopsis PLB(Inoculant number:30;rate of proliferation=proliferation number/inoculant number)
2.2 农杆菌菌液浓度对转化的影响
从图1可以看到蝴蝶兰类原球茎在被OD600值为0.3菌液侵染后 gus转化瞬时表达率最高,并在OD600值0.3~0.6之间的菌液侵染后gus转化瞬时表达率差异不明显,OD600值0.7之后呈快速下降趋势。所以我们选用在对数生长期的OD600值为0.3~0.6的农杆菌作为侵染体。
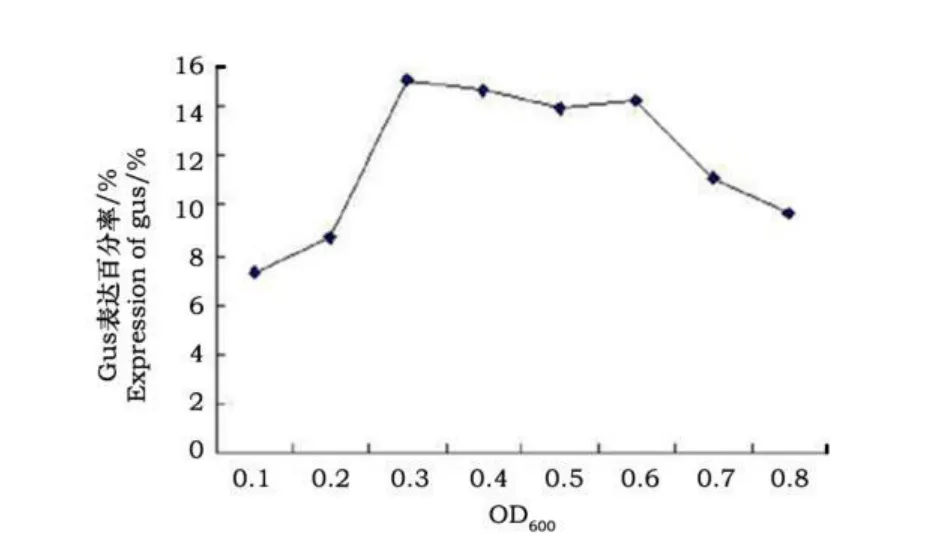
图1 农杆菌菌液浓度对转化的影响Fig.1 Effects of different bacterium concentrations onexpression of gus
2.3 超声波及负压处理对转化的影响
将在表2中不同处理的PLB在500 mg·L-1的卡那霉素条件下筛选30 d后进行gus组织化学分析染色。在各个处理中均检测到 gus的表达,其染色阳性率均达20%以上。而在侵染前进行超声波预处理,会很大程度上提高转化效率。若侵染是在负压下进行,而没有进行超声波预处理则转化效率与对照相比略有提高。另外,我们发现超声波预处理和在负压下侵染二者之间存在交互影响,若同时处理将会更大程度上提高转化效率。但是我们也发现,超声波与负压处理与对照相比会大大降低PLB的生根与成苗的百分率,如何提高这两种处理后PLB的生根和成苗率,有待进一步的研究。

表2 不同处理对转化的影响Table2 Effect of treatment methods on the transformation efficiency
2.4 蝴蝶兰ΔB-5的PLB对卡那霉素的敏感性
将蝴蝶兰 ΔB-5的PLB置于含100 mg·L-1、200 mg·L-1、300 mg·L-1、400 mg·L-1和500 mg·L-1卡那霉素的2/3MS培养基上培养50~60 d。结果表明,蝴蝶兰ΔB-5的PLB在卡那霉素浓度达到400 mg·L-1时仍有45%正常存活,在卡那霉素浓度达到500 mg·L-1仅有不到5%的存活率。试验证明蝴蝶兰对卡那霉素具有较强的耐受性。固在其后的转化实验中,我们选定500 mg·L-1卡那霉素浓度作为筛选浓度,以减少假阳性抗性PLB及嵌合体PLB的获得。
2.5 转化植株的PCR检测结果
处理的249个PLB经过60~90 d的筛选培养后,共获得69个卡那霉素抗性PLB(包括在筛选压下新生的PLB),将其转移至含1/3MS培养基+NAA0.1 mg·L-1+IBA0.1 mg·L-1+胰蛋白胨2 g·L-1+150 g·L-1香蕉泥+200 mg·L-1的卡那霉素培养基上诱导植株再生,共获得50株再生蝴蝶兰 (其中有6株为丛生状),3~4叶时取其部分顶端叶片提取DNA进行PCR检测分析。其中有17株呈阳性,在对照植株中未扩增出此条带 (见图2)。
3 结论与讨论

图2 部分转化植株的PCR琼脂糖凝胶电泳图Fig.2 PCR result of CaMV 35S from transformed Phalaenopsis.
目前,转基因蝴蝶兰选育大多采用原球茎,类原球茎,或非胚性愈伤组织为试材,采用原球茎,类原球茎作为受体材料虽然继代培养相对容易,再生能力强,但由于未经过中间的愈伤组织发生过程,而使得对选择药剂有抗性的再生材料所发育获得的转化株多为嵌合体[9];而采用非胚性愈伤组织虽然易获得完全转化株,但蝴蝶兰非胚性愈伤组织在固体培养基上易白化死亡,浸染后存活率较低,且长成植株后其一些好的特性易发生改变[10]。这都使得蝴蝶兰的基因转化不易操作,在本研究中,笔者用蝴蝶兰品系ΔB-5采用卡那霉素作为筛选元件,对蝴蝶兰的类原球茎采用多次继代选择方法,有效控制了嵌合体的产生。在实验中,我们在对蝴蝶兰逐代继代培养中用GUS检测中也证实了这种情况。
另外,笔者在试验中发现,在农杆菌侵染前使用低频频率为25 k Hz,强度为400 W的超声波对待处理的PLB进行预处理,可以大大提高蝴蝶兰外源基因的转化效率。这可能和超声波的空化作用有关,其有可能使得植物细胞处于一种类似感受态的状态,使得农杆菌更易于侵染[11]。而在试验中侵染时被侵染对象处于负压状态,与对照相比其侵染效率稍有提高。其原因可能是因为排除了受体材料表面的微小气泡,使得菌液与受体材料能够更充分地接触,从而增加了对其的侵染机会。试验中我们也发现,这两种处理方式同时使用时会更大程度上提高转化率,说明两者之间存在着一定的交互作用,其机理还有待进一步的研究。
蝴蝶兰作为一种重要的观赏花卉,建立成熟高效的转化体系是十分必要的。本研究中通过对农杆菌介导转化蝴蝶兰PLB过程中辅以一定强度的超声波及负压处理,并最终获得了转化株,为进一步提高蝴蝶兰遗传转化体系和导入外源有益基因提供了理论依据。
[1]马建岗.基因工程学原理[M].西安:西安交通大学出版社,2004:27-48.
[2]李子红.热带兰花种养与鉴赏 [M].上海:上海科学技术出版社,2009:1-41.
[3]曹颖,胡尚连,孙霞,等.农杆菌介导转化石斛兰-蝴蝶兰杂交种类原球茎体的研究 [J].福建林业科技,2007,34(3):27-30.
[4]王关林,方宏筠.植物基因工程原理与技术 [M].北京:科学出版社,2002:733-831.
[5]满若君,卜朝阳,李杨瑞.蝴蝶兰·文心兰遗传转化体系的初步研究[J].安徽农业科学,2008,36(8):3129-3131.
[6]杨美纯,周岐伟.外部因子对蝴蝶兰叶片原球茎状体发生的影响 [J].广西植物,2002,20(1):42-46.
[7]张元国,刁家连,刘玉娥,等.蝴蝶兰花梗腋芽组培再生技术体系的研究[J].山东农业科学,2004(6):3-5.
[8]姚丽娟,徐晓薇,林绍生,等.蝴蝶兰原球茎增殖分化影响因子探讨 [J].亚热带植物科学,2004,33(3):42-44.
[9]Chai M L,Xu C J,Senthil K K,et al.Stable transformation of protoeorm-like bodiesin Phalaenopsis orchid mediated by Agrobacterium tumefaciens.Sci.Hort.2002,96:213-224.
[10]潭文澄,戴策刚.观赏植物组织培养技术[M].北京:中国林业出版社,1991:137-267.
[11]章力建,陈乐枚,袁静,等.超声波法导入外源基因高效烟草转化体系的建立 [J].中国农业科学:1991,24(2):83-89.

