长期吸烟对肺癌组织TGF-β1、VEGF-C表达的影响及临床意义
刘 涛,李若葆
肺癌,又称原发性支气管肺癌,肿瘤细胞起源于支气管黏膜或腺体,是常见的恶性肿瘤之一。肺癌的病因复杂,目前越来越多的研究者从基因水平研究吸烟与肺癌的关系,对肺癌的早期诊断、治疗及改善预后具有重要意义,其中TGF-β1、VEGF-C是研究的热点。
转化生长因子 β1(TGF-β1),是 Tuker等于 1984年发现的一种与多种上皮性肿瘤生长有关的多肽性负性细胞生长调控因子。近年研究发现TGF-β1在肺癌的发生发展及预后起着非常重要的作用。肺癌的生长与转移依赖肿瘤相关血管、淋巴管提供营养和转移通道。血管内皮生长因子C(VEGF-C)是迄今为止唯一能特异地作用于血管、淋巴管内皮细胞刺激因子A,通过与血管、淋巴管内皮细胞上的高亲和力的酪氨酸受体 VEGFR-2(KDR)和VEGFR-3(flt-4)结合,诱导血管及淋巴管增生,从而促进肿瘤的生长和转移。近年来国内外学者对TGF-β1、VEGF-C在肺癌组织中的表达及临床意义的研究很多,而吸烟对肺癌组织中TGF-β1、VEGFC表达的影响及临床意义的研究较少。本试验采用免疫组织化学研究长期吸烟和非长期吸烟肺癌患者癌组织、癌旁组织及周边“正常”组织结构差异及TGF-β1和VEGF-C表达的差异,探讨长期吸烟对肺癌组织及周边组织TGF-β1、VEGF-C表达的影响及临床意义。旨为临床上吸烟者肺癌的早期诊断提供理论依据,将对肺癌的早期诊断、指导治疗以及预后产生积极的作用。
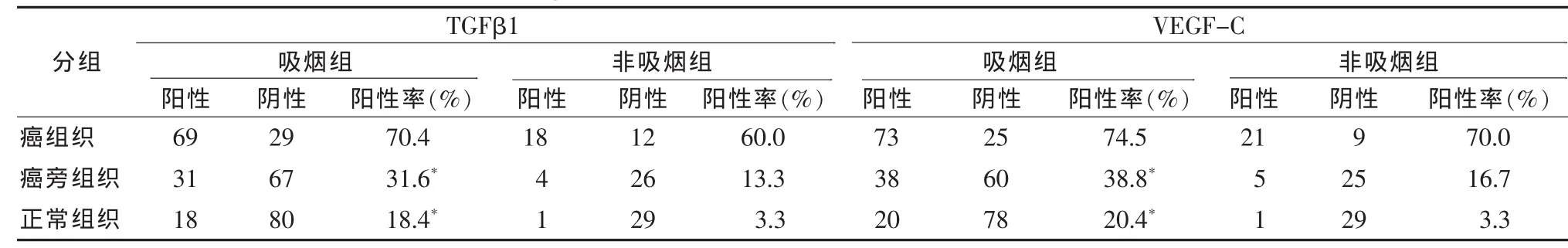
表 1 TGFβ1、VEGF-C在肺癌组织以及周边组织中表达情况
1 资料和方法
1.1 研究对象 取潍坊市第二人民医院病理科2006-01~2007-12行手术治疗并经病理确诊为肺癌的蜡块,其中吸烟组98份,非吸烟组30份。所有病例临床资料完整,吸烟史明确,按WHO(1984)关于吸烟调查方法标准建议:每天吸烟1支以上,时间长于1年者为吸烟。吸烟量1~9支/d为轻度,10~19支/d为中度,20支以上为重度,部分病历中每日吸烟量(支)的记录,仅有吸烟年限,吸烟年限虽不能精确地计算出吸入量,但吸烟时间的长短亦在一定程度上反映出其吸烟量及受烟雾刺激的多少,故将其吸烟年限<10年者定为轻度,11~19年为中度,20年以上为重度。本研究中所指的长期吸烟是指吸烟年限在20年以上、吸烟支数在20支/d以上。所有患者术前均未接受化疗、放疗或其它针对肿瘤的治疗。吸烟组男78份,女20份;非吸烟组男21份,女9份;年龄35~74岁,中位数年龄为57岁。依据1981年WHO《肺肿瘤组织学分型》制定的标准分类:吸烟组鳞癌43份,腺癌38份,鳞腺癌9份,小细胞癌8份;非吸烟组鳞癌11份,腺癌9份,鳞腺癌5份,小细胞癌5份。按2002年国际抗癌联盟(UICC)修订的标准进行TNM分期:吸烟组I期、Ⅱ期52份,Ⅲ期、Ⅳ期46份;非吸烟组I期、Ⅱ期11份,Ⅲ期、Ⅳ期19份。分化程度:吸烟组高分化程度18份,中等分化63份,低分化程度17份;非吸烟组高分化7份,中等分化12份,低分化11份。吸烟组有淋巴结转移者51份,无转移47份,远处转移31份,无远处转移67份;非吸烟组有淋巴结转移18份,无转移12份,远处转移13份,无远处转移17份。所取组织块用10%中性甲醛固定,常规脱水透明,浸蜡包埋、切片,分别进行 TGF-β1、VEGF-C 和苏木素-伊红染色(HE染色)。
1.2 试剂 PV-9000二步法免疫组化染色试剂盒、兔抗人TGF-β1多克隆抗体、兔抗人血管内皮生长因子C单克隆抗体、浓缩型DAB试剂盒均购自北京中杉金桥生物技术有限公司。
1.3 实验方法 选取术后经病理确诊为肺癌蜡块,进行连续5 μm切片,防脱片处理后进行免疫组织化学染色,PV-9000二步法步骤按试剂盒提供的说明书进行。
1.4 免疫组化结果分析 TGFβ1、VEGF-C阳性染色均为棕黄色颗粒,定位于细胞浆。TGFβ1、VEGFC阳性细胞计数:每份标本随机选取10个高倍视野,每个视野计数100个细胞,共计1000个细胞,计算阳性细胞百分率。细胞阳性细胞数<10%为表达阴性(-);阳性细胞数10%~20%为表达阳性(+);阳性细胞数>20%为表达阳性 (++);阳性细胞数>50%为表达强阳性(+++)。
1.5 统计学处理 使用SPSS 11.5统计学软件包进行数据处理分析,定性资料与各临床指标之间的关系行χ2检验,以及Speannan等级相关等方法。
2 结果
2.1 TGF-β1、VEGF-C组间阳性表达的比较 TGF-β1、VEGF-C均表达于细胞浆,阳性呈棕黄色颗粒状(图1~4)。在吸烟组以及非吸烟组肺癌组织中TGF-β1和VEGF-C均呈现高表达,但两组间无显著性差异,又都明显高于癌旁组织及周边组织(P<0.05);吸烟组癌旁组织TGF-β1与VEGF-C的阳性表达与非吸烟组癌旁组织TGF-β1与VEGF的阳性表达存在统计学差异 (P<0.05);吸烟组周边组织TGF-β1、VEGF-C表达高于非吸烟组“正常”组织(P<0.05);吸烟组癌旁组织TGF-β1和VEGF-C表达明显高于周边 “正常”组织 (P<0.05);非吸烟组癌旁组织TGF-β1表达明显高于周边“正常”组织(P<0.05),见表1。
2.2 TGF-β1蛋白与VEGF-C在肺癌组织的表达的相关关系 TGF-β1蛋白、VEGF-C在两组肺癌组织中的阳性表达率均明显增加,并且与分化程度、TNM分期、淋巴结转移密切相关。TGF-β1、VEGF-C过度表达可能与肺癌的发生、发展及恶性潜能有关(P<0.05,表 2、3)。
2.3 吸烟组与非吸烟组两种因子表达的相关性
无论吸烟组还是非吸烟组肺癌组织中VEGF-C、TGF-β1蛋白表达均密切相关(表4),VEGF-C 与TGF-β1蛋白在两组肺癌组织中的表达呈正相关,提示TGF-β1可能上调VEGF-C的表达。两者在肺癌的发生发展及转移中可能具有协同作用。

图 1 吸烟组肺癌组织免疫组化(×200),TGFβ1 阳性表达于细胞浆

图 2 吸烟组肺癌旁组织免疫组化(×200),TGFβ1 弱阳性表达于细胞浆
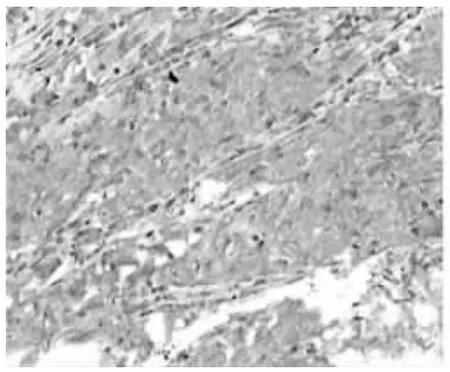
图 3 非吸烟组肺癌组织免疫组化 (×200),VEGF-C 阳性 表达,在细胞浆呈棕黄色弥漫颗粒

图 4 非吸烟组肺癌癌旁组织免疫组化(×200),VEGF-C 弱阳性表达于胞浆
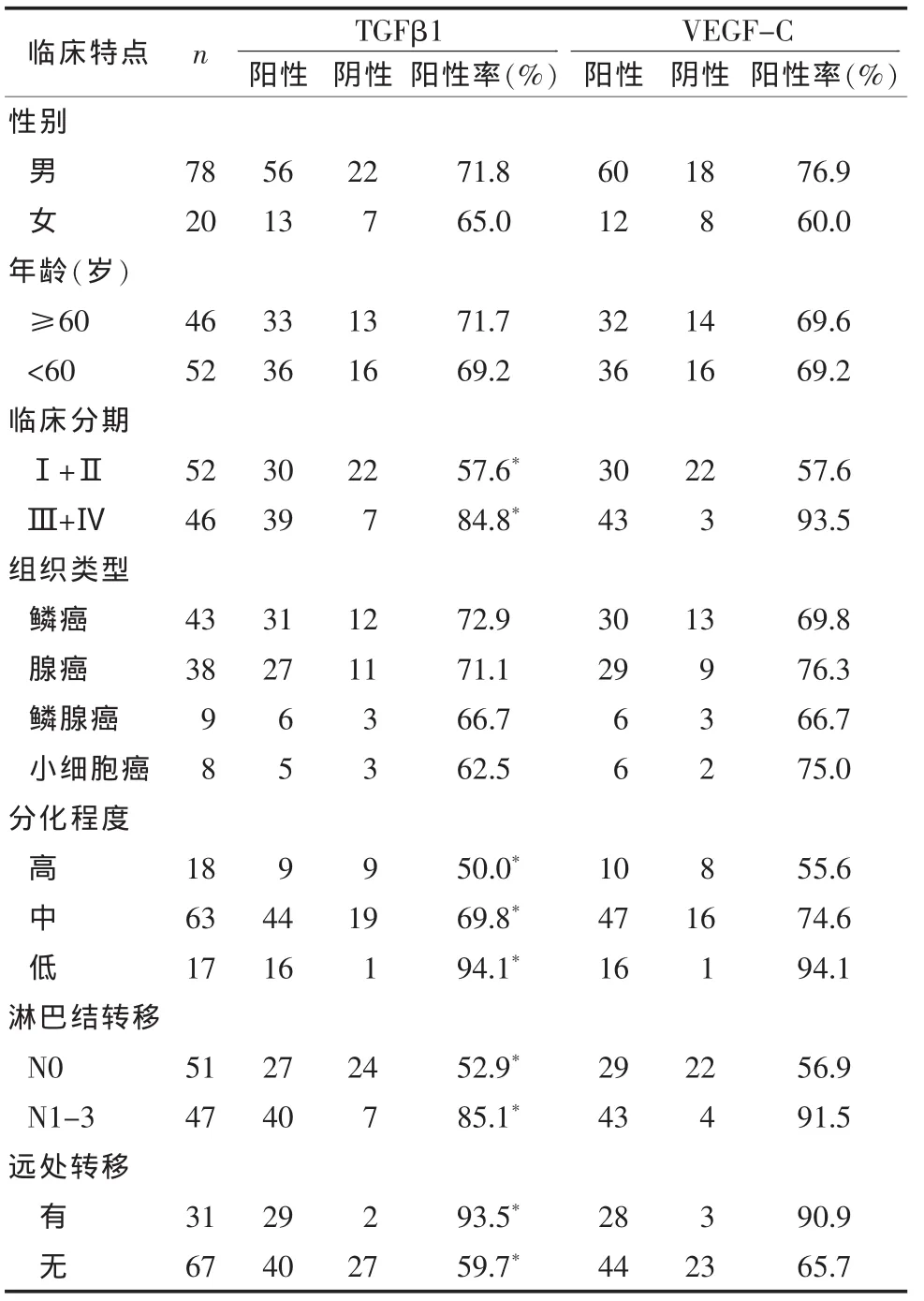
表 2 吸烟组肺癌组织TGFβ1、VEGF-C表达水平与肺癌病理生理特征关系
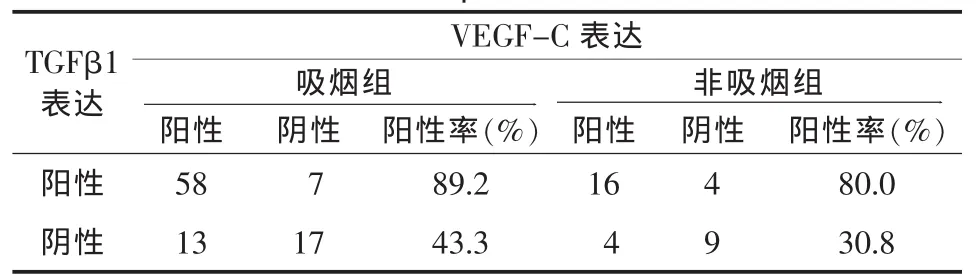
表 4 两组肺癌组织中TGFβ1与VEGF-C表达的相互关系
3 讨论
吸烟严重危害着人类的健康,现在的流行病学和科学实验已相继证明,吸烟是肺癌的主要病因。吸烟除了导致肺组织形态学改变以外,还可导致基因的改变。TGF-β与肿瘤的发生、发展及转移密切相关。在多种肿瘤中可观察到TGF-β的高度表达,在肿瘤生长的早期,TGF-β通过抑制细胞生长周期从G1期→S期抑制正常细胞生长和肿瘤细胞发生。但随着肿瘤的进展,TGF-β在肿瘤细胞中高表达,表明肿瘤细胞对TGF-β生长抑制作用的反应丧失或减弱。不仅抑制了机体免疫系统对肿瘤细胞的识别和杀伤,并同时通过促进肿瘤对微血管的生长及调节基质,促进了肿瘤的浸润和转移。越来越多的研究发现肺癌组织中常有TGF-β的增高。Asselin-Paturel等[1]从新鲜肿瘤活检标本中提取mRNA进行反转录PCR处理,发现所有的NSCLC细胞中均有TGF-β1mRNA的高表达。

表 3 非吸烟组肺癌TGFβ1、VEGF-C表达水平与肺癌病理生理特征关系
VEGF-C基因是1996年由Joukov等[2]首次从人前列腺癌细胞株PC-3的cDNA文库中克隆并分离得到,又称血管内皮生长因子相关蛋白(VRP),是一种特异性的血管、淋巴管内皮细胞调节因子,与血管内皮细胞生长因子受体-3(VEGFR-3)结合后,能诱导血管及淋巴管内皮细胞生长,在肿瘤组织中表达增加促进肿瘤转移。据Santos等[3]研究显示肺功能正常的吸烟者和中度慢性阻塞性肺病(COPD)患者肺动脉中VEGF表达均增高,且在平滑肌细胞中表达的程度与血管壁增厚程度相关。Arinago等[4]对180例NSCLC患者手术标本的免疫组化研究结果显示:VEGF-C和VEGFR-3的阳性表达率分别为 76.1%和 22.2%;其中腺癌组织中VEGF-C的表达明显高于其它病理类型;VEGF-C或(和)VEGFR-3阳性表达是影响患者生存期的重要因素,特别是VEGF-C和VEGFR-3同时阳性患者的预后最差;多因素分析结果显示,受体VEGFR-3阳性表达是影响NSCLC患者预后的独立因素。Kojima等[5]对129例TNM分期的T1期肺腺癌患者的研究结果提示肿瘤细胞中VEGF-C与内皮细胞上VEGFR-3的联合表达,是影响T1期肺腺癌患者预后的独立因素。本研究也显示,吸烟组癌旁组织、周边“正常”组织 TGF-β1、VEGF-C 阳性表达均显著高于非吸烟组癌旁组织、周边“正常”组织 TGF-β、VEGF-C 的表达(P<0.05);吸烟组和非吸烟组癌旁组织TGF-β1表达明显高于周边“正常”组织(P<0.05)。吸烟组VEGF-C表达在癌旁组织明显高于周边“正常”组织(P<0.05),而在非吸烟组VEGF-C阳性表达在癌旁组织与“正常”组织无显著性差别(P>0.05)。提示吸烟导致肺组织早期损伤。
VEGF-C一方面可以通过一系列复杂的机制诱导血管的形成,从而促使肿瘤体积增大,并使肿瘤边缘部分的瘤细胞与淋巴管的接触增多,或通过静脉-淋巴管吻合处,使血液进入淋巴管;另一方面,它还能增加微血管的通透性,并能诱导新生淋巴导管的形成,从而促使肿瘤细胞的淋巴管转移[6]。研究显示,VEGF-C和TGF-β1的表达呈正相关,表明TGF-β1刺激肿瘤血管生成的作用是通过旁分泌途径诱导VEGF-C的表达,间接地刺激肿瘤血管的生成,同时VEGF-C对TGF-β1亦有类似作用,两者通过促血管的生成而共同促进肿瘤的进展和转移[7]。由此可以推测,TGF-β1通过上调VEGF-C表达,间接促进肿瘤血管生成可能是促进肿瘤细胞增殖、浸润和转移的机制之一[8,9]。本研究结果也显示,在TGF-β1蛋白表达阳性的吸烟肺癌组织中,VEGF-C表达阳性率为89.2%,在TGF-β1蛋白表达阳性的非吸烟肺癌组织中,VEGF-C表达阳性率为80%。而在TGF-β1蛋白表达阴性的吸烟肺癌组织中,VEGF-C表达率仅为43.3%,在TGF-β1蛋白表达阴性的非吸烟肺癌组织中,VEGF-C表达阳性率仅为30.8%,表明TGF-β1蛋白与VEGF-C表达呈显著正相关,即TGF-β1与VEGF-C具有协同作用。
[1]Asselin-Paturel C,Echchakir H,Carayol G,et al.Quantitative analysis of Th1,Th2 and TGF-beta 1 cytokine expression in tumor,TIL and PBL of non-small cell lung cancer patients.Int J Cancer,1998,77(1)∶7-12.
[2]Joukov V,Pajusola K,Kaipainen A,et al.A novel vascular endothelial growth factor,VEGF-C,is a ligand for the Flt-4(VEGFR-3)and KDR(VEGFR-2)receptor tyrosine kinases[J].EMBO(Eur Mol Biol Organ)J,1996,15(2):290-298.
[3]Salud Santos,Victor I.Peinado,JosepRamírez,et al.Enhanced expression of vascular endothelial growth factor in pulmonary arteries of smokers and patients with moderate chronic obstructive pulmonary disease[J].Am J Respir Crit Care Med,2003,167:1250-1256.
[4]Arinago M,Noguchi T,Takeno S,et a1.Clinical significance of vascular endothelial growth factor C and vascular endothelial growth factor receptor 3 in patients with non-smaIl cell lung carcinoma[J].Cancer,2003,97(2):457-464.
[5]Kojima H,Shijubo N,Yamada G,et a1.Clinical significance of vascular endothelial growth factor C and vascular endothelial growth factor receptor 3 in patients with T1 lung adenocarcinoma[J].Cancer,2005,104(8):1668-1677.
[6]Skobe M,Hawighorst T,Jackson DG,et al.Induction of tumor lymphangiogenesis by VEGF-C promotes breast cancer metastasis[J].Nat Med,2001,7(2):192-198.
[7]Achen MG,Jeltsch M,Kukk E,et al.Vascular endothelial growth factor-D(VEGF-D)is a ligand for the tyrosine kinases VEGF receptor-2(Flk1)and VEGF receptor-3(Flt-4)[J].Proc Narl Acad Sci USA,1998,95(2):548-553.
[8]Grinnond S,Lagercrantz J,Drinkwater C,et al.Cloning and characterization of a novel hunman gene related to vascular endothelial growth factor[J].Genome Res,1996,6(2):124-131.
[9]Grimmond D,Guerriero V,Viglietto G,et al.Isolation of a human placenta vDNA coding for a protein related to the vascular permeability factor[J].Proc Narl Acad Sci USA,1991,88(20):9267-9271.

