黄绿木霉菌及不同生物混剂对土壤养分与酶活性的影响
孙冬梅 林志伟 段东平 迟 丽 张树权 于运凯 王 卓
(1黑龙江省农业科学院齐齐哈尔分院博士后工作站,东北林业大学博士后流动站,黑龙江齐齐哈尔 161041;2黑龙江八一农垦大学,黑龙江大庆 163319)
黄绿木霉菌及不同生物混剂对土壤养分与酶活性的影响
孙冬梅1,2林志伟2段东平2迟 丽1张树权1于运凯1王 卓2
(1黑龙江省农业科学院齐齐哈尔分院博士后工作站,东北林业大学博士后流动站,黑龙江齐齐哈尔 161041;2黑龙江八一农垦大学,黑龙江大庆 163319)
以生物菌肥拮抗细菌、解磷细菌、解钾细菌和黄绿木霉菌为实验材料,通过盆栽番茄试验,研究不同生物菌肥对土壤养分含量及土壤酶活性的影响。结果表明:添加黄绿木霉菌的处理,土壤养分含量均高于清水处理与化肥处理。跟踪测定番茄不同生长时期土壤中的脲酶、磷酸酶活性,结果表明:不同处理土壤中的脲酶与磷酸酶在番茄不同生长时期有相同的变化趋势,即由发芽期至开花期,酶活性逐渐增强,而后下降;而比较不同处理的酶活性,其中以解磷细菌、解钾细菌、拮抗细菌和黄绿木霉菌混合处理效果最为明显。所有使用生物菌肥的处理,脲酶与磷酸酶的活性均高于化肥处理与清水处理,其中混合处理比化肥处理在番茄不同生长时期的土壤脲酶活性均高出30 %,磷酸酶活性均高出27 %;但比较番茄收获后土壤过氧化氢酶与纤维素酶的活性,不同处理间差异不显著。
黄绿木霉菌;生物混剂;番茄;土壤养分;土壤酶
我国农业生产由传统农业向现代农业过渡的进程中,长期施用化学肥料,其化学物质在土壤中大量残留,破坏了土壤的有机组成(Minotli,1978;Corre & Breimer,1979),严重污染了环境(陈平 等,2003)。近年来,随着可持续农业及无公害农业的发展要求,生物菌肥由于具有改善土壤环境、活化土壤养分、提高土壤肥力、减少环境污染的能力,而逐渐受到人们的关注(陈平 等,2003),微生物肥料应用后的定殖情况已有大量研究(陈雪丽 等,2008),但有关黄绿木霉菌在土壤中施用后对土壤养分和土壤酶活性的影响研究鲜见报道。
土壤中的一切生物化学反应,都是在酶的参与下进行的,土壤酶活性反映了土壤中进行的各种生物化学过程的强度和方向。土壤酶主要来源于土壤中动物、植物根系和微生物的细胞分泌物以及残体的分解物(Menon et al.,2005)。土壤酶在营养物质转化、能量代谢、污染物质净化和温室气体排放等过程中都发挥着十分重要的作用,因此被认为是土壤生态过程的重要组成部分(孙英健 等,2005)。
本试验以黑龙江八一农垦大学生物技术实验室自分的效果良好的拮抗细菌、解磷细菌、解钾细菌和黄绿木霉菌为实验材料(孙冬梅 等,2005a,2005b,2008a,2008b),通过测定土壤肥力、土壤酶活性的变化情况,初步探讨不同生物菌肥施用后对土壤特性的影响,为生物菌肥的进一步推广应用提供科学依据。
1 材料与方法
1.1 试验材料
供试番茄:齐研矮粉,市场购买。
供试肥料:解磷细菌、解钾细菌、拮抗细菌均为芽孢杆菌,黄绿木霉菌为黑龙江八一农垦大学生物技术实验室保留的自分菌株。
盆栽土壤基本农化性状:土壤全氮含量0.198 g·kg-1,碱解氮含量164.78 mg·kg-1,有效磷含量15.67 mg·kg-1,速效钾含量210 mg·kg-1,有机质5.96 %,pH值8.04。
1.2 试验方法
1.2.1 盆栽试验设计 取试验用林甸未开垦的碱土,混匀装入直径为20 cm的塑料盆中。盆栽土壤处理方法见表1。

表1 盆栽土壤的不同处理方法
生物肥菌液稀释后有效菌剂浓度达到1×108个·mL-1,黄绿木霉菌孢子悬浮液浓度为1×106个·mL-1。每处理15盆,每次取样3盆,每盆播种番茄种子5粒,出苗后保留3株。在植株生长期间,向盆内均匀补充清水,适度保持土壤含水量,于番茄发芽期、幼苗期、开花期、结果期和收获后分别土壤取样。
1.2.2 土壤养分测定 土壤全氮含量采用凯氏定氮法测定;有效氮含量采用碱解扩散法测定;有效磷含量采用钼锑钪比色法测定;速效钾含量采用火焰光度法测定;有机质含量采用重铬酸钾容量法测定;pH采用电位法测定,具体测定方法参照《土壤农化分析》(南京农业大学,1991)。
1.2.3 土壤酶活性测定 脲酶活性采用苯酚钠法测定;酸性磷酸酶活性采用磷酸苯二钠比色法测定;过氧化氢酶活性采用高锰酸钾滴定法测定;纤维素酶活性采用3, 5-二硝基水杨酸法测定(关松荫,1986)。
2 结果与分析
2.1 不同处理对土壤养分含量的影响
解磷细菌能够逐步分解土壤中的磷灰石和磷酸三钙以及有机磷化物,释放出P2O5;解钾细菌则能溶解非交换性钾和矿物钾,释放出易被植物吸收利用的钾(洪坚平 等,2000)。因而不同微生物施入土壤后,在作物收获后对土壤养分产生了不同的影响。与化肥处理和清水处理相比,施用解磷细菌、解钾细菌、拮抗细菌和黄绿木霉菌的处理(E)增加了全氮、碱解氮、有效磷、速效钾及有机质含量,而pH值下降。只施用拮抗细菌的处理(B)比化肥处理全氮含量增加7.69 %,碱解氮含量增加5.70 %,有效磷含量增加9.97 %,速效钾含量增加6.19 %,有机质含量增加2.10 %,pH值下降1.84 %。添加黄绿木霉菌的处理在土壤各种养分及pH值方面,均表现良好(表2)。

表2 收获后不同处理的土壤养分含量
2.2 不同处理对土壤酶活性的影响
2.2.1 对土壤脲酶活性的影响 脲酶是催化尿素水解的唯一酶,脲酶活性的变化与土壤氮素状况及土壤理化性状有关,脲酶活性的高低与土壤营养物质转化能力、肥力水平、污染状况密切相关(李现伟 等,2008)。测定番茄不同生长时期的土壤脲酶活性变化情况后发现,各处理的脲酶活性在番茄生长发育过程中变化趋势一致,在番茄开花期均出现一个高峰期,然后稍有下降。脲酶活性以处理E(解磷细菌液10 mL+解钾细菌液10 mL+拮抗细菌液20 mL+黄绿木霉菌孢子悬浮液10 mL+清水150 mL)最高,与其他处理差异显著(表3)。
不同处理之间的差异可能与使用的微生物菌株不同有关,来源于土壤中的大部分细菌都具有分解有机态氮为无机态氮的能力,故拮抗细菌与解磷细菌、解钾细菌加入后对脲酶活性均有促进作用;黄绿木霉菌能够增强脲酶活性可能与该菌株纤维素分解能力强有关(林志伟 等,2008),伴随土壤中纤维质类的降解,为细菌的生长提供了可利用的碳源,发挥了微生物间的互生关系,从而提高了土壤中脲酶的活性(洪坚平 等,2007)。试验结果在一定程度上也反映了不同菌株混合后的增效作用,这将为生物复合菌剂的研制提供理论参考。
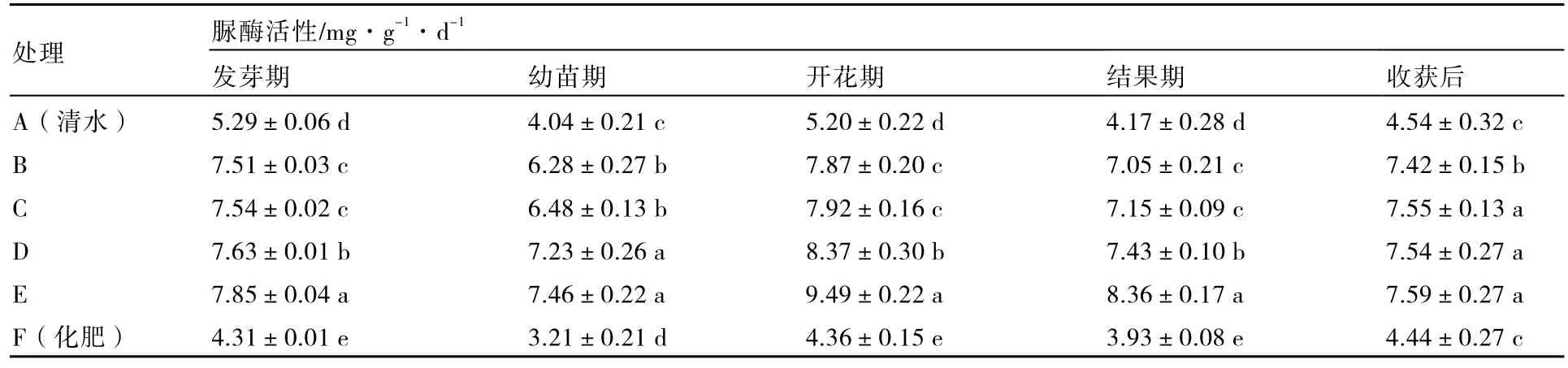
表3 不同处理的土壤脲酶活性在番茄生长发育过程中的变化
2.2.2 对土壤磷酸酶活性的影响 植物根系、土壤细菌和真菌等微生物都能分泌胞外磷酸酶(Dinkelaker et al.,1992;张信娣 等,2008),土壤磷酸酶对土壤中含磷物质等的循环具有重要作用。与清水、化肥处理相比,在番茄的不同生长时期,由于解磷细菌的加入,土壤中磷酸酶活性增加,即处理C(拮抗细菌液40 mL+黄绿木霉菌孢子悬浮液10 mL+清水150 mL)、D(解磷细菌液10 mL+解钾细菌液10 mL+拮抗细菌液20 mL+清水160 mL)、E(解磷细菌液10 mL+解钾细菌液10 mL+拮抗细菌液20 mL+黄绿木霉菌孢子悬浮液10 mL+清水150 mL)的磷酸酶活性均高于清水处理与化肥处理,开花期C、D、E处理的磷酸酶活性分别比清水处理高 47.9 %、53.9 %和64.2 %,比化肥处理高27.4 %、33.0 %和52.9 %;同时只施用拮抗细菌的处理(B)与化肥处理相比,一定程度上增加了磷酸酶的活性。不同处理的土壤磷酸酶活性均随着植株发育的进程,表现出比较一致的趋势,即先上升后下降,开花期土壤磷酸酶活性达到最大值(表4)。有研究表明,能够代表土壤肥力的两种土壤酶为土壤脲酶和磷酸酶(周礼恺,1983;宋勇春 等,2000)。本试验对不同处理的结果分析发现,上述两种土壤酶表现趋势比较一致。
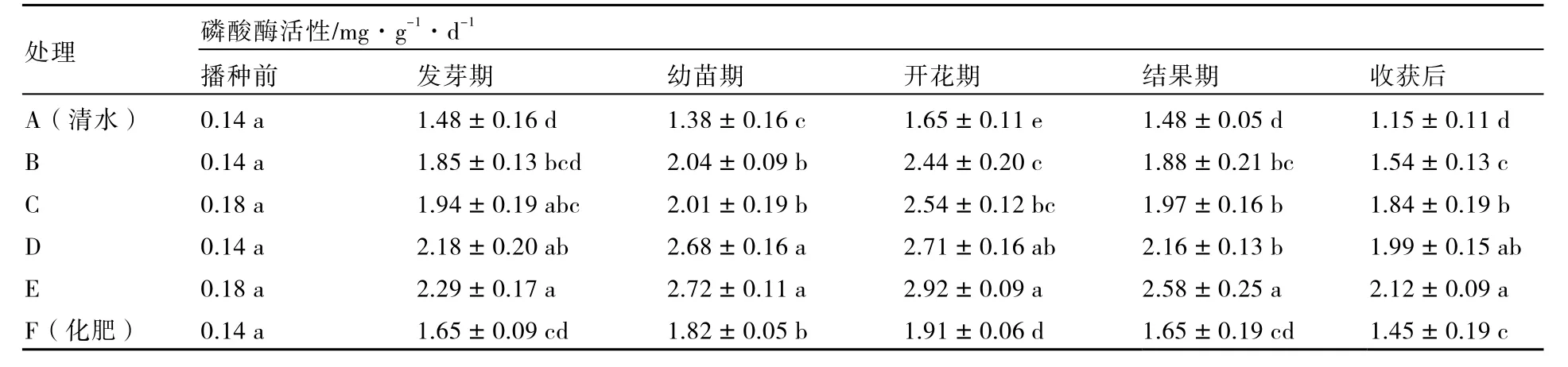
表4 不同处理的土壤磷酸酶活性在番茄生长发育过程中的变化
2.2.3 对土壤过氧化氢酶及纤维素酶活性的影响 过氧化氢是由生物呼吸过程和有机物的生物化学氧化反应产生的,对生物和土壤均有毒害作用,而存在于土壤中的过氧化氢酶则能酶促过氧化氢分解为水和氧气,从而解除过氧化氢的毒害作用。过氧化氢酶的活性表征土壤腐殖化强度大小和有机质积累程度(刘建新,2004),纤维素酶是表征土壤碳素循环速度的重要指标(王启兰 等,2007),进入土壤的植物纤维素是在纤维素酶的作用下分解的,纤维素酶促使纤维素中的β-1,4-葡聚糖水解成纤维二糖。由表5可知:C、D、E处理的过氧化氢酶活性与清水处理和化肥处理有显著差异。施用黄绿木霉菌处理的纤维素酶活性比清水处理和化肥处理高,不同处理间差异不显著。施用黄绿木霉菌处理的纤维素酶活性稍高,这可能与该菌株本身的纤维素分解能力有关。
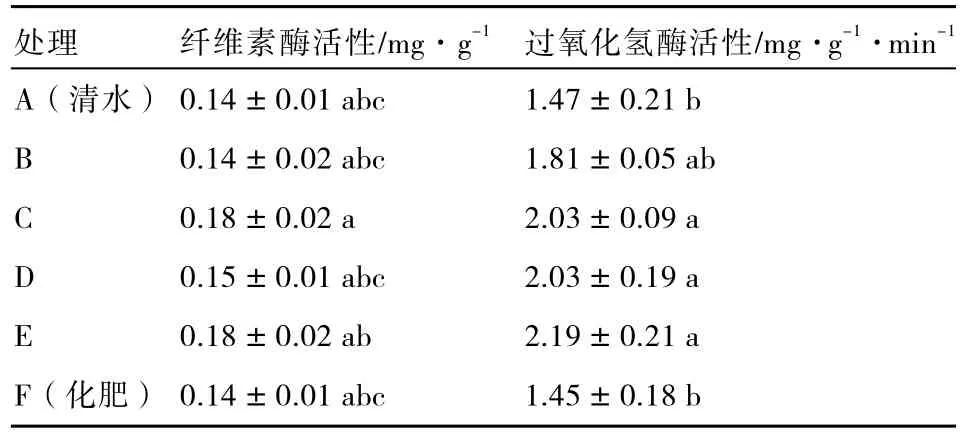
表5 不同处理的土壤过氧化氢酶与纤维素酶活性
3 结论与讨论
施用各种生物菌肥,可以通过微生物的活动及其分泌的各种生物酶,改良土壤,促进土壤有机质的形成,改善土壤理化性状,活化被土壤固定的 P、K、Mg、Ca、Si、Fe等营养元素(王立刚 等,2004),且解磷细菌、解钾细菌等有益微生物能加快有机物的分解和转化,活化土壤中被固定养分及矿物质,增加土壤养分含量(周培 等,2002;占新华 等,2003)。
使用生物菌肥后,土壤中的各养分含量均有增加趋势。微生物处理的土壤中全氮、有效磷、有效钾及有机质含量均高于化肥处理及清水处理,其中以施用解磷细菌、解钾细菌、拮抗细菌和黄绿木霉菌的处理最高;使用微生物的各处理,在番茄的不同生长时期,土壤脲酶活性与磷酸酶活性均高于化肥处理与清水处理;对比番茄不同生长时期的土壤脲酶与磷酸酶活性变化,各处理均呈先上升后下降的变化趋势,其中以开花期较高。而各处理土壤过氧化氢酶和纤维素酶活性变化不是很明显,但以施用黄绿木霉菌孢子悬浮液的处理酶活性较高。
陈平,娄春荣,安景文,刘慧颖. 2003. 微生物肥料在农业中的应用与发展前景. 农业经济,2(7):34-35.
陈雪丽,王光华,金剑,王玉峰. 2008. 两株芽孢杆菌对黄瓜和番茄根际土壤微生物群落结构影响. 生态学杂志,27(11):1895-1900.
关松荫. 1986. 土壤酶及研究方法. 北京:中国农业出版社.
洪坚平,郝晶,毕理智,谢英荷,刘冰. 2007. 不同解磷菌群对油菜土壤养分与酶活性的影响. 中国生态农业学报,15(5):51-54.
洪坚平,谢英荷,巫东堂. 2000. 农业微生物资源的开发与利用. 北京:中国林业出版社.
李现伟,何莉莉,张旭,宋涛. 2008. 黄瓜有机营养土栽培中土壤酶活性、肥力动态变化及其相互关系. 土壤通报,39(3):424-427.
林志伟,孙冬梅,张红梅,赵金玲. 2008. 黄绿木霉菌产纤维素酶条件优化. 微生物学通报,35(1):59-62.
刘建新. 2004. 不同农田土壤酶活性与土壤养分相关关系研究. 土壤通报,35(4):523-525.
南京农业大学. 1991. 土壤农化分析. 2版. 北京:中国农业出版社.
孙冬梅,杨谦,张军政. 2005a. 黄绿木霉菌诱变菌株对大豆根腐病菌的生物防治. 大豆科学,24(3):171-175.
孙冬梅,杨谦,宋金柱. 2005b. 黄绿木霉菌对大豆根腐病菌的生物防治. 油料作物学报,27(3):58-61.
孙冬梅,张树权,迟丽,王昱婷. 2008a. 两株不同解磷微生物的分离及其特性. 中国农学通报,24(3):239-241.
孙冬梅,林志伟,张树权,迟丽,蒋堃,赵敏. 2008b. 苯酚降解微生物的分离及特性初探. 黑龙江八一农垦大学学报,20(4):4-6.
孙英健,刁晓平,沈建忠. 2005. 阿维菌素对土壤微生物和蚯蚓的影响. 应用生态学报,16(11):2140-2143.
宋勇春,冯固,李晓林. 2000. 泡囊丛枝菌根对红三叶草根际土壤磷酸酶活性的影响. 应用与环境生物学报,6(2):171-175.
王立刚,李维炯,邱建军,马永良,王迎春. 2004. 生物有机肥对作物生长、土壤肥力及产量的效应研究. 土壤肥料,(5):12-16.
王启兰,曹广民,王长庭. 2007. 放牧对小嵩草草甸土壤酶活性及土壤环境因素的影响. 植物营养与肥料学报,13(5):856-864.
占新华,徐阳春,蒋廷惠. 2003. 硅酸盐细菌的生物效应和根际效应. 农业环境科学学报,22(4):412-415.
张信娣,曹慧,徐冬青,金叶飞,陈银科. 2008. 光合细菌和有机肥料对土壤主要微生物类群和土壤酶活性的影响. 土壤,40(3):443-447.
周礼恺. 1983. 土壤酶活性的总体在评价土壤肥力水平中作用. 土壤学报,20(4):413-417.
周培,黄锦法,陆贻通. 2002. 微生态制剂SC27对作物生长和土壤环境的影响. 上海交通大学学报,20(4):332-336.
Corre W J,Breimer T. 1979. Wageningen center for agrieutural publishing and documentation. Nitrite in Vegetables,85:102-103.
Dinkelaker B,Marschner H. 1992. In vivo demonstration of acid phosphatase activity in the rhizosphere of soil-grown plants. Plant and Soil,144:199-205.
Menon P,Gopal M,Parsad R. 2005. Effects of chlorpyrifos and quinalphos on dehydrogenase activities and reduction of Fe3+in the soils of two semi-arid fields of tropical India. Agriculture,Ecosystems & Environment,108(1):73-83.
Minotli P L. 1978. Nitrogen in the environment. Plant Nitrogen Relationship,250(11):235-252.
Effect of Appling Trichoderma aureoviride and Muti-microorganisim on Soil Fertility and Soil Enzyme Activity
SUN Dong-mei1,2, LIN Zhi-wei2, DUAN Dong-ping2, CHI Li1, ZHANG Shu-quan1, YU Yun-kai1, WANG Zhuo2
(1Post-doctor Work Station of Qiqihar Institute, Heilongjiang Academy of Agricultural Sciences, Northeast Forestry University, Qiqihar 161041, Heilongjiang, China; 2Heilongjiang August First Reclamation University, Daqing 163319,Heilongjiang, China)
Taking antagonism bacteria, phosphate dissolving bacteria, silicate dissolving bacteria andTrichodermasp. as material,through pot experiment, we compared the results and studies the effects of different bio-fertilizer on soil nutrients and soil enzymes activities. The results showed that the concentration of soil nutrients in the treatment of bio-fertilizer were higher than that in the treatments of pure water and chemical fertilizer. The soil urase and phosphatase activity were detected at different tomato development stages. The result showed that the change tendency of soil urase activity and phosphatase activity were the same along different tomato growing stages, the enzyme activity was increasing from germination stage to flowering stage, but decreasing after flowering stage. Contrast to other treatments, the enzyme activity of bio-fertilizers mixed treatment(phosphate dissolving bacteria, silicate dissolving bacteria, antagonism bacteria andTrichodermasp.)was higher. The urase activity and phosphatase activity by different bio-fertilizer treatments were higher than the treatment of pure water and chemical fertilizer. The urase activity and phosphatase activity of treatment E were 30 % and 27 % higher than that of the treatment of chemical fertilizer, respectively. However, the differences in catalase activity and cellulase activity among different treatments were not significant after harvest.
Trichoderma aureoviride; Bio-fertilizer; Tomato; Soil fertility; Soil enzyme
TQ925
A
1000-6346(2010)10-0072-05
2009-10-23;接受日期:2010-03-07
黑龙江省博士后基金(LBH-Z07021),黑龙江省教育厅骨干教师项目(1152G023),黑龙江八一农垦大学博士启动项目
孙冬梅,女,博士研究生,副教授,从事应用微生物学研究,E-mail:sdmlzw@163.com

