果胶酸类物质的酶解及其对DCS稳定性的影响
张春辉 詹怀宇 李 静 李兵云 付时雨
(华南理工大学制浆造纸工程国家重点实验室,广东广州,510640)
果胶酸类物质的酶解及其对DCS稳定性的影响
张春辉 詹怀宇 李 静 李兵云 付时雨
(华南理工大学制浆造纸工程国家重点实验室,广东广州,510640)
选用两种商品果胶酶制剂,首先优化其酶解果胶类物质的反应条件,结果发现,两种果胶酶在pH值9.0,温度为60~70℃的较优条件下可以有效地酶解果胶类物质和马尾松化学机械浆DCS,降低其阳离子需求量(CD值)。在探求两种果胶酶酶解果胶类物质的机理时,得出在对PGA类物质(酸性果胶物质)进行果胶酸(盐)裂解酶(PGL)处理以降低CD值时,没有必要将其完全酶解成单体,而只需将其聚合度降为6左右即可。碱性果胶酶(PL)处理果胶时也有类似的结果。同时发现,在漂白浆DCS中的果胶类物质主要是以果胶酸的形式存在,在选用果胶酶时应选用PGL。马尾松化学机械浆DCS经PGL酶处理以后虽然对提高DCS的稳定性作用不大,但可以减缓其沉淀的速度。
果胶酶;溶解与胶体物质;酶解机理;聚合度
机械浆生产过程中,各种木材组分会释放到过程水中[1-2],其中溶解与胶体物质(DCS)会随白水循环次数的增多在白水中积累,给湿部操作和产品质量带来一系列问题,如纸机运转性能下降、纸张质量下降(纸页中的小孔、斑点等)、助留剂无效消耗等[3-4]。
机械法制浆过程中生成的阴离子杂质主要是聚半乳糖醛酸。研究发现,这些果胶酸类物质不仅会消耗阳离子型助剂,而且易与钙离子形成不溶聚集物,加速体系的失稳。Thornton等利用商品果胶酶(PextinexUltra SP-L)处理机械浆过氧化氢漂白滤液中的DCS,发现该酶可以解聚聚半乳糖醛酸,并使其阳离子需求量从431μmol/L降至248μmol/L[5]。这说明,在造纸过程中为防止果胶酸(聚半乳糖醛酸)与阳离子型助剂发生络合,采用果胶酶处理是很有用的[6]。到目前为止,对于果胶酸类物质的酶解(果胶酶处理)的研究绝大多数停留在其酶解的最终效果,即酶解处理对阳离子型助剂用量的影响,而对果胶酶的具体酶解机理及其对DCS体系的稳定性方面的研究较少。
因此,本研究以此为切入点,首先优化果胶酶降解果胶酸类物质的反应条件,再在较优条件下探求其降解果胶酸类物质的机理,最后用果胶酶处理化学机械浆中的DCS,探讨其对降低阳离子需求量(CD值)的效果,并研究果胶质降解后对体系中胶体物质稳定性的影响。
1 实 验
1.1 实验原料
实验用果胶酶A由中国诺维信(天津)公司提供,果胶酶B为碱性果胶酶,EDT公司生产。马尾松CT MP取自广州造纸股份有限公司。
CaCl2(分析纯),果胶酸类物质PGA(Sigma公司),半乳糖醛酸(Sigma公司)、DNS试剂、果胶(Sigma公司)、Tris-HCl(三(羟甲基)氨基甲烷盐酸盐)缓冲液。
1.2 实验方法
1.2.1 酶活的测定
果胶裂解酶(pectin lyase)和果胶酸(盐)裂解酶(pectate lyase)是两种主要的果胶裂解酶,前者可以降解果胶,后者可以降解聚半乳糖醛酸。实验采用两种果胶酶,一种为碱性果胶酶(PL),一种为果胶酸(盐)裂解酶(PGL)。
PL酶活的测定:基于3,5-二硝基水杨酸与醛糖共热能产生棕红色的氨基化合物,在一定范围内还原糖的量和含有呈色氨基化合物的反应液颜色深浅成正比,在540 nm下测其吸光度,从而可计算出果胶酶活力。底物为果胶,取1.00 g果胶用pH值8.0的Tris-HCl缓冲液溶解,恒速搅拌1.5 h,用缓冲液定容至100 mL。以半乳糖醛酸为底物测定并绘制标准曲线。酶活力单位为1 mL酶液在50℃、pH值8.0的条件下,1 h分解果胶产生1 mg半乳糖醛酸为一个酶活单位。具体测定步骤见参考文献[7]。此条件下测定的酶活为4000 U(测定时稀释500倍)。
PGL酶活的测定[8]:酶解产物——不饱和低聚半乳糖醛酸在235 nm处的紫外吸收值与其浓度成正比关系,ε=4.6×103L/(mol·cm)。通过测定单位时间内生成的低聚醛酸的量来表征酶的活力。一个酶活单位为1 mL酶液在30℃、pH值7.5的条件下,每分钟酶解果胶酸钠生成1μmol不饱和低聚半乳糖醛酸为一个酶活单位,用U表示,单位U/mL。计算公式为:
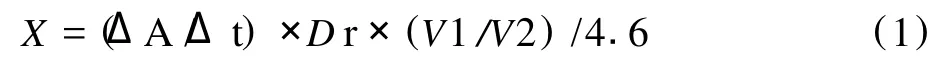
式中,ΔA/Δt为吸光度变化速率,Dr为稀释倍数,V1测定液的总体积,V2测定所用酶液的体积, 4.6为系数。此条件下测得的酶活为125 U/mL。
1.2.2 DCS的制备
CT MP浆的漂白:化学品用量H2O24.0%, NaOH 2.0%,Na2S iO33.0%,EDTA 0.2%,MgSO40.05%,60℃,90 min,浆浓10.0%。
DCS的制备:取漂后浓浆(未洗涤)加蒸馏水稀释至1.0%浆浓,用盐酸调节pH值为5.5左右,随后在60℃下搅拌3 h,悬浮液经离心(500 g,30 min),小心移取上清液即得DCS。
1.2.3 其他参数的测定
浊度的测定采用美国HACH公司的2100N型浊度仪测定,单位NTU。
阳离子需求量(CD值)的测定:采用Mutek PCD03型胶体电荷自动滴定仪。标准阳离子物质为1000μmol/L的聚二烯丙基二甲基氯化铵(P-DADMAC)。样品体积为10 mL。
2 结果与讨论
果胶酶是可以水解果胶类聚合物中糖苷键的酶的总称。有的果胶酶可以优先水解甲基化的果胶,而有的果胶酶可以优先水解未甲基化的果胶。机械浆的碱处理过程中溶出的果胶是未被甲基化的[9],因此,内切果胶酶对降低果胶的聚合度比外切果胶酶更为有效。因此,在纸浆的酶处理中多采用内切聚半乳糖醛酸酶(EC 3.2.1.15 poly-[1,4-α-D-galacturonide]-glycanohydrolase)。
2.1 PGL酶解果胶酸模型物及DCS的机理
果胶酸(盐)裂解酶(PGL)可以降解聚半乳糖醛酸(盐),而不能直接降解果胶。因此选用酸性聚糖PGA的钠盐作为底物,研究各影响因素如pH值、温度、酶用量等对降低CD值的影响,并据此优选出较佳的处理条件。先进行小样实验,用不同pH值的Tris-HCl缓冲溶液配制1.0 g/L的PGA溶液,测定不同pH值和温度下PGA的CD值的变化情况,反应时间为120 min,结果如图1~图3所示。
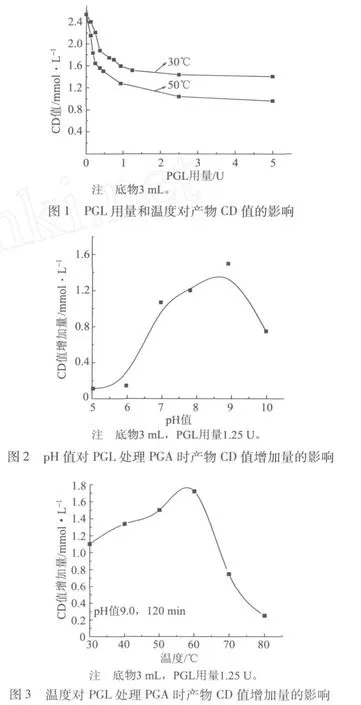
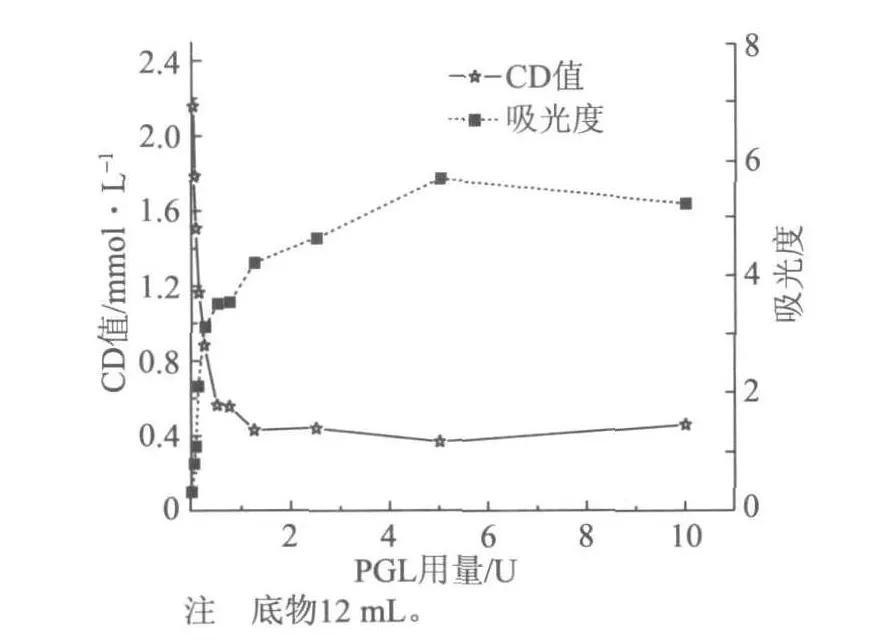
图4 PGL用量对产物CD值及其吸光度的影响
从上面的小样品实验得出,PGL处理PGA时较优的条件为pH值9.0,温度60℃。在此基础上,为研究PGL酶解果胶酸类物质PGA的机理,另取12 mL PGA水溶液,用盐酸和NaOH调节pH值为9.0,在60℃下,反应120 min,测定产物的CD值;同时将产物稀释一定的倍数,测定其在235 nm的吸光度,结果如图4所示。
从图4中可以看出,随着PGL用量的增加,产物的CD值开始降低较快,当PGL用量超过1.25 U之后变化不大;吸光度逐渐升高。CD值的下降反映PGA聚合度DP的减小,吸光度的增大说明产生了更多的不饱和低聚半乳糖醛酸基。图4还可以看出, PGL用量超过1.25 U之后,产物的吸光度仍然有较为明显的上升。这说明CD值与吸光度之间并不成比例关系。根据朗伯比尔定律:
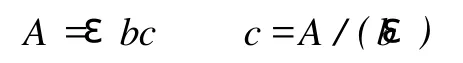
其中,A为吸光度;ε为系数;b为吸收层厚度(cm);c为浓度。
据此得出反应过程中产生的不饱和醛酸末端基的浓度为:
C=ΔA/4.6
反应物中PG A的浓度为0.8 g/L,即4.04 mmol/L。由此得出PGA聚合度(DP)随PGL用量的变化趋势,以及CD值与DP的关系,如图5和图6所示。
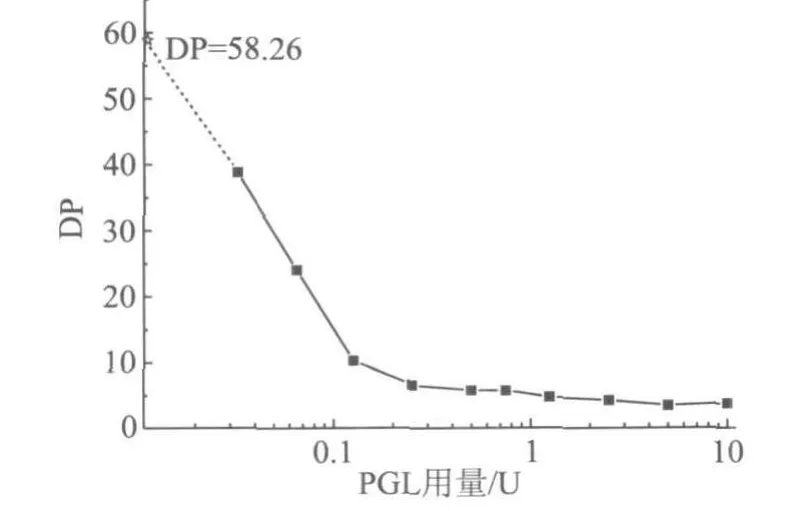
图5 PGA聚合度随PGL加入量的变化趋势
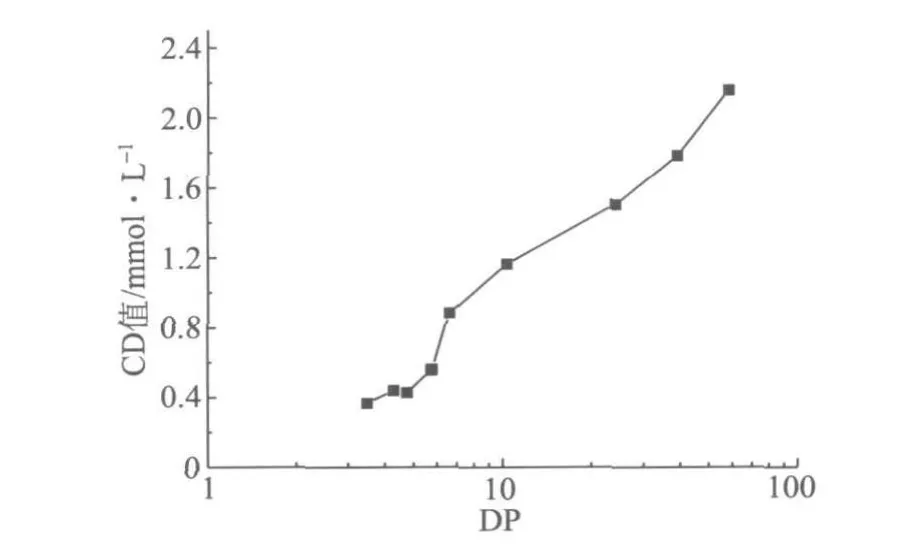
图6 PGA的CD值与其聚合度之间的关系
从图5可以看出,随着PGL用量的增加,PGA的聚合度开始时下降迅速,PGL用量为0.25 U时平均DP已降低6~7;但继续增加PGL用量,PGA的DP变化不大,用量为10 U时,DP降至3~4。之所以PGA的DP没有降至1(即完全酶解成单体),可能与果胶酶本身的降解能力和实验所用的时间(120 min)有关。
另外,得出了PGA的CD值与其DP的关系。从图6中可以看出,在DP较小时(<6),PGA仍会消耗少量的阳离子聚合物(P-DADMAC);当聚合度超过6时,PGA的CD值开始明显上升。因此,从经济和效率的角度出发,在对PGA类物质进行果胶酶处理以降低CD值时,没有必要将其完全酶解成单体,而只需将其聚合度降为6左右即可。
接着用PGL处理马尾松CT MP漂白浆DCS,实验结果如图7所示。从图中可以看出,PGL可以有效地去除果胶质,降低DCS的CD值。研究得知, DCS的CD值主要来自DS(溶解性物质)部分,约占总CD值的70%~80%。但是果胶酶处理以后, CD值只下降了约40%,这说明DS中不仅果胶质会消耗阳离子聚合物,其他的阴离子性物质也会消耗阳离子聚合物。Thornton等也获得类似的结果,他们利用商品果胶酶(Pextinex U ltra SP-L)处理机械浆过氧化氢漂白滤液的DCS样品,可以导致聚半乳糖醛酸的解聚,并且CD值从431μmol/L降至248μmol/L[5]。

图7 PGL用量对马尾松漂白浆DCS的CD值的影响
2.2 PL酶解果胶模型物及DCS的机理
选用果胶作为底物,研究各影响因素如pH值、温度对PL酶酶活的影响,并据此优选出较佳的处理条件为温度70℃,pH值9.0(实验结果未列出)。在此较优条件下,通过测定CD值的变化,来探讨PL对果胶和DCS的处理效果。实验条件为pH值9.0,温度70℃,时间120 min,100℃下灭活5 min;果胶(1.0 g/L)5 mL,总体积15 mL。结果如图8所示。图中PL用量均以标准测定方法(温度50℃,pH值8.0)测得的酶活4000 U/mL来计量的。
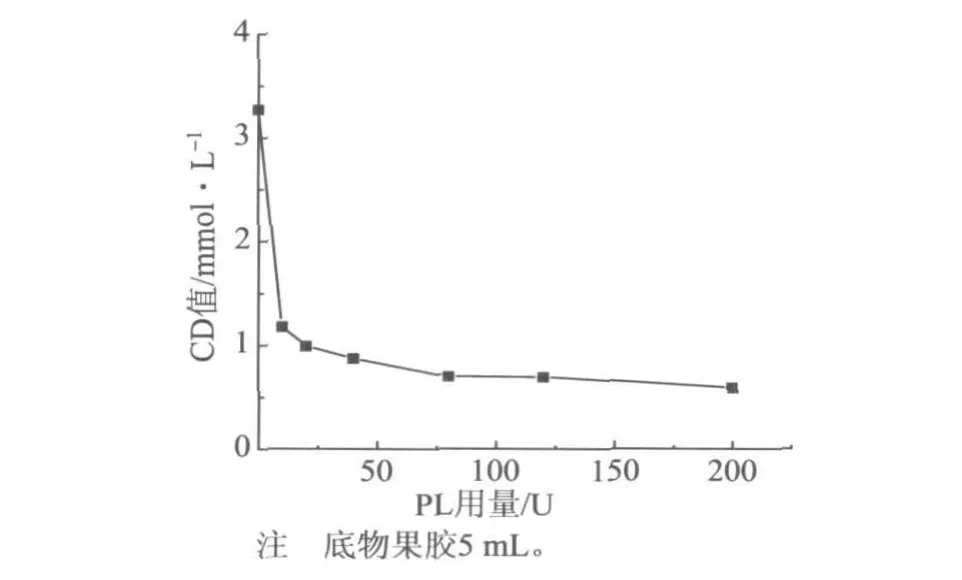
图8 PL用量对酶解产物CD值的影响
从图8中可以看出,PL酶可以有效地酶解果胶模型物,当用量为200 U时,果胶的CD值下降约80%。但从变化趋势来看,PL用量大于80 U以后, CD值下降甚为缓慢。另外,还将产物稀释并测定其在235 nm处的吸光度,发现了与PGL处理PGA时类似的现象(如图9所示),即CD值基本保持不变,而吸光度不断地增大,进一步证明了果胶类物质只有在DP超过一定值时才会与阳离子聚合电解质反应。
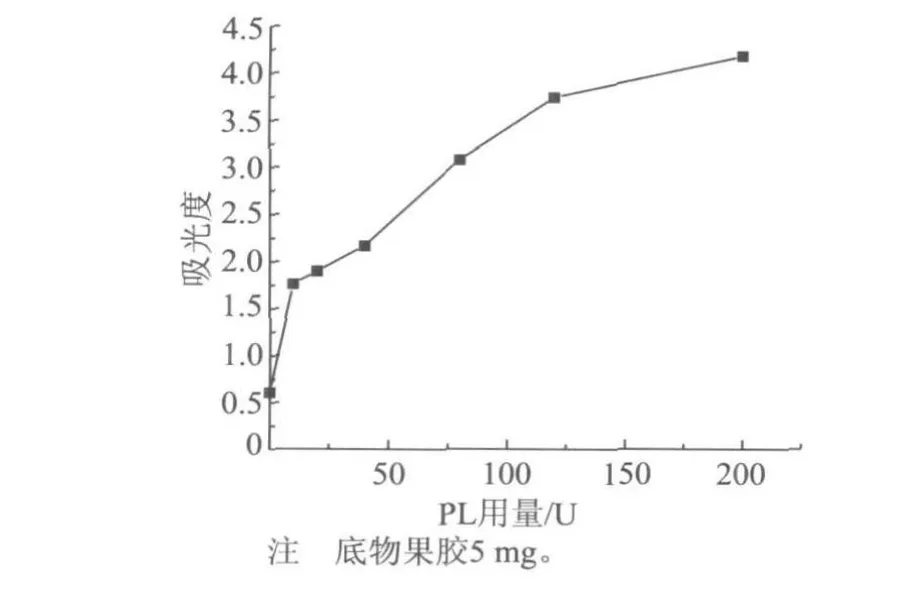
图9 PL用量对产物吸光度的影响
将PL酶用于马尾松漂白浆DCS的处理。条件为:pH值9.0,温度70℃,时间120min;DCS的制备略有改动,浆浓为2.0%以增加DCS的浓度。实验结果如图10所示。

图10 PL用量对马尾松漂白浆DCS的CD值的影响
从图10中可以看出,随着PL用量的增加,DC的CD值逐渐减小,当PL用量为80 U时,DCS的CD值下降30%。比较图7和图10发现,在实验范围内,PL对马尾松漂白化学机械浆DCS的处理效果不如PGL。通过实验发现,PL对PGA和果胶都有酶解作用,但对果胶更为有效;而PGL对PGA的酶解效果较好,对果胶也有一定的酶解作用(可能是果胶中含有一定量的果胶酸)。因此,推断在漂白浆DCS中的果胶类物质主要是以果胶酸的形式存在(未被甲基化),在选用果胶酶时应选用PGL;处理纸浆时应选用PL。
2.3 PGL酶解处理对DCS稳定性的影响
果胶酸主要是在H2O2漂白过程中产生的,是水系统中阴离子垃圾的重要来源,易与钙离子结合,对钙离子引起的凝聚具有促进作用[10-11]。果胶酶PGL虽然可以通过酶解果胶质来降低马尾松漂白化学机械浆DCS的CD值,但果胶质酶解以后可否在一定程度上提高DCS的稳定性需要进一步研究。因此,选用PGL处理马尾松漂白化机浆的DCS。条件为:DC 300 mL,pH值9.0,温度70℃,时间120 min。处理以后的DCS样品调节pH值为5.0、温度60℃,然后加入一定量的预热至60℃的CaCl2溶液,反应30 min,离心(500 g,30 min)取上清液测其浊度结果如图11所示。
在未经酶处理的体系中,碳水化合物(中性聚糖和果胶质)会吸附在胶体颗粒的表面;加入钙离子以后,由于果胶质的存在两者起到类似“架桥”的作用,将胶体颗粒絮凝并沉淀下来,果胶质与钙离子反应生成的聚集物并非在体系中单独存在,而是始终与胶体颗粒连在一起,并在离心时沉淀下来,所以体系没有出现浊度上升的现象。

图11 PGL处理对马尾松漂白化机浆DCS稳定性的影响(离心)
然而,从图11中可以看出,PGL处理以后的DCS样品中加入少量钙离子时,体系的浊度急剧升高,但这不能说明处理以后的样品稳定性提高了。在实验中发现,酶处理以后的样品在加入钙离子后会变得更加浑浊,样品中产生白色絮团(比水轻),甚至产生分层现象。这是因为经过果胶酶处理以后,部分果胶质会从胶体颗粒的表面释放到水相中;当加入钙离子时,这些“游离”的低DP果胶质就会与之反应生成不溶物,但由于钙离子的加入量较少,生成的不溶物不足以相互聚集并在离心时沉淀下来,而是悬浮在样品中,造成浊度的非正常升高。当加入的钙离子足够多时,不溶物絮团增大,在离心时被除去,浊度开始快速下降;表现在图中就是,残余浊度曲线出现明显的拐点(见图中大圆点)。PGL用量为240 U时曲线的拐点要小于60 U的,且曲线后段的斜率也大(绝对值),因为前者酶解产生的“游离”低聚果胶质多,易于生成大絮团。
为了尽量消除钙离子与果胶质生成的不溶物对浊度测定的影响,将最后的离心过程改为过滤。取少量反应后的样品,用GF/A(孔径1~2μm)玻璃纤维滤纸进行过滤,取滤液测定其浊度。得到的实验结果如图12所示。从图12中可以看出,DCS经PGL处理以后,稳定性改善不明显。结合图11的分析可以得出,马尾松化学机械浆DCS经PGL酶处理以后虽然对提高DCS的稳定性作用不大,但可以减缓其沉淀的速度。
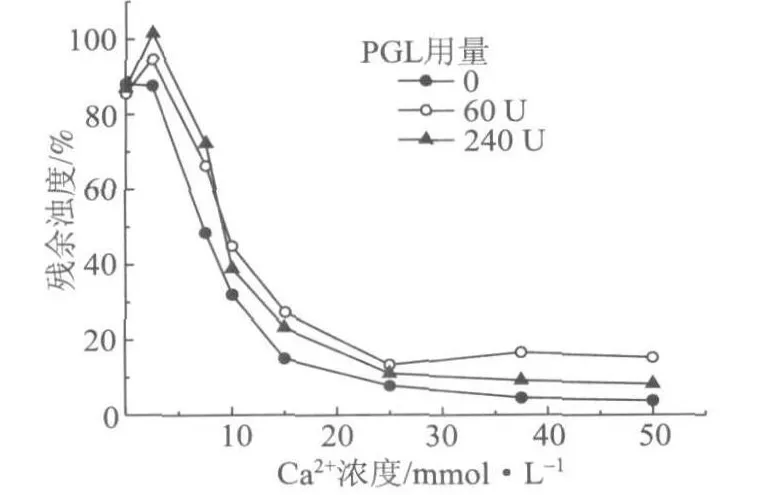
图12 PGL处理对马尾松漂白化学机械浆DCS稳定性的影响(滤液)
3 结 论
3.1 果胶酸(盐)裂解酶(PGL)可以降解果胶酸模型物PGA,降低其阳离子需求量(CD值),较优的条件为pH值9.0,温度60℃,120 min。
3.2 PGA在聚合度较小时(<6),仅消耗少量的阳离子聚合物(P-DADMAC);当聚合度超过6时, PGA的CD值开始明显上升。因此在对PGA类物质进行果胶酶处理以降低CD值时,没有必要将其完全酶解成单体,而只需将其聚合度降为6左右即可。
3.3 PGL果胶酶可以去除马尾松化学机械浆DCS中的果胶酸类物质,降低其CD值;但处理以后,CD值只下降了约40%。因此不能仅仅靠果胶酶来完全降低DCS的CD值。
3.4 碱性果胶酶PL可以有效地酶解PGA,当用量为200 U时(底物5 mg),果胶的CD值下降约80%。较优的处理条件为:温度70℃,pH值9.0, 120 min。同时,PL可以有效地降低马尾松漂白浆DCS的CD值。在漂白浆DCS中的果胶类物质主要是以果胶酸的形式存在,在选用果胶酶时应选用果胶酸(盐)裂解酶PGL。马尾松化学机械浆DCS经PGL酶处理以后虽然对提高DCS的稳定性作用不大,但可以减缓其沉淀的速度。
[1] Thornton J,Ekman R,Holmbom B,et al.Polysaccharides dissolved from Nor way spruce in ther momechanicalpulping and peroxide bleach ing[J].Journal of Wood Chemistry and Technology,1994,14 (2):159.
[2] Thornton J,Ekman R,Holmbom B,et al.Release of potential“an ionic trash”in peroxide bleaching ofmechanical pulp[J].Pap Puu, 1993,75(6):426.
[3] FrancisD W,OuchiM D.Effect of dissolved and colloidal solids on newsprint properties[J].Journal of Pulp and Paper Science,2001, 27(9):289.
[4] Nur miM,Byskata J,Eklund D.On the interaction between cationi polyacrylamide and dissolved and colloidal substances in thermome chanical pulp[J].Paperi ja Puu/Paper and Timber,2004,86 (2):109.
[5] Thornton J W.Enzymatic degradation of polygalacturonic acids re leased from mechanical pulp during peroxide bleaching[J].Tapp Journal,1994,77(3):161.
[6] Heli Kangas K,Espoo F,Anna Suurnäkki V,et al.Modification o the surface chemistry of T MP with enzymes[J].Nordic Pulp and Pa per Research Journal,2007,22(4):415.
[7] Shobha M,Vishu Kumar A,Tharanathan R,et al.Modification o guar galactomannan with the aid of Aspergillus niger pectinase[J]. Carbohydrate Polymers,2005,62(3):267.
[8] Solbak A,Richardson T,McCann R,et al.Discovery of pectin-degrading enzymes and directed evolution of a novel pectate lyase for processing cotton fabric[J].Journal of Biological Chemistry,2005, 280(10):9431.
[9] Sundberg K E,SundbergA C,Thornton J W,et al.Pectic acids in the production of wood-containing paper[J].Tappi Journal,1998, 81(7):131.
[10] Sundberg K,Thornton J,Holmbom B,et al.Effects of wood poly saccharides on the stability of colloidal wood resin[J].Journal o Pulp and Paper Science,1996,22(7):226.
[11] Garnier C,AxelosM A V,Thibault J-F.Phase diagrams of pectin calcium systems:influence of pH,ionic strength,and temperatur on the gelation of pectins with different degrees of methylation[J]. Carbohydrate Research,1993,240:219.
Abstract:The efficiency and mechanism of two pectinases degrade or hydrolyze model substances and DCS from Masson pine BCT MP wer evaluated.The optimal conditions for pectate lyase(PGL)and alkaline pectinase(PL)treatmentwere as follows:pH 9.0,60℃,120mi for PGL,and pH 9.0,70℃,120 min for PL.Both pectinase could effectively degrade the pectics in the DCS ofMasson pine BCT MP,wit PGL beingmore efficient,due to the unmethylated for m of pectic substances inDCS ofBCT MP.The hydrolysismechanis m of PGA with PGL was investigated.The results showed that it was not necessary to hydrolyze the polymeric pectics to be monomers,in order to reduce it cationic demand,instead itwas hydrolyzed to a average DP of 6 would be acceptable.TreatmentofDCS from Masson pineBCT MPwith PGL could not preventDCS from complete aggregation by calcium ions,but the rate of aggregation was lowered.
Keywords:pectinase;dissolved and colloidal substances;enzymatic hydrolysismechanism;degree of polymerization
(责任编辑:孙秋菊)
Enzymatic Hydrolysis of Pectic Substances and its Effect on the Stability of DCS from Mason Pine BCTM P
ZHANG Chun-hui*ZHAN Huai-yu L IJing L IBing-yun FU Shi-yu
(State Key Lab of Pulp and Paper Engineering,South China University of Technology, Guangzhou,Guangdong Province,510640)
(*E-mail:chunhui@scut.edu.cn)
Q55
A
1000-6842(2010)-02-0039-06
2010-02-01(修改稿)
国家自然科学基金资助项目(编号20676047,30771689)和中国(广州)留学生交流会难题招贤项目(200621-I0021)。
张春辉,男,1979年生;博士;主要从事二次纤维利用、胶黏剂控制以及生物质转化等方面的研究。
E-mail:chunhui@scut.edu.cn

