黄芪多糖对暴露于苯、甲醛环境中小鼠脾脏的保护作用
石 勇,胡梦林,于艾清,宋祥福,修家祺,李铁骥
(1.吉林大学公共卫生学院,长春 130021;2.吉林大学第一医院,长春 130021)
研究报告
黄芪多糖对暴露于苯、甲醛环境中小鼠脾脏的保护作用
石 勇1,胡梦林1,于艾清2,宋祥福1,修家祺1,李铁骥1
(1.吉林大学公共卫生学院,长春 130021;2.吉林大学第一医院,长春 130021)
目的探讨黄芪多糖对暴露于苯、甲醛环境中小鼠脾脏的保护作用。方法将 40只雄性小鼠随机分成 4组,即对照组、苯甲醛染毒组(苯:5 g/m3,甲醛:50 mg/m3)、苯甲醛染毒黄芪多糖低剂量保护组[黄芪多糖: 10 mg/(kg·d),苯:5 g/m3,甲醛:50 mg/m3]、苯甲醛染毒黄芪多糖高剂量保护组[黄芪多糖:20 mg/(kg·d),苯: 5 g/m3,甲醛:50 mg/m3]。采用静式吸入染毒,每天 2 h,连续 30 d,并同时采用饮水的方式给予黄芪多糖保护。末次染毒 24 h内,处死小鼠,对小鼠脾中谷胱甘肽 (GSH)含量及谷胱甘肽过氧化物酶 (GSH-PX)活性进行测定和分析。结果苯、甲醛染毒黄芪多糖保护各组脾组织中 GSH含量和 GSH-PX活性均高于苯、甲醛染毒组,均有统计学意义(P<0.01)而与对照组的差异无统计学意义 (P>0.05),苯、甲醛染毒黄芪多糖保护组高剂量组脾组织中GSH-PX活性高于低剂量组,差异有统计学意义(P<0.01)。结论黄芪多糖对暴露于苯、甲醛环境中小鼠脾脏具有保护作用,且对脾中 GSH含量的作用有随剂量增加而增大的趋势,对脾中 GSH-PX活性的作用随剂量增加而增大。
苯;甲醛;黄芪多糖;脾;谷胱甘肽;谷胱甘肽过氧化物酶
苯及甲醛是工业生产中重要的生产原料,室内污染物的主要来源也是由一些建筑装饰产品中释放出的苯和甲醛。室内环境的污染指数与患病危险性呈线性关系[1]。苯和甲醛对造血系统具有损害作用[2],并具有一定的遗传毒性[3,4]。黄芪多糖(Astragalus polysaccharides,APS)具有多种功能,如免疫促进、抗肿瘤以及促进造血系统功能的作用[5]。本文采用亚急性动物实验,通过苯和甲醛联合染毒后给与 APS,观察对小鼠脾脏中 GSH以及GSH-PX含量的影响,研究其对脾脏的保护作用。
1 材料和方法
1.1 实验动物与分组
吉林大学基础医学院实验动物中心清洁级雄性 I CR小鼠[SCR-(吉)2003-0001]40只,体重 18~20 g。随机分为对照组、苯醛染毒组 (苯:5 g/m3,甲醛:50 mg/m3)、苯醛染毒黄芪多糖低剂量保护组[黄芪多糖:10 mg/(kg·d),苯:5 g/m3,甲醛:50 mg/m3]、苯醛染毒黄芪多糖高剂量保护组[黄芪多糖:20 mg/(kg·d),苯:5 g/m3,甲醛:50 mg/m3],共 4组,每组均为 10只小鼠。
1.2 实验试剂与器材
99.9%苯,分析纯,天津市光复精细化工研究所;38%甲醛,分析纯,天津化学试剂二厂;谷胱甘肽(GSH)试剂盒,南京建成生物工程研究所;谷胱甘肽过氧化物酶 (GSH-PX)试剂盒,南京建成生物工程研究所;黄芪多糖,本实验室自备;56 L静式染毒柜 8个;722型光栅分光光度计,上海第三分析仪器厂。
1.3 实验动物染毒
对小鼠采用静式染毒,每天 2 h,连续 30 d,同时采用饮水的方式给与黄芪多糖保护,根据预实验实测每天小鼠饮水量结果,确定每组小鼠的给水总量,以确保正式实验时每组鼠把水溶液总量全部饮完,然后进一步确定每只鼠给予黄芪多糖量及水溶液浓度。小鼠黄芪多糖实际摄入量分别为:对照组0 mg/(kg·d);黄芪多糖低剂量保护组 10 mg/(kg ·d);黄芪多糖高剂量保护组 20 mg/(kg·d)。
1.4 脾脏检查
1.4.1 内脏组织匀浆的制备:取脾组织称重,用生理盐水冲洗干净后,分别加入 10倍质量的生理盐水,匀浆,离心 (3500 r/min,10 min),取上清,于4℃中保存,24 h内进行检测。
1.4.2 脾生化指标测定:用试剂盒对脾组织 GSH含量、GSH-PX活性进行测定。
1.5 统计学处理
各组数据处理经 SPSS 13.0统计软件进行数据处理。
2 结果
2.1 各组GSH含量
由表 1可见,苯、甲醛染毒组脾脏中 GSH的含量与对照组相比明显降低(P<0.01);苯、甲醛染毒黄芪低剂量保护组和高剂量保护组与苯、甲醛染毒组相比 GSH含量明显升高(P<0.01)。
表 1 脾组织中 GSH的含量 (±s,n=10,mg/gprot)Tab.1 Content of GSH in spleen tissues (±s,n=10,mg/gprot)
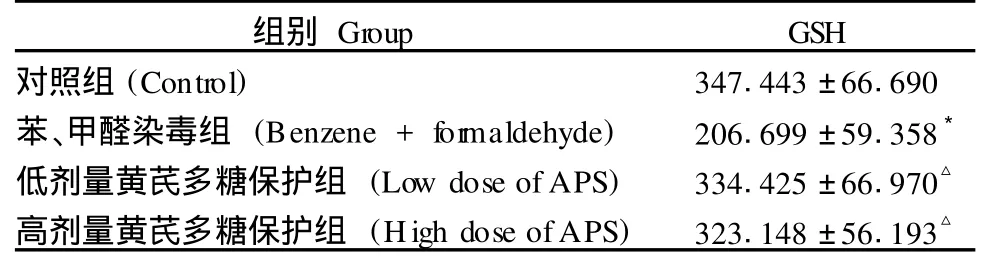
表 1 脾组织中 GSH的含量 (±s,n=10,mg/gprot)Tab.1 Content of GSH in spleen tissues (±s,n=10,mg/gprot)
注:*P<0.01 vs对照组,△P<0.01 vs与苯、甲醛染毒组比较。Note:compared with control group*P<0.01;compared with Benzene and formaldehyde group△P<0.01.
组别 Group GSH对照组(Control) 347.443±66.690苯、甲醛染毒组 (Benzene+for maldehyde) 206.699±59.358*低剂量黄芪多糖保护组 (Low dose ofAPS) 334.425±66.970△高剂量黄芪多糖保护组 (High dose ofAPS) 323.148±56.193△
2.2 各组GSH-PX活性
表 2 脾组织中 GSH-PX活性(±s,n=10,U/mg·Pr)Tab.2 GSH-Px activity in spleen tissues (±s,n=10,U/mg·Pr)
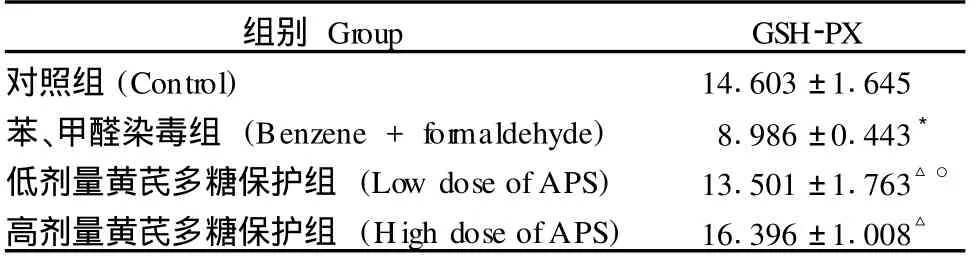
表 2 脾组织中 GSH-PX活性(±s,n=10,U/mg·Pr)Tab.2 GSH-Px activity in spleen tissues (±s,n=10,U/mg·Pr)
注:*P<0.01与对照组比较;△P<0.01与苯、甲醛染毒组比较;○P <0.01与高剂量黄芪保护组比较。Note:compared with control group*P<0.01;compared with Benzene and formaldehyde group△P<0.01;compared with high dose of APS group○P<0.01.
组别 Group GSH-PX对照组(Control) 14.603±1.645苯、甲醛染毒组 (Benzene+for maldehyde) 8.986±0.443*低剂量黄芪多糖保护组 (Low dose ofAPS) 13.501±1.763△○高剂量黄芪多糖保护组 (High dose ofAPS) 16.396±1.008△
由表2可见,苯、甲醛染毒组明显低于对照组(P<0.01);苯、甲醛染毒高剂量黄芪多糖保护组和黄芪多糖低剂量保护组的 GSH-PX活性明显高于苯、甲醛染毒组(P<0.01),且APS高剂量保护组与低剂量组相比明显升高(P<0.01)。
3 讨论
黄芪多糖对造血系统有着广泛的影响。黄芪多糖对人骨髓粒单集落、红细胞集落的形成均有促进作用,对造血功能障碍有明显保护作用[6]。黄芪多糖对动物机体免疫器官的促进作用,主要体现在对动物胸腺、脾脏、法氏囊等免疫器官重量的增加及对创伤动物免疫器官重量减轻的拮抗作用。黄芪多糖能显著提高机体细胞免疫和体液免疫的能力,黄芪多糖可刺激正常小鼠脾细胞的增殖反应,还可明显促进适量浓度 ConA与LPS诱导脾细胞的增殖反应[7,8]。
苯和甲醛可引起多系统损害,如呼吸系统、生殖系统、免疫系统[9,10]等的损害并且与血液疾病的发生有重要关系[11,12]。苯的毒作用与苯在体内代谢过程中产生醌类、·、·OH、H2O2等自由基有关[13]。甲醛可以引起小鼠脂质过氧化的发生,从而造成机体损害的发生[14]。

本次研究中发现,染毒 30 d后苯、甲醛染毒组小鼠脾中 GSH的含量明显低于对照组,同时也明显低于苯、甲醛染毒黄芪多糖保护的两组,苯、甲醛染毒黄芪多糖保护的两组在同时染毒的情况下与对照组相比差异不大,且高剂量黄芪多糖保护组 GSH含量高于低剂量 APS保护组以及对照组。这表明苯、甲醛会引起脾中 GSH含量下降,可能是由于这两种物质在体内会导致多种自由基的生成,GSH会与自由基结合从而引起其含量下降。在一定范围内,GSH含量越高说明机体受到的损伤越小。因此,虽然受黄芪多糖保护的两染毒组差异无统计学意义,但还是可以得出APS保护组的保护效果具有随剂量增加而升高的趋势。至于无统计学意义的原因,可能与染毒同时加保护的时间较短有关,还需进一步的研究。
此外,染毒 30 d后苯、甲醛染毒组 GSH-PX活性明显低于对照组。表明苯和甲醛会导致脾中GSH-PX活性下降,可能是由于苯和甲醛及其代谢产物造成的损伤超过机体代偿,机体的抗氧化能力开始降低,而 GSH-PX是体内重要的氧化物分解酶,所以 GSH-PX活性降低。另外受到 APS保护的两组 GSH-PX活性明显高于染毒组,并且APS高剂量保护组明显高于低剂量保护组。因此可以说明APS保护组对脾脏具有一定的保护效果,并且在一定范围内随剂量增加保护作用加强,但其作用机制还有待于进一步研究。
综上,黄芪多糖对小鼠脾中 GSH含量及 GSHPX的活性均有影响,对暴露于苯、甲醛环境中小鼠脾脏具有一定的保护作用,且随着黄芪多糖剂量的增加保护作用加强。
[1] 杨绪.武汉市某报社办公楼不良建筑物综合症的流行病学调查[J].中国公共卫生,1998,4(3、4):74-80.
[2] 金泰廙,孙贵范.职业卫生与职业医学 (第 5版)[M].北京:人民卫生出版社,2003:207.
[3] 何以平.苯的遗传毒性和代谢物[J].现代预防医学,2005,32 (9):1082-1084.
[4] 李红霞,黄厚今.甲醛的毒性研究进展[J].国外医学卫生学分册,2006,33(2):114-117.
[5] 黄桢.黄芪多糖的药理研究进展[J].中国临床药学杂志, 2002,11(5):315-317.
[6] 张仲平,洪介民.黄芪多糖对体外人骨髓造血细胞生成的影响[J].中药药理与临床,2000,16(1):16-17.
[7] 单俊杰,王顺春,刘涤,等.黄芪多糖体的化学和药理研究进展[J].上海中医药大学学报,2000,14(3):62-65.
[8] 许杜娟,陈敏珠.黄芪多糖对小鼠免疫功能的影响[J].安徽医药,2003,7(6):418-419.
[9] AoyamaK. Effectofbenzene inhalation on lymphocyte subpopulations and immune response in mice[J].Toxicol Appl Pharmacol,1986,85:92.
[10] Lyapina M,Zhelezova G,Petrova E,et al. Flow cytometric deter mination of neutrophil respiratory burst activity in workers exposed to formaldehyde[J].Int Arch Occup Environ Health, 2004,77(5):335-340.
[11] Snyder R.The benzene problem in historical perspective[J]. Fund Appl Toxicol,1984,4:692-699.
[12] Cole P,Axten C.Formaldehyde and leukemia:an improbable causal relationship[J].Regul Toxicol Pharmacol,2004,40 (2):107-121.
[13] 龚梓初.苯的骨髓毒性机理研究进展[J].劳动医学,1997, 14(1):59-60.
[14] 梁瑞峰,原福胜.甲醛吸入对小鼠脾脏和胸腺的氧化性损伤[J].环境与职业医学,2005,22(5):429-431.
[15] 周爱儒,查锡良.生物化学 (第 5版)[M].北京:人民卫生出版社,2001:10-11.
Protective Effects of Astragalus Polysaccharides on Spleen Tissues from M ice Exposed to Compound of Benzene and Formaldehyde
SH I Yong1,HU Meng-lin1,YU Ai-qing2,SONG Xiang-fu1,X IU Jia-qi2,L I Tie-ji1
(1.Depar tment of SanitaryAnalysis,School of Public Health,Jilin University,Changchun 130021,China; 2.First Hospital,Jilin University,Changchun 130021,China)
ObjectiveTo study the protective effect of Astragalus polysaccharides on spleen tissues。MethodsFortymale mice were divided into 4 groups randomly(10 in each group):control group,benzene and formaldehyde group with no polysaccharide protection(benzene:5 g/m3,for maldehyde:50 mg/m3),low dose of Astragalus polysaccharides group with benzene and formaldehyde[Astragalus polysaccharides:10 mg/(kg·d),benzene:5 g/m3,for maldehyde:50 mg/m3],high dose of Astragalus polysaccharides group with benzene and for maldehyde[Astragalus polysaccharides:20 mg/(kg·d),benzene:5 g/m3,formaldehyde:50 mg/m3].The mice were exposed to benzene and formaldehyde 2 hours per day for 30 days continuously,and offered waterwith Astragalus polysaccharides,the mice were killed within 24 hours after the last exposure.The content of glutathione(GSH)and the activities of glutathione peroxidase(GSH-PX)were determined and detected in spleen tissues。ResultsThe contents of GSH and the activities of GSH-PX in spleen tissues in mice from the Astragalus polysaccharides protecting groups were significantly higher than that of the benzene and for maldehyde group(P<0.01),and had no significant difference to the control groups(P>0.05).The activities ofGSH-PX in spleen tissues of the low dose Astragalus polysaccharides protecting group were significantly lower than that of the high dose Astragalus polysaccharides protecting group(P<0.01)。Conclusions It is suggested that Astragalus polysaccharides could protect the spleen tissues from benzene and formaldehyde and better protection with higher dose of Astragalus polysaccharides.
Benzene;For maldehyde;Astragalus polysaccharides;Spleen;Glutathione;Glutathione peroxidase
R122.2
A
1671-7856(2010)03-0051-03
2009-10-29
石勇(1964-),男,讲师,研究方向:药物化学。
李铁骥,男,副教授,研究方向:工业废弃物对环境的影响。

