ERK活化对哮喘大鼠气道重塑及CyclinD1表达的影响
张爱芝,张焕萍,蔺鹏翔
(1.山西医科大学,太原 030001;2.山西医科大学第一临床医学院呼吸内科,太原 030001)
研究报告
ERK活化对哮喘大鼠气道重塑及CyclinD1表达的影响
张爱芝1,张焕萍2,蔺鹏翔1
(1.山西医科大学,太原 030001;2.山西医科大学第一临床医学院呼吸内科,太原 030001)
目的探讨细胞外信号调节蛋白激酶(ERK)对哮喘大鼠气道重塑及 CyclinD1表达的作用。方法原代培养大鼠的平滑肌细胞(AS MCs),给予 ERK激动剂表皮生长因子 EGF和抑制剂 PD98059干预AS MCs生长,依处理方式不同分为 5组:(1)正常对照组 (2)哮喘对照组;(3)E组:EGF20 ng/mL;(4)P+E组,PD98059 10 μmol/L 1 h后添加 EGF 20 ng/mL;(5)PD组,PD98059 10μmol/L。采用四甲基偶氮唑盐 (MTT)法检测气道平滑肌细胞(AS MCs)增殖能力,流式细胞术 (FCM)测定细胞周期和 cyclinD1的蛋白含量,RT-PCR方法检测 cyclinD1 mRNA表达水平。结果(1)与哮喘对照组比较,E组AS MCs S+G2/M期比例、吸光度 A值、cyclinD1蛋白阳性表达率和 cyclinD1 mRNA的A值均显著升高,PD组均显著降低(P<0.05)。P+E组与哮喘对照在此 4项指标上比较无明显差异。(2)哮喘(对照组、E组、PD组和 P+E组)组与正常对照组,其 S+G2/M期比例、吸光度 A值、cyclinD1蛋白和 cyclinD1 mRNA的表达均显著增高 (P<0.05)。结论ERK活性促进哮喘大鼠AS MCs的增殖,增加 cyclinD1在哮喘平滑肌细胞中的表达,导致气道重塑的形成,提示 ERK可能对 CyclinD1的表达具有调节作用。
CyclinD1;细胞外信号调节激酶;气道重塑;哮喘
细胞外信号调节蛋白激酶 (ERK)是丝裂原活化蛋 白 激 酶 (mitogen-activated protein kinase, MAPK)家族中的一个亚族,参与细胞增殖、分化、凋亡等多种生理病理过程,特别是在调节细胞增殖过程中起着重要的作用[1],研究证实,D1类细胞周期蛋白 (cyclinD1)主要存在与气道平滑肌细胞,在调节细胞周期 G1期向 S期转变的过程中起关键作用[2]。细胞周期的进行依赖于 ERK的持续激活和核内的滞留[3]。目前 ERK对哮喘大鼠气道平滑肌细胞增殖调控的确切机制尚未阐明,以及 ERK对哮喘大鼠平滑肌细胞 CyclinD1调控的相关研究报道甚少。本实验在细胞水平和基因水平探讨 ERK对在哮喘平滑肌细胞增殖的作用和对 CyclinD1表达的影响。
1 材料和方法
1.1 实验材料
清洁级健康雄性W istar大鼠山西医科大学实验动物中心提供 (合格证号:山医字第 070101)。ERK特异性激活剂表皮生长因子 (EGF)及抑制剂PD98059购自美国 Peprotech公司;抗 cyclinD1抗体购于 Santa Cruz公司;其余为进口或国产试剂。
1.2 方法
1.2.1 AS MCs的培养鉴定:用OVA制备 6周哮喘模型,原代培养大鼠平滑肌细胞,通过形态学观察和小鼠平滑肌α-肌动蛋白 (α-actin)免疫细胞化学染色鉴定为AS MCs。
1.2.2 实验分组:实验用培养的第 3~6代气道平滑肌细胞,换无血清DMEM培养 24 h,使细胞生长同步于 G0期,换用含 10%FBS的DMEM液,再分别应用 ERK激活剂 EGF及抑制剂 PD98059干预AS MCs,根据给药方式不同分为 5组:(1)正常对照组;(2)哮喘对照组;(3)E组,EGF 20 ng/mL;(4)P +E组,PD98059 10μmol/L 1 h后添加 EGF20 ng/ mL,细胞培养再持续 24 h;(5)PD组,PD98059 10 μmol/L。干预后的 AS MCs放入 CO2培养箱中共培养 12 h,进行下述实验。每 5个复孔/瓶为一组,实验重复 3次。
1.2.3 流式细胞仪分析 AS MCs细胞周期:收集各组的AS MCs用 PBS制成浓度为 1×107/mL的细胞悬液,用 -20℃预冷的 75%乙醇在 4℃过夜固定,离心后加入 RNA酶 37℃作用 30 min后,再加入 PI室温避光 30 min,直接用 FACsort型流式细胞仪(型号:BECK MAN)检测,Cell quest软件分析细胞周期中各期所占的百分比。
1.2.4 四甲基偶氮唑蓝 (MTT)微量比色法测定AS MCs增殖:消化各组平滑肌细胞制成浓度为 1.0 ×107cells/L的细胞悬液,每孔 200μL接种于 96孔板。使细胞同步化后再换成各组的培养液培养 16 h,之后每孔加 20μL(5 g/L)MTT溶液,继续培养 4 h。培养结束后,加入 150μL二甲基亚砜 (DMSO)溶液,振荡 30 min后,用酶联免疫检测仪于 490 nm比色测定。结果以A值表示。实验重复 3次。
1.2.5 流式细胞仪测定 AS MC中 cyclinD1的表达情况:取同代的各组 AS MC制成 5×107cells/L浓度,用 0.01 mol/LPBS液洗 2次;加 50μL细胞固定液,室温静置 15 min,用 0.01 mol/L PBS液洗涤细胞后,1500 r/min离心 5 min,弃上清的细胞碎片;加50μL细胞破膜剂,避光静置 10 min后,直接加 9 μL鼠抗 cyclinD1单抗 (设一空白对照组),混匀避光室温孵育 30 min;用 PBS液洗 2次,再加 8μL的FITC标记羊抗鼠 IgG,常温避光染色 30 min后,再PBS液洗 2次,弃去上清液,加 500μL PBS直接用FACS Calibur流式细胞仪进行检测,Multicyle软件分析各组细胞表达 CyclinD1的阳性百分率,用阳性细胞表达百分率值表示 cyclinD1蛋白的相对含量,检测重复 3次。
1.2.6 逆转录聚合酶链式反应 (RT-PCR)检测CyclinD1的 mRNA表达水平:CyclinD1引物序列:上游:5′-GCG TAC CCT GAC ACC AAT CT-3′下游: 5′-GGC TCC AGA GAC AAG AAA CG-3′扩增产物片断为 232bp。GAPDH引物序列:上游 5′TGA ACG GGA AGC TCA CTG G-3′,下游 5′-TCC ACC ACC CTG TTG CTG GA-3′,扩增产物片断 307 bp。PCR反应条件:94℃预变性 2 min,94℃变性 20 s,58℃退火 1 min,72℃延伸 30 s,共进行 32个循环,最后72℃延伸 5 min,扩增产物经 2%琼脂糖凝胶电泳,采用 Quantity one 4.6软件分析扩增产物条带灰度值(A):取目的基因与 GAPDH的A值的比值为该目的基因的相对含量。
1.2.7 统计学处理:应用统计分析软件包 SPSS13. 0进行统计学分析。实验数据以均数 ±标准差(¯x± s)表示,多组间比较采用 F检验,两两之间比较采用 q检验。
2 结果
2.1 细胞鉴定(图 1~2见彩插 2)
经原代培养的AS MCs在倒置显微镜下为典型“峰和谷”生长状态(图 1)。α-actin免疫细胞化学染色阳性,即所培养的细胞鉴定为平滑肌细胞[4](图 2)。
2.2 细胞增殖活性检测
2.2.1 流式细胞仪分析 AS MCs细胞周期:哮喘对照组与正常对照组相比,S+G2/M期细胞所占比例明显升高(P<0.05)。EGF处理组 S+G2/M期细胞所占比例与哮喘对照组相比,明显增高 (P< 0.05);PD处理组则明显减少 (P<0.05)。P+E组与哮喘对照组比较,差异不显著 (表 1)。
2.2.2 MTT法检测细胞增殖:与哮喘对照组 A490值相比,哮喘 E组 A490值增高,哮喘 PD组 A值降低,差异均显著(P<0.05)。哮喘 P+E组与正常对照组比较,A值升高,差异显著 (P<0.05);哮喘 P+ E组与哮喘对照组比较差异不显著(表 1)。

表 1 AS MCs增殖活性表达情况Tab.1 Proliferation levels ofAS MCs in each group
2.3 哮喘大鼠 ASMCs的 cyclinD1蛋白和cycl inD1mRNA表达

图 3 用 FCM测哮喘平滑肌细胞 CyclinD1的表达Fig.3 CyclinD1 expression ofAS MCswere detected by FCM
如图 3、4所示,与哮喘对照组比较,EGF组和PD组 cyclinD1蛋白和 cyclinD1 mRNA的表达分别为 (1.419±0.401)、(0.716±0.064),差异显著 (P <0.01)。P+E组与哮喘对照组比较cyclinD1蛋白和mRNA的表达差异不显著。P+E组与正常空白组比较,A值比值上升;与 PD组比较A值下降,差异均显著。cyclinD1蛋白表达与 cyclinD1 mRNA表达呈正相关。
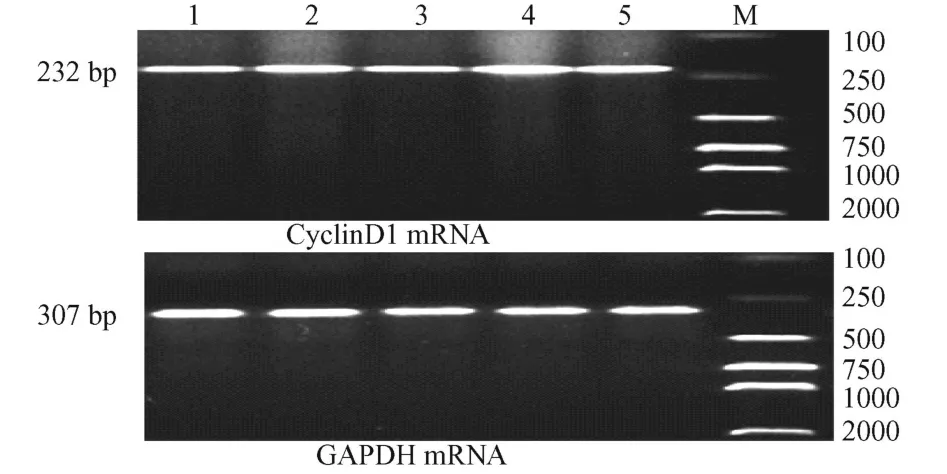
图 4 大鼠AS MCs CyclinD1 mRNA表达Fig.4 RT-PCR amplification of Expression of CyclinD1 mRNA in AS MCs
3 讨论
哮喘是以气道高反应性、气道炎症和气道重塑为特征的慢性疾病,气道平滑肌细胞的异常增殖是参与哮喘气道重塑的重要因素[5]。本研究的目的在于研究 ERK对平滑肌细胞增殖的作用及对CyclinD1表达的调节作用。
Duan和 Wong等[6]研究显示 ERK抑制哮喘气道炎症的形成,激酶抑制剂通过抑制炎症反应来治疗哮喘。目前 ERK对细胞增殖的调控机制是一个研究的热点[7],为了更好的阐明 ERK信号通道对哮喘大鼠气道平滑肌细胞增殖的调控作用及对CyclinD1作用的研究,本实验采用 ERK激动剂 EGF和抑制剂 PD98059分别干预平滑肌细胞的增殖。哮喘对照组AS MCs细胞增殖水平明显高于正常对照组,提示哮喘平滑肌细胞增殖活跃。给予 ERK激动剂 EGF的刺激后,AS MCs细胞增殖水平明显增高;给予 ERK抑制剂 PD98059则抑制细胞增殖,提示 ERK的活性与细胞增殖水平密切相关,与张晓宇研究一致[8]。PD98059阻止了部分 EGF的作用,这表明在慢性哮喘大鼠平滑肌细胞增殖中 ERK起了重要的促进作用,进一步证实 ERK信号通路参与了大鼠平滑肌细胞增殖的调控。
近年来对细胞增殖周期的研究表明[9]:细胞周期调控是在各期的控制点上进行的,细胞周期中存在两个重要的调控点:G1/S和 G2/M期调控点,只要 G1期内的正性调节因子累积达到一定程度,周期越过 G1/S交界点,以后细胞就不再依赖于细胞外促生长因子而顺序完成整个细胞周期,因而 G1/S调控点是影响细胞周期的关键。CyclinD1特异性地表达于细胞增殖周期的 G1期,调控着 G0期细胞向G1期的转化,是细胞增殖周期启动的重要调控因子。Inoue等[10]研究报道在哮喘免疫方面 ERK对SPRED蛋白有调节作用,抑制 SPRED蛋白可作为治疗哮喘的新策略,因此推测 ERK在哮喘平滑肌细胞增殖中对 CyclinD1有调节作用,抑制 CyclinD1表达可阻止哮喘气道重塑。
实验结果显示,与正常对照组比较,哮喘对照组 cyclinD1 mRNA和蛋白表达增加,提示在哮喘平滑肌细胞中 cyclinD1表达活性提高。给予 EGF处理之后,cyclinD1 mRNA和蛋白表达水平均显著增高;给予 PD98059处理AS MCs之后,cyclinD1mRNA和蛋白表达水平均明显降低;这表明 ERK活性影响了 cyclinD1的表达,同时细胞周期时相也发生了改变,即 S+G2细胞增加或减少,促进或阻止了细胞从 G0/G1期向 S期转化的进程,提示 ERK的活性影响细胞周期的进行,表明 cyclinD1在平滑肌细胞增殖中的表达与 ERK信号途径存在密切的关系。联合应用 EGF和 PD98059组与哮喘对照组比较, cyclinD1 mRNA和蛋白表达水平无显著变化,细胞周期时相也未发生变化,进一步阐明了 ERK对哮喘大鼠气道平滑肌细胞增殖周期中的 cyclinD1可能具有调控作用。此外,联合应用 EGF+PD98059组的cyclinD1 mRNA和蛋白表达水平略低于哮喘对照组,表明 PD98059抑制作用大于 EGF激活 ERK活性促进 cyclinD1表达的作用,提示除了 ERK之外,也可能还存在其他机制对 cyclinD1表达进行调控。
以上实验结果表明,ERK活化在哮喘大鼠AS MCs增殖中起重要作用,促进哮喘气道重塑的形成,对细胞周期蛋白 (cyclinD1)可能具有调控作用,明确 ERK对 cyclinD1的调控作用,可以把 ERK或cyclinD1作为靶点来抑制气道重塑的形成,为治疗哮喘提供新方向。但目前 ERK对细胞周期的各个时期和多种蛋白的调控机制尚不清楚,如对 G2/M期及其它周期蛋白 (cyclinE、CDK4等)调控远未明了,还有待于进一步深入研究。
[1] He H,Pannequin J,Tantiongco JP,et al.Glycine-extended gastrin stimulates cell proliferation and migration through a Rhoand ROCK-dependent pathway,not a Rac/Cdc42-dependent pathway[J].Am J Physiol GastrointestLiver Physiol,2005,289 (3):G478-488.
[2] Liu Y,Templeton DM.Iron-loaded cardiac myocytes stimulate cardiac myofibroblastDNA synthesis[J].Mol Cell Biochem, 2006,281(1-2):77-85.
[3] Ravenhall C,Guida E,Harris T,et al.The importance of ERK activity in the regulation of cyclinD1 levels and DNA synthesis in human cultured air way smooth muscle[J].Br J Pharmacol, 2000,131(1):17-28.
[4] 张晓宇,徐永健,刘先胜,等.香烟提取物经级联反应促进支气管哮喘大鼠气道平滑肌细胞增殖[J].中华结核和呼吸杂志,2009,32(5):390-393.
[5] Wang PY,Weng J,Anderson RG,et al.OSBP is a cholesterol regulated scaffolding protein in control of ERK 1/2 activation [J].Science,2005,307(5714):1472-1476.
[6] DuanW,WongWS.Targetingmitogen-activated protein kinases for asthma[J].CurrDrug Targets,2006,7(6):691-698.
[7] Roberts PJ,Der CJ. Targeting the Raf-MEK-ERK mitogenactivated protein kinase cascade for the treatment of cancer[J]. Oncogene,2007,26:3291– 3310.
[8] 范晓燕,张焕萍.p-ERK1/2及 ERK2mRNA在哮喘大鼠气道中的表达变化[J].中国比较医学杂志,2008,18(3):14-18.
[9] Kavurma MM,Khachigian LM.ERK,JNK,and p38 MAP kinases differentially regulate proliferation and migration of phenotypically distinct smooth muscle cell subtypes[J].J Cell Biochem,2003,89(2):289-300.
[10] Inoue H,Fukuyama S,Matsumoto K,et al.Role of endogenous inhibitors of cytokine signaling in allergic asthma.Curr Med Chem.2007;14(2):181-189.
Effect of ERK on Asthmatic Rat A irway Remodeling and CyclinD1
ZHANGAi-zhi1,ZHANG Huan-ping2,L IN Peng-xiang1
(1.Shan XiMedicalUniversity,Tai Yuan 030001,China;2.Department of Respiration First Affiliate Hospital of Shan XiMedicalUniversity,Tai Yuan 030001,China)
ObjectiveTo investigate the effects of ERK on asthma air way remodeling and the expressions of cyclinD1。MethodsThe rat asthma model was made through ovalbumin(OVA)sensitization and excitation.Primary cultures ofAS MCswere established and cells between passages 3 and 6 were used for experiments.AS MCs were treated with ERK activator epidermal growth factor(EGF)and inhibitor PD98059,and then subdivided into 5 groups based on the drug interventions:(1)Normal control group;(3)Asthmatic control group;(3)Asthmatic EGF group;(4)P+E group, PD98059 10μmol/L+EGF 20 ng/mL;(5)PD98059 group.The proliferations ofAS MCswere examined with cell cycle analysis and MTT colorimetric assay,the expressions of cyclinD1 mRNA were detected by RT-PCR,and the protein expression of cyclinD1 wasmeasured by FCM。ResultsCompared to asthmatic control group,the percentage of cells at S +G2/M phase,Avalue,the expression of cyclinD1 mRNA and cyclinD1 protein from E group were significantly increased (P<0.05);the PD group were significantly reduced respectively(P<0.05).There was no significant difference between P+E group and the asthmatic control group in the above four index. (2)Compared with normal control group,the percentage of cells at S+G2/M phase,Avalue,the expression of cyclinD1 mRNA and cyclinD1 protein from asthmatic group(control group,E group,P group and P+E group)were significantly increased(P<0.05)。ConclusionTheactivation of ERK promotesAS MCsproliferation and expressionsof cyclinD1 in asthmatic rats,indicating that the expression of CyclinD1 may be dependenton the ERK activation in asthmatic rats.The findingwill help to understand the mechanisms of airway remodeling.
CyclinD1;Extracellular signal-regulated kinase(ERK);Airway remodeling;Asthma
R563
A
1671-7856(2010)03-0026-04
2009-11-16
山西省教育厅 2005年山西省高校科技研究开发项目(20051001)。
张爱芝(1985-)女,硕士生,研究方向:哮喘发病机制的研究。E-mail:Aizhi2008@126.com
张焕萍,女,博士,硕士生导师。E-mail:zhp326@163.com

