S W1990和 Capan-2红色荧光标记胰腺癌移植肿瘤模型的建立和比较
李小颖,苏 卫,张连峰
(中国医学科学院实验动物研究所北京协和医学院比较医学中心,卫生部人类疾病比较医学重点实验室,北京 100021)
研究报告
S W1990和 Capan-2红色荧光标记胰腺癌移植肿瘤模型的建立和比较
李小颖,苏 卫,张连峰
(中国医学科学院实验动物研究所北京协和医学院比较医学中心,卫生部人类疾病比较医学重点实验室,北京 100021)
目的建立稳定表达红色荧光蛋白基因的人胰腺癌细胞系,为体内监测肿瘤的早期生长及抗肿瘤药物的药效评价建立一种新的肿瘤动物模型。方法以 Lipofectamine 2000介导 chickenβ-actin-RFP-NEO转染人胰腺癌细胞 S W1990和 Capan-2,经梯度浓度 G418筛选获得稳定表达红色荧光蛋白的细胞克隆并扩大培养。BALB/ cA-nu裸鼠皮下接种 1×106个发光细胞使其成瘤,活体荧光成像系统观察肿瘤的生长情况。结果获得了稳定表达 RFP的两种不同的人胰腺癌细胞株,将其接种到裸鼠体内可成瘤,利用活体成像系统观察了肿瘤的生长动态过程,并且 S W1990肿瘤细胞的生长速度较 Capan-2细胞快。结论用红色荧光蛋白标记的人胰腺癌细胞建立的裸鼠肿瘤模型为胰腺癌的研究和相关药物筛选提供了可进行荧光影像活体、动态分析的动物模型。
人胰腺癌细胞;红色荧光蛋白;活体荧光成像系统
肿瘤细胞系 S W1990和 Capan-2均为源于男性白人的胰腺癌细胞,组织培养,呈现上皮样细胞特征;接种裸鼠后,组织病理学上类似于原发癌,肿瘤呈现高分化的腺癌样生长[1,2]。人胰腺癌细胞株S W1990为高转移人胰腺癌细胞株,1978年取自一名 58岁胰尾癌并脾转移的男性患者,CEA阳性, 1979年患者死于肝转移。S W1990由美国学者Kyriazis等建株[1]。人胰腺癌细胞株 Capan-2取自胰腺导管腺癌,产生高水平粘蛋白 MUC-1的mRNA,低水平粘蛋白MUC-2的mRNA但是不表达粘蛋白MUC-3基因.目前国内外学者主要集中于胰腺癌转移机制的研究[3-7]。
本实验利用红色荧光蛋白 (red fluorescent protein,DsRed)基因分别标记 S W1990和Capan-2肿瘤细胞,结合光学影像分析技术,连续、动态地观察和比较两种不同的人胰腺癌细胞在裸鼠皮下生长及形成瘤体的过程,建立了光学肿瘤模型。
1 材料和方法
1.1 材料
1.1.1 试剂与仪器:人胰腺癌细胞 S W1990和Capan-2本实验室冻存,L-谷氨酰胺 (G IBCO公司)、双抗(G IBCO公司)、DMEM(G IBCO公司)、胎牛血清 (G IBCO公司 )、G418(AMRESCO公司 )、Lipofectamine 2000 Reagent(Invitrogene公司 )。Whole-body optical imaging system (I.C.E.,日本Roper公司)、倒置荧光显微镜(OLY MPUS IX71)、倒置显微镜 (Nikon TS100)。
1.1.2 实验动物:BALB/cA-nu裸小鼠购自北京维通利华实验动物技术有限公司[XCXK(京)2007-0001],鼠龄 5周,体重 15~18 g,在本实验室无特定病原体 (specific-pathogen free,SPF)的饲养间饲养。所有实验操作程序均经过实验动物研究所实验动物使用管理委员会批准 (批准号为 GC-09-2001)。
1.2 方法
1.2.1 细胞培养:用含 10%胎牛血清、100 IU/mL青霉素,100μg/mL链霉素的 DMEM培养基作为S W1990和 Capan-2细胞的培养液,于 5%CO2,37℃细胞培养箱内常规培养。
1.2.2 构建带有筛选标记的载体:chickenβ-actin-RFP由本实验室构建[8,9]。
1.2.3 细胞转染和筛选:采用 Lipofectamine 2000 Reagent转染 S W1990和 Capan-2细胞 (具体转染步骤参照 Lipofectamine 2000 Reagent操作说明)。转染后 24 h,用含 1000μg/mL G418的培养液筛选细胞 3周,获得稳定表达 RFP的细胞株,选择其中高表达的克隆株扩大培养。
1.2.4 肿瘤细胞的植入及活体荧光成像:收集处于生长对数期的转染细胞,稀释至 5×106/mL。各取三只BALB/cA-nu裸鼠进行皮下接种,1×106个细胞/只,每隔一周观察一次,饱和三溴乙醇 (0.18 mL/10 g)麻醉后放入活体荧光影像系统摄像,Slide Book 4.0软件进行分析。
2 结果
2.1 稳定高表达D sRed的细胞株克隆
S W1990和 Capan-2采用脂质体 2000转染,用含 1000μg/mL G418的培养液筛选细胞三周,获得稳定表达 RFP的细胞株。稳定高表达 DsRed的两种细胞,在荧光显微镜下均呈强荧光,并且荧光较均匀的分布于整个细胞内。单克隆 DsRed细胞在无 G418筛选压力下,传代数次后仍能稳定高水平表达DsRed(图 1,彩插 1)。细胞形态和未转染细胞无明显区别。
2.2 D sRed荧光标记 SW 1990和 Capan-2小鼠肿瘤模型的动态观察
分别将对数生长期的DsRed标记的 S W1990和Capan-2肿瘤细胞皮下接种于 3只 BALB/cA-nu,1 ×106/只。在接种后的 7、14、21、28和 35 d观察肿瘤的生长情况。在接种的第 7天就可以观察到肿瘤荧光,通过肿瘤组织发出的荧光的光子数确定肿瘤的大小,随着观察天数的增加,肿瘤的体积和发光强度增加,且具有很好的相关性 (图 2和图 3,彩插2)。以肿瘤细胞发射的光子数对小鼠荷瘤时间作图得到荧光蛋白标记的两种不同肿瘤细胞在裸鼠体内的生长曲线 (图 4),发现 S W1990肿瘤明显比Capan-2快。
3 讨论
DsRed是红色荧光蛋白 (red fluorescent protein, RFP)的一种,是从印度洋-太平洋中海葵相关的Discosoma sp中分离得到的生物发光蛋白,相对分子质量为 28×103。它能在紫外线激发时发出红色荧光,其最大激发波长为 558 nm,最大发射波长为583 nm,且发射峰位于培养基、组织培养玻璃器材及细胞成分等产生的荧光背景范围之外[10]。RFP能在哺乳动物细胞中高效表达,可用于示踪活细胞内基因表达调控、蛋白质转运及蛋白质之间的相互作用等。与绿色荧光蛋白各种变异体比较,DsRed能提供更高的信噪比。而且,由于 DsRed为长发射波长,故细胞中荧光转换效率更高,较短发射波长的绿色和蓝色荧光信号更为清楚。与其他报告基因比较,DsRed具有观察方便、灵敏度高、对极端 pH值和光漂白抗性强、定性和定量测定方便等特点,因而日益受到关注。
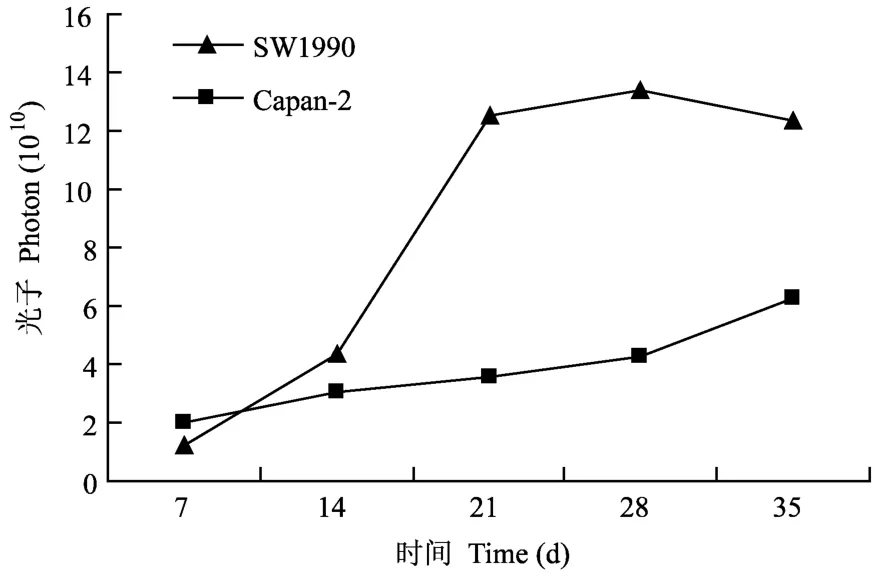
图 4 红色荧光标记两种胰腺肿瘤的生长曲线Fig.4 Thegrowthcurve of Capan-2-DsRedand S W1990-DsRed in vivo
活体动物体内光学成像技术对疾病动物模型微小病灶的检测灵敏度极高,该技术能够进行无创、实时、动态的动物活体观察,从而对同一实验对象进行不同时间点的观察,减少实验动物个体间差异,与传统的实验方法相比,可以大大减少动物的用量,符合替代、减少、优化的“3R”原则。本实验中将强启动子 chickenβ-actin启动的 RFP基因转染到人胰腺癌细胞株 S W1990和 Capan-2中得到了高表达DsRed荧光蛋白细胞株。经过多次传代表达水平稳定,标记细胞的形态、生长方式、生长速度及致瘤能力等与未转染细胞无明显差异,可以反映S W1990和 Capan-2肿瘤细胞生物学行为的标记细胞,其他标记细胞的研究报道也证实了类似的结果[11]。将 RFP标记的两种人胰腺癌细胞经皮下接种至BALB/cA-nu裸鼠,用活体荧光成像系统连续观察,发现能够成瘤,并且肿瘤的体积与发光强度有相关性,建立了一种新的能够用于活体内连续监测肿瘤生长的动物模型。此癌症模型利用无创伤活体荧光成像对癌细胞生长的检测,可对癌症治疗之前和过程中的癌细胞的变化进行实时观测和评估,可应用于癌症体内用药的疗法中。另外,从两种不同肿瘤细胞在裸鼠体内的生长曲线发现S W1990肿瘤细胞的恶性程度远远高于 Capan-2肿瘤细胞,S W1990高肝转移的人胰腺癌细胞株具有侵袭力强、转移效率高和转移范围广的特点,常用来深入研究胰腺癌肝转移机理的理想细胞系[12-15]。综上,活体成像系统具有较高的灵敏度,能够客观评价 S W1990-Ds Ded和 Capan-2-DsRed细胞在裸鼠体内的生长情况,为成像系统在胰腺癌的发展机制、药物治疗、基因治疗等方面的研究提供重要的参考依据。
[1] Kyriazis AP,McCombsⅢ WB, Sandberg AA, etal. Establishment and characterization of human pancreatic adenocarcinoma cell line S W-1990 in tissue culture and the nude mouse[J].Can Res,1983,43:4393-4401.
[2] KyriazisAA,KyriazisAP,Sternberg CN,et al.Morphological, biological,biochemical,and karyotypic characteristics of human pancreatic ductal adenocarcinoma Capan-2 in tissue culture and the nude mouse[J].Can Res,1986,46:5810-5815.
[3] Sawada T,Kimura K,Nishihara T,et al.TGF-beta1 downregulates ICAM-1 expression and enhances liver metastasis of pancreatic cancer[J].AdvMed Sci,2006,51:60-65.
[4] Huang C,Cao J,Huang KJ,et al.Inhibition of STAT3 activity with AG490 decreases the invasion of human pancreatic cancer cells in vitro[J].Can Sci,2006,97(12):1417-1423.
[5] Teraoka H,Sawada T,Yamashita Y,et al.TGF-beta1 promotes livermetastasisofpancreatic cancer bymodulating the capacityof cellular invasion[J].Int J Oncol,2001,19(4):709-715.
[6] 蒋海飚,胥明,王兴鹏,等.Galectin-3在人胰腺癌细胞株S W1990增殖浸润中的作用[J].胰腺病学,2006,6(6):330 -333.
[7] 黄陈,裘正军,江弢,等.RNAi沉默 STAT3对人胰腺癌细胞侵袭能力的影响[J].中华普通外科杂志,2008,23(4):292 -295.
[8] 冯娟,高苒,全雄志,等.红色荧光和绿色荧光转基因小鼠模型的建立[J].中国实验动物学报,2007,15(04):267-270.
[9] 李小颖,高凯,刘学丽,等.人结直肠癌细胞 HCT116红色和绿色荧光标记肿瘤模型的建立 [J].中国比较医学杂志, 2009,19(9):7-10.
[10] 邢飞跃,赵克森,秦清和,等.人内皮细胞一氧化氮合酶红色荧光蛋白报告基因载体的构建与表达[J].中华医学杂志, 2002,82(16):1093-1096.
[11] Chishima T,Yang M,Miyagi Y,et al. Governing step of metastasis visualized in vitro[J]. Proc Natl Acad Sci USA, 1997,94(11):11573-11576.
[12] 诸琦,曹海霞,黄佳,等.人类真核延伸因子 1A2对胰腺癌细胞侵袭、转移能力的影响 [J]?中华消化杂志,2008,28 (11):751-754.
[13] 高臻,黄陈,裘正军,等.抑制信号转导与转录激活因子 -3基因表达对人胰腺癌细胞转移能力的影响[J].中华外科杂志,2008,46(13):1010-1013.
[14] Zhou L,Zhang RF,Yao WY,et al.Decreased expression of Angiotensin-converting enzyme 2 in pancreatic ductal adenocarcinoma is associated with tumor progression[J].Tohoku J Exp Med,2009,217(2):123-131.
[15] Sawai H,Okada Y,Funahashi H,et al.Basement membrane proteins play an important role in the invasive processes of human pancreatic cancer cells[J].J Surg Res,2008,144(1):117-123.
The Establishment and Comparison of TwoM ouse Transplanted Tumor M odels with D sRed-labeled SW1990 and Capan-2 Human Pancreas Cancer CellL ines
L IXiao-ying,SU Wei,ZHANGLian-feng
(KeyLaboratory of Human Diseases ComparativeMedicine,Ministry of Health;Institute ofLaboratoryAnimal Science, Chinese Academy ofMedical Sciences(CAMS)&ComparativeMedicine Centre,PekingUnionMedical Collage(PUMC),Beijing 100021,China)
ObjectiveTo establish DsRed-labeled human pancreas cancer cell lines and to generate a noninvasive model for monitoring tumor growth in vivo.M ethod Human pancreas cancer cells of S W1990 and Capan-2 were transfected with chickenβ-actin-DsRed-neo byLipofectamine 2000 reagent and screened with G418 to produce the stable DsRed-expressing clone.Then the labeled S W1990 and Capan-2 cellswere implanted into the subcutaneous tissue of nude mice and the growth of the implanted tumorwas observed and analyzed with the whole-body optical imaging system.Result The stable DsRed-expressing S W1990 and Capan-2 cell lines were established and the cell line was used to duplicate the implanted tumormousemodel.The growth of the tumormasswith red fluorescentprotein labeled S W1990 and Capan-2 was observed after inoculation of the cells below dorsal blank ofBALB/cA-nu。ConclusionThe implanted tumormousemodel ofDsRed-labeled S W1990 and Capan-2 cell was established,which was a convenient model for the dynamic and in vivoresearch on the human pancreas cancer and drug discovery.
Human pancreas cancer cell;Red fluorescent protein;Whole-body optical imaging system
R541
A
1671-7856(2010)03-0012-03
2009-09-15
卫生部行业基金,实验动物和人类疾病动物模型资源扩展(200802036)和十一五新药专项支持(2009ZX09501-026)。
李小颖,实习研究员,主要研究方向:人类疾病动物模型。
张连峰。E-mail:zhanglf@cnilas.org

