固定化对柴油生物脱硫菌UP-1性能的影响
侯影飞,王增林,张 建,郭 宁,孔 瑛
(1.中国石油大学重质油国家重点实验室,山东青岛 266555; 2.中石化胜利油田博士后科研工作站,山东东营 257015)
固定化对柴油生物脱硫菌UP-1性能的影响
侯影飞1,2,王增林2,张 建2,郭 宁1,孔 瑛1
(1.中国石油大学重质油国家重点实验室,山东青岛 266555; 2.中石化胜利油田博士后科研工作站,山东东营 257015)
为获得稳定高效生物脱硫催化剂,采用海藻酸钠(SA)包埋法制备生物脱硫菌UP-1的固定化细胞,使用环镜扫描电镜(ESE M)对固定化细胞进行分析和表征。结果表明:固定化细胞可以重复使用 5次以上,而未固定化细胞只能有效重复使用 2~3次;固定化小球内部的网状结构、表面的致密表层和固定化细胞初始阶段存在覆盖物,说明 SA是固定UP-1的合适载体,反应底物和产物在固定化载体中的传质阻力增加和包埋材料对UP-1的初始覆盖导致了固定化UP-1脱硫活性的降低;最佳条件下得到的固定化细胞菌体在载体内部均匀饱和分布,这从微观结构上证明固定化可以提高生物催化剂总脱硫能力和稳定性。
微生物学;固定化细胞;生物脱硫;环境扫描电镜;施氏假单胞菌UP-1
对于杂环类含硫化合物如二苯并噻吩(DBT)等由于受空间位阻的影响,常用的脱硫技术较难脱除,近年来迅速发展的生物脱硫技术可以选择性地脱除此类硫化物[1-3]。20世纪 60年代出现的固定化生物催化剂技术,通过再生活化能够显著提高生物催化剂的使用寿命,保持生物催化剂的原始状态,有良好的稳定性和重复使用性,避免细胞的流失,简化了反应体系的后续分离过程,可以有效解决酶或细胞作为高效生物催化剂存在的稳定性差、与产品分离困难、容易流失的问题[4-7]。笔者采用包埋法对生物脱硫菌 Pseudom onas stutzeriUP-1进行固定化研究,使用环境扫描电镜(ESEM)[8-10]对固定化细胞内部结构和状态进行检测和表征,分析固定化对生物脱硫菌性能的影响机制。
1 材料与方法
1.1 菌种及细胞培养
菌种为具有自主知识产权的脱硫菌 Pseudom onas stutzeriUP-1(ZL03156758.4)[11]。将菌种UP-1接种于 50 mL新鲜桑特斯培养基[12]的 250 mL锥形瓶中,放入转速为 200 r/min、温度为 31℃恒温摇床中培养一定时间。然后利用冷冻高速离心机 (-4℃,10 kr/min,20 min)将菌体从培养液中分离,将得到的UP-1菌体用磷酸盐缓冲液洗涤 3~5次,再用生理盐水洗涤 1次,备用。
1.2 固定化细胞制备
将收集的细菌菌体加入溶解好的 3%海藻酸钠(Sodium alginate,简称 SA)胶液中,混合均匀,搅拌状态下用注射器滴入 4℃交联剂中成球。
1.3 固定化细胞脱硫实验
以二苯并噻吩(DBT)作为模型化合物进行脱硫实验。
水体系脱硫实验:准确称量一定量的DBT放入250 mL的三角瓶中,高压蒸汽灭菌后,用微量的DMF将其溶解分散,再加入 50 mL灭菌水,得到水反应体系。然后称量 0.625 g菌体当量的固定化细胞加入瓶中,放进恒温摇床最佳温度下反应。用40.0 mL正己烷萃取反应体系中的硫化物,正己烷中的硫含量可以利用气相色谱和微库仑综合分析仪测定,根据降解前后DBT的质量浓度计算脱硫率。
模拟油 -水体系的脱硫实验:将DBT溶于十二烷作为模拟柴油,DBT质量浓度为 500 mg/L,水相体积为 50 mL,油水比为3∶10,加入 1.0 mL传质助剂,恒温摇床最佳温度下反应。反应结束,先将固定化细胞与反应混合液分离,反应混合液再离心,测定油相DBT质量浓度,分析降解效果。
1.4 固定化细胞内部结构观察
固定化细胞先经过液氮速冻 15 min,迅速放入冷冻干燥机,于 -45℃下干燥24 h,然后使用 ESEM进行检测表征。或者直接将制备得到的含水固定化细胞风干表面水分,在低真空度下使用 ESEM进行结构观察、表征。
2 结果分析
2.1 固定化载体交联后结构
ESEM样品室为低真空 (大于 12.7 kPa),含水样品不必经过传统的脱水、干燥和喷镀金属导电层等处理,可直接在较高的加速电压下观察,省却了繁杂的制样过程,使含水样品的观察研究变得极为方便,消除了因样品处理而造成的人为假象。图 1是SA小球的 ESEM照片。从图 1(a)的沉淀后 SA小球湿态 ESEM照片可以看出,载体通过交联沉淀形成了格子型内部结构,这种网状微细结构有利于细菌的包埋和附着,在有效包埋UP-1细胞的同时提供充足水分。图1(b)是 SA小球经冷冻干燥后的断面ESEM照片,可见,虽然经过液氮速冻和冷冻干燥后存在变形,但其断面照片清楚显示了其格子状的内部结构,适合固定化微生物细胞。图 1(c)表明 SA小球外表面没有UP-1细胞出现,图 1(d)表明固定化小球表面存在致密层(厚度 30~35μm)、内部存在大孔道,此层极薄的致密球壳可以有效地防止颗粒内部菌体的外流[13],内部大孔道有利于底物、产物和溶氧的传递。综上可见,SA是一种较为理想的包埋材料。

图1 不同状态和部位的 SA小球 ESEM照片Fig.1 ESEM pictures of SA spherule under different state and position
2.2 固定化细胞质量浓度的选择
图 2是细胞浓度对固定化细胞降解 DBT效果的影响曲线。菌体质量浓度大于 0.048 g/mL之后,随着菌体质量浓度的增加,降解率的增长并不明显。图 3为固定化细胞内部 ESEM照片。可以看出:菌体质量浓度为 0.05 g/mL时,UP-1细胞分布均匀,接近均匀饱和分布(均匀饱和分布是指菌体在载体内分布紧凑均匀、不重叠、不堆积);菌体质量浓度为 0.025 g/mL的固定化细胞内部,菌体分散不均匀,达不到均匀饱和分布。脱硫实验和 ESEM检测一致证明,固定化细胞中菌体质量浓度为 0.048 g/ mL是最合适的。


2.3 固定化对 UP-1在水体系中脱硫性能的影响
图 4是固定化前、后 UP-1对 DBT降解曲线。可见,细菌UP-1固定化以后,其脱硫活性明显降低,脱硫速率变慢。未固定化细胞和固定化细胞分别在反应时间为 20和 120 h之前,具有相对较快的反应速率,之后,反应速率趋于平稳,降解率的增加不明显。这是由微生物反应过程中存在反馈抑制作用和扩散效应造成的[14]。当反应开始时,酶体系活性较高,底物含量高,反馈抑制作用小,反应速率较快,扩散推动力大,产物较容易扩散到载体外的水相中,所以降解率增加较快;随着底物含量下降,产物含量增加,反馈抑制作用加强,反应速率下降,同时传质推动力降低,导致降解效果趋于恒定。
使用前、后固定化小球干燥后 ESEM照片见图5。可以看出,使用后的固定化小球内部交联层的厚度明显增加,表面变得模糊和粗糙,可能是没有扩散出来的反应物质和代谢产物沉积所致,这也证明了扩散效应对DBT降解反应影响较大,是固定化细胞脱硫效率下降的一个主要因素。结合图 1(d)发现的固定化小球存在的致密层,可以认为反应物和产物的扩散阻力在致密层最大,致密层的存在也是固定化细胞脱硫速率显著降低的主要原因之一。

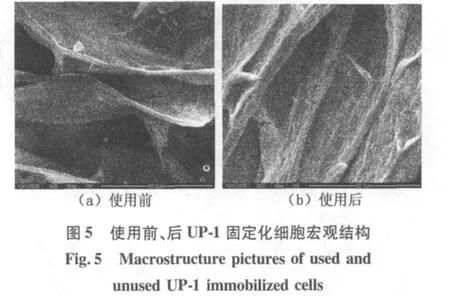

图 6 使用前、后固定化 UP-1细胞微观结构Fig.6 I nternalm icrostructure of used and unused UP-1 i mmobilized cells
图 6是固定化细胞使用前、后内部细胞状态变化照片。使用前菌体表面有覆盖物,而使用后细胞清晰,说明在使用过程中,被包埋的菌体能够摆脱部分覆盖物而与底物接触,从而能够催化DBT降解反应。在考察时间内细胞数量并没有明显变化,表明所选择的载体能够将脱硫菌株 UP-1牢固地包埋固定,没有出现大量增殖或流失。UP-1细胞表面存在包埋材料的覆盖,在初始阶段阻碍了DBT和UP-1细胞的接触,导致了其脱硫速率降低,但是覆盖物的厚度 (图 6)远远小于表皮致密层 (图 1)的厚度,因此菌体表面的覆盖物是脱硫速率降低的次要影响因素。
2.4 固定化对 UP-1在水体系中使用性能的影响
表 1是UP-1的固定化前、后脱硫细胞的重复使用情况。可以看出:开始阶段未固定化细胞的对DBT的降解率高,脱硫速率高,但其使用寿命太短;固定化细胞效果十分稳定,脱硫效率只是稍有下降;相对于单位质量的生物催化剂,DBT的加入量为 500 mg/L时,固定化细胞的总脱硫能力 (降解 DBT总量)为62.5 mg,远远大于未固定化细胞的 35.42 mg。可以认为,固定化对微生物的本质特性没有影响或影响很小,但其催化脱硫稳定性有了较大提高。
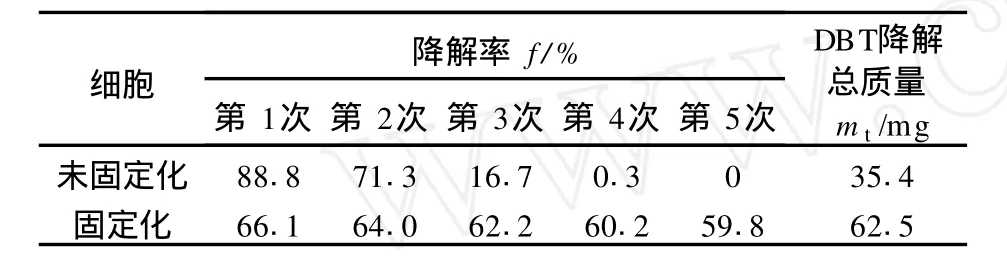
表 1 UP-1未固定化和固定化细胞稳定性比较Table 1 Stability comparison of non-i mmobilized and i mmobilized cell
2.5 固定化对 UP-1在模拟油 水体系中脱硫性能的影响
UP-1固定化前、后在不同油水比下脱硫性能见表2(反应时间均为72 h,模拟油DBT质量浓度为500 mg/L)。由表 2可以看出,无论是UP-1固定化细胞还是未固定化细胞,最优脱硫效果对应的油水比均是1∶8,随着油水比的降低,降解率都趋向于升高,两者脱硫性能差别不大。可见在模拟油体系中底物DBT在油水之间传递速率受到了限制,在一定程度上抵消了底物扩散对固定化细胞脱硫速率的影响,导致两者在模拟油体系中的脱硫性能相差较小。

表 2 固定化对 UP-1在模拟油 水体系中脱硫性能的影响Table 2 I nfluence of immobilization on desulfurization performance in modeling oil-water system
2.6 固定化对 UP-1在模拟油 水体系中使用性能的影响
在模拟油 -水体系中未固定化细胞 48 h脱硫率即达到稳定,而固定化细胞最佳脱硫时间是 100 h,在各自最佳脱硫反应时间下进行了二者重复使用性能的考察,结果见图 7。实验油水比为1∶8,活化是在0.9%NaCl溶液中进行的。菌株UP-1未固定化细胞对DBT的降解能力在第 1次降解实验结束后就急剧下降,第 3次降解实验基本上就失去了脱硫活性,重复使用性能很差。虽然固定化细胞最高脱硫率(55%左右)低于未固定化细胞(62%左右),但是固定化细胞在模拟油 -水体系的脱硫性能稳定,在重复使用了 5次之后脱硫性能才有明显下降。这说明固定化之后细胞在模拟油 -水体系的脱硫活性稳定性得到了提高。

图 7 固定化对 UP-1在模拟油 水体系中稳定性的影响Fig.7 Influence of immobilization on stability in modeling oil-water system
3 结 论
(1)利用环境扫描电镜可以清楚的观察到含水固定化小球内部的网状结构和表面的致密表层,也可以清晰观察到脱硫菌体在固定化载体中的分布状态。
(2)SA是石油生物脱硫菌 Pseudom onas stutzeri UP-1合适的固定化载体,反应底物和产物在固定化载体中的传质阻力主要集中在致密表层;最佳条件下(SA质量分数为 3%时,细菌固定化质量浓度为0.048 g/mL)得到的固定化细胞菌体在载体内部均匀饱和分布,不出现重叠和累积,固定化载体形成了网状结构和含水大通道,有利于底物和产物扩散。
(3)相对于生长细胞,固定化降低了 UP-1的脱硫活性,但提高了其总脱硫能力和脱硫性能的稳定性,UP-1固定化细胞在水体系和模拟油-水体系均可以有效重复使用 5次以上,而未固定化细胞只能有效重复使用 2~3次。脱硫菌UP-1固定化之后活性降低的原因,一是固定化小球存在的致密层加大了反应物和产物的扩散阻力,二是包埋材料对UP-1的初始覆盖阻碍了反应底物与细胞的快速有效接触。
[1] 张英,李伟,王妙冬,等.微杆菌 ZD-M2降解二苯并噻吩的特性及其生长条件优化[J].化工学报,2005,56 (7):1295-1299.
ZHANG Ying,L IWei,WANGMiao-dong,et al.Selective-desulfurization of dibenzothiophene byM icrobacterium spZD-M2 and optimization of growth conditions[J]. Journal of Chemical Industry and Engineering,2005,56 (7):1295-1299.
[2] 李维彬,张浩,田淑梅,等.石油加工中生物脱硫技术的进展[J].炼油与化工,2007,18(4):4-8.
L IWei-bin,ZHANG Hao,TI AN Shu-mei,et al.Progress of bio-desulfurization technology in petroleum processing[J].Refining and Chemical Industry,2007,18 (4):4-8.
[3] 李玉光,李望良,邢建民,等.石油生物脱硫过程和反应器的研究进展 [J].化工学报,2006,57(5):1040-1047.
L I Yu-guang,L IWang-liang,XI NG Jian-min,et al.Research advance´s in bioreactors and bioprocesses for biodesulfurization of petroleum[J].Journal of Chemical Industry and Engineering,2006,57(5):1040-1047.
[4] 王洪祚,刘世勇.酶和细胞的固定化 [J].化学通报, 1997(2):22-27.
WANG Hong-zuo,L I U Shi-yong. I mmobilization of enzyme and cells[J].Chemistry,1997(2):22-27.
[5] CHANG J H,CHANG Y K,RYU H W,et al.Desulfurization of light gasoil in I mmobilized-cell systemsofGordona spCYKS1 andNocardia spCYKS2[J].FEMSMicrobiolLetter,2000,182(2):309-312.
[6] NA ITO M,KAWAMOTO T,FUJ I NO K,et al.Longterm repeated biodesulfurization by immobilizedRhodococcus erythropolisKA2-5-1 cells[J].Appl Microbiol Biotechnol,2001,55(3):374-378.
[7] 马挺,李国强,李剑,等.海藻酸钠-聚乙烯醇共固定化细胞脱除燃料油中的有机硫[J].化工学报,2006,57 (11):2705-2713.
MA Ting,L I Guo-qiang,L I Jian,et al.Desulfurization of diesel fuel by co-immobilized cellswith sodium alginate and polyvinyl alcohol[J].Journal of Chemical Industry and Engineering,2006,57(11):2705-2713.
[8] 严启团,马成华,单秀琴,等.液体样品的环境扫描电镜观察[J].电子显微学报,1998,17(5):680-681.
YAN Qi-tuan,MA Cheng-hua,SHAN Xiu-qin,et al. Observation of liquid sample by environmental scanning electron microscope[J].Journal of Chinese Electron Microscopy Society,1998,17(5):680-681.
[9] SUZUKIJ,MURATA R,SUZUKI T,et al.Observation ofwaterborne protozoan oocysts using a low-vacuum SEM [J].JEOL News,1998,33E:32.
[10] 邵曼君.环境扫描电镜的应用 [J].物理,1998,18 (1):48-52.
SHAO Man-jun.Environmental scanning electronmicroscope and its applications[J].Physics,1998,18(1): 48-52.
[11] 史德青,赵金生,杨金荣,等.施氏假单胞菌对二苯并噻吩的降解[J].中国环境科学,2004,24(6):730-733.
SH IDe-qing,ZHAO Jin-sheng,YANG Jin-rong,et al. Degradation of dibenzothiophene byPseudom onas stutzeri UP1[J].China Environmental Science,2004,24(6): 730-733.
[12] 侯影飞,孔瑛,张建辉,等.石油生物脱硫菌 UP-1的培养及反应条件优化[J].石油大学学报:自然科学版,2005,29(1):111-115.
HOU Ying-fei,KONG Ying,ZHANG Jian-hui,et al. Optimization on cultivation and reaction conditions of petroleum biodesulfurization bacterium UP-1[J].Journal of theUniversity of Petroleum,China(Edition ofNatural Science),2005,29(1):111-115.
[13] 翟晓萌,李道棠.海藻酸钠固定化包埋微生物处理有机微污染源水[J].环境科学,2000,21(6):80-85.
QU Xiao-meng,L I Dao-tang.Organic micropolluted source water treatment by immobilized cells[J].Chinese Journal of Enviromental Science,2000,21(6):80-85.
[14] 曹国民,赵庆祥,孙贤波,等.氨氮、硝酸盐氮和亚硝酸盐氮在 PVA凝胶膜中的扩散性能[J].环境科学, 2002,23(2):65-68.
CAO Guo-min,ZHAO Qing-xiang,SUN Xian-bo,et al. Diffusion coefficients of ammonia,nitrate and nitrite in cell-free and cell-containing PVA gel membranes[J]. Chinese Journal of Enviromental Science,2002,23(2): 65-68.
(编辑 刘为清)
Influence of i mmobilization on performance of diesel biodesulfurizing bacterium UP-1
HOU Ying-fei1,2,WANG Zeng-lin2,ZHANG Jian2,GUO Ning1,KONG Ying1
(1.State Key Laboratory of Heavy O il Processing in China University of Petroleum,Q ingdao266555,China; 2.W ork Station of Post-Doctoral,Shengli O ilfield,SINOPEC,Dongying257015,China)
In order to get stable and efficient biodesulfurization catalyst,immobilization of pseudomonas stutzeriUP-1 was investigated.The immobilization cellsof biodesulfurization bacteriaUP-1were prepared by sodium alginate(SA)embedmethod. Immobilized cellswere analyzed and characterized by using environmental scanning electron microscope(ESE M).The results show that the prepared immobilized cells can be used repeatedly and effectively 5 times,and the unimmobilized cells(UN IC) just can be effectively used 2-3 times.The internal reticular formation,dense surface layerof immobilized cells and cover existing in immobilized cells initial stage show that SA is a suitable carrier of i mmobilization forUP-1.The increase of transport resistance of reaction substrate and product in the immobilized-carrier and the initial cover of embed material overUP-1 result in the decrease of immobilizedUP-1 desulfurization ability.Under the optimum conditions,the distribution of cells is uniform and saturated.The i mmobilization can improve the total desulfurization ability and stability of biodesulfurization catalyst.
microbiology;immobilization cell;biodesulfurization;environmental scanning electron microscope;pseudomonas stutzeriUP-1
Q 819
A
10.3969/j.issn.1673-5005.2010.04.031
1673-5005(2010)04-0157-05
2010-04-07
国家自然科学基金项目(20676128)
侯影飞(1977-),男(汉族),安徽阜阳人,讲师,博士,博士后,研究方向为生物化工和分离工程。

