磁柱分选技术在CMV特异性CD8+T细胞纯化中的应用研究
王新超,张伟,邸旭,姜智,陈宝安
(1.东南大学医学院,江苏南京 210009;2.天津医科大学四中心临床学院肿瘤外科,天津 300140;3.江苏省肿瘤医院妇瘤科,江苏 南京 210009)
巨细胞病毒(cytomegalovirus,CMV)疾病是同种异体外周血干细胞移植后常见并发症和导致死亡的主要原因[1]。CMV特异性CD8+T细胞是阻止或限制CMV反应的关键因素[2],其过继性免疫治疗已经用于CMV疾病的治疗。获得高纯度的CMV特异性CD8+T细胞是过继性免疫治疗的关键。虽然CMV特异性CD8+T细胞体外培养或克隆技术能够有效获得高纯度的 CMV 特异性 CD8+T 细胞[3-4],但由于对技术和费用的要求较高而难以推广。Cobbold等[5]应用四聚体技术纯化CMV特异性CD8+T细胞,虽然取得了较满意的结果,但四聚体试剂随细胞输注入体内可产生毒副作用。本实验探索可否运用磁柱技术联合连锁状多聚体既简便又高效地纯化CMV特异性CD8+T细胞,进而用于CMV疾病的过继性免疫治疗。
1 材料和方法
1.1 主要试剂和设备
连锁状多聚体试剂(包括IS缓冲液、连锁状多聚体磁珠、D-Biotin、CMV连锁状多聚体PE和MHC等)由德国IBA公司提供,抗CD8*PerCP抗体由美国BD公司提供,分别储存于4℃、-20℃和-80℃冰箱。Ficoll-Biocoll和RPMI 1640分离液由德国生物化学AG公司提供;人AB白蛋白由德国DRK公司提供;DPBS、青霉素和链霉素由美国Invitrogen公司提供;BD FACS冲洗液、清理液、浸润液为德国BD公司产品;MACS滤片和MS磁柱为德国Miltenyi Biotec公司产品。
1.2 血标本
所有外周血标本均由HLA-A2/CMV血清阳性健康志愿者提供。外周血单核细胞由Ficoll-Biocoll分离液从血标本中分离获得,经过台盼蓝实验证实其存活率大于95%。外周血单核细胞可以直接用于进一步实验,或冷冻后储存于-80℃超低温冷冻箱或液氮罐中备用。
1.3 分选前后CMV特异性CD8+T细胞的检测
分选前外周血单核细胞标本中的CMV特异性CD8+T细胞的百分比由流式细胞仪检测,用抗CD8*PerCP抗体检测CD8+T细胞,CMV连锁状多聚体PE检测CMV特异性细胞。首先,将外周血单核细胞和HLA-A2/CMV连锁状多聚体PE在4℃、避光的条件下孵育45 min,HLA-A2/CMV连锁状多聚体PE的使用浓度为每106个细胞0.2 μg。其次,将抗CD8*Per-CP抗体和上述标本在4℃、避光的条件下孵育20 min。用PBS洗涤后上流式细胞仪检测,所有标本至少收集106个细胞进行流式细胞分析,每一个标本都做对照实验来定义所染细胞的属性。为了避免死亡细胞和细胞碎片影响实验结果,仅对淋巴细胞进行分析。
1.4 运用MS磁柱分选CMV特异性CD8+T细胞
首先运用CMV连锁状多聚体磁珠复合物标记CMV特异性CD8+T细胞,之后运用MS磁柱将已标记的细胞和未标记的非特异性细胞分离,最后用D-Biotin试剂将连锁状多聚体试剂和CMV特异性CD8+T细胞分离,获得CMV特异性CD8+T细胞。共可分为3部分。
第1部分,将50 μl连锁状多聚体磁珠、8 μl CMV连锁状多聚体MHC和90 μl IS缓冲液在4℃和避光条件下孵育45 min后加入1 ml IS缓冲液。将MS磁柱置于磁场中,用3 ml IS缓冲液冲洗,将上述孵育后的液体注入磁柱分选,未与磁珠结合的CMV连锁状多聚体MHC被洗脱,CMV连锁状多聚体MHC-磁珠复合物滞留于MS磁柱。接着,将MS磁柱移离磁场,加入250 μl IS缓冲液洗脱并收集CMV连锁状多聚体磁珠复合物。将上述CMV连锁状多聚体磁珠复合物与2×107的单核细胞在4℃和避光条件下外周血孵育45 min,洗涤细胞,加入1 ml IS缓冲液,准备分选。
第2部分,将MS磁柱放入磁场,用3 ml IS缓冲液冲洗,将上述细胞悬液注入磁柱。然后,用1 ml IS缓冲液冲洗3次,未与CMV连锁状多聚体磁珠结合的细胞可通过磁柱。将磁柱移离磁场,用1 ml IS缓冲液冲洗3次,洗出已经标记的特异性细胞,收集备用。
第3部分,将上述与磁珠结合的细胞离心、混悬于2 ml IS缓冲液中,加入2 mmol·L-1D-Biotin在4℃和避光条件下孵育20 min后洗涤。重复上述步骤1次,之后用5 ml IS缓冲液洗涤4次,收集所得细胞进行分析。
2 结 果
2.1 标本的选择
为获得CMV特异性CD8+T细胞含量较高的标本,本实验检测了HLA-A2/CMV血清阳性健康志愿者的血标本。结果显示,53.3%的标本中CMV特异性CD8+T细胞阳性,其中25%的标本超过0.5%,将这些标本储存备用。
2.2 CMV特异性CD8+T细胞的纯化率
流式细胞仪检测结果显示,外周血单核细胞标本经过分选后,CMV特异性 CD8+T细胞的纯度最高达到90.45%(图1)。经过一次磁柱分选的CMV特异性CD8+T细胞的纯度为72.33% ~78.95%,经过两次磁柱分选的纯度为85.31% ~90.45%,后者的纯度较前者明显提高(表1)。但经过两次磁柱分选后,CMV特异性CD8+T细胞的数量较仅进行1次磁柱分选明显减少。

图1 运用MS磁柱从HLA-A2/CMV血清阳性健康志愿者血标本中分选的CMV特异性CD8+T细胞Fig 1 Selection of CMV-specific CD8+T cells by MS column from a HLA-A2/CMV-seropositive healthy donor The dot plots show the percentage of CMV specific CD8+T lymphocytes before(A)and after(B)selection.For subpopulations of T lymphocyte,frequency of CMV specific CD8+T lymphocytes was increased from 0.63%to 72.33%after MS selection
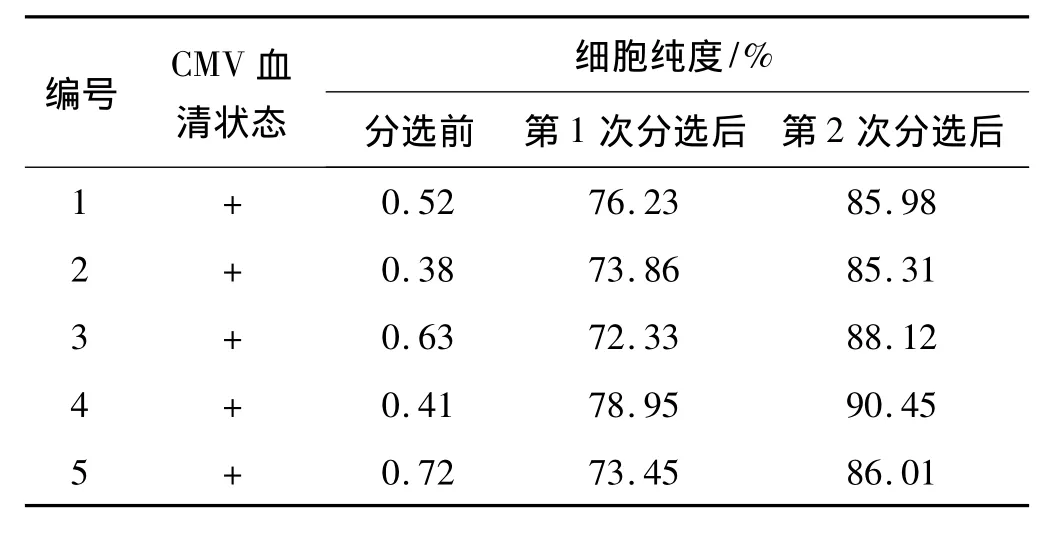
表1 CMV特异性CD8+T细胞的纯度Tab 1 The purity of CMV specific CD8+T cells
3 讨 论
CMV疾病是同种异体外周血干细胞移植常见并发症,严重者可导致死亡[1]。目前,有两种方法治疗,一种是抗病毒药物治疗,另一种是免疫治疗[6-7]。抗病毒药物治疗发展较早,但随着药物毒性和抗药病毒的出现,其疗效已经受到影响[8]。因此,CMV特异性CD8+T细胞的过继性免疫治疗受到关注。研究证明,纯化的CMV特异性CD8+T细胞不仅可以诱导抗病毒反应,而且可以避免移植物抗宿主反应[3]。目前,有两类方法用于获取CMV特异性CD8+T细胞:一类是细胞克隆技术,其价格昂贵、技术复杂,难以推广;另一类直接从外周血中提纯抗原特异性CD8+T细胞,目前有一定的进展[5],但试剂却和细胞牢固结合,可能导致相应的并发症。
连锁状多聚体技术能够鉴别CMV特异性CD8+T细胞,为CMV疾病的诊断和治疗拓展了发展空间[9]。CMV血清阳性健康志愿者的外周血中CMV特异性CD8+T细胞含量相当高,本实验检测结果显示,CMV特异性CD8+T细胞在53.3%的标本中阳性表达。其中,25%的标本中CMV特异性CD8+T细胞含量超过0.5%,使直接从外周血中分选CMV特异性CD8+T细胞成为可能[5]。连锁状多聚体技术的特点是能将已纯化的CMV特异性CD8+T细胞和连锁状多聚体试剂分离,使纯化的T细胞保持了原来的功能状态[10]。其机理是:短肽链Strep-tags和strep-tactin具有高度亲和性(Kd为1 ×10-6mol·L-1),strep-tag Ⅱ和 strep-tactin的亲和力是和抗生蛋白链菌素亲和力的100倍[11]。在生理条件下,strep-tagⅡ可以和重组蛋白结合,用strep-tagⅡ和结合特异性磁珠的strep-tactin组成的MHC多聚体-磁珠复合物标记抗原特异性T细胞,然后利用MS磁柱将已标记的抗原特异性T细胞与其它细胞分离。D-Biotin与strep-tactin有更强的亲和力(Kd<1×10-13mol·L-1),D-Biotin可以和 strep-tagⅡ竞争结合位点,将多聚体磁珠复合物从抗原特异性T细胞分离,从而得到具有功能活性的抗原特异性T细胞[12]。
MS磁柱技术具有简单和实用的优点,有利于分选抗原特异性T细胞[13]。本实验探索联合运用连锁状多聚体磁珠和MS磁柱,建立并优化一个简单、高效的获得CMV特异性CD8+T细胞的方法。本实验选用CMV特异性CD8+T细胞阳性表达的标本,结果显示:经过1次磁柱分选的CMV特异性CD8+T细胞的纯度最高达78.95%,经过两次磁柱分选的纯度最高达到90.45%,经过两次磁柱分选的CMV特异性CD8+T细胞的纯度明显提高。提示磁柱分选技术效果良好,如果想得到高纯度的CMV特异性CD8+T细胞,可采用两次磁柱分选的方法。进一步分析发现,经过两次磁柱分选较1次分选的细胞丢失严重。因此,我们可以根据对CMV特异性CD8+T细胞纯度的要求不同,采用1次或两次磁柱分选。
总之,联合运用连锁状多聚体磁珠复合物和MS磁柱技术不仅可以得到高度纯化的CMV特异性CD8+T细胞,而且连锁状多聚体试剂和磁珠可与细胞分离,进而被洗脱、除去,这样就避免了由试剂导致的副作用,如机体对试剂的免疫反应、T细胞的定向移动功能的丢失等,有利于发展CMV特异性CD8+T细胞的过继性免疫治疗。
[1]LJUNGMAN P,BRAND R,EINSELE H,et al.Donor CMV serologic status and outcome of CMV-seropositive recipients after unrelated donor stem cell transplantation:an EBMT megafile analysis[J].Blood,2003,102(13):4255-4260.
[2]GRIGOLEIT G U,KAPP M,HEBART H,et al.Dendritic cell vaccination in allogeneic stem cell recipients:induction of human cytomegalovirus(HCMV)-specific cytotoxic T lymphocyte responses even in patients receiving a transplant from an HCMV-seronegative donor[J].J Infect Dis,2007,196(5):699-704.
[3]EINSELE H,ROOSNEK E,RUFER N,et al.Infusion of cytomegalovirus(CMV)-specific T cells for the treatment of CMV infection not responding to antiviral chemotherapy[J].Blood,2002,99(11):3916-3922.
[4]PEGGS K,VERFUERTH S,MACKINNON S.Induction of cytomegalovirus(CMV)-specific T-cell responses using dendritic cells pulsed with CMV antigen:a novel culture system free of live CMV virions[J].Blood,2001,97(4):994-1000.
[5]COBBOLD M,KHAN N,POURGHEYSARI B,et al.Adoptive transfer of cytomegalovirus-specific CTL to stem cell transplant patients after selection by HLA-peptide tetramers[J].J Exp Med,2005,202(3):379-386.
[6]SCHMIDT G M,HORAK D A,NILAND J C,et al.A randomized,controlled trial of prophylactic ganciclovir for cytomegalovirus pulmonary infection in recipients of allogeneic bone marrow transplants;The City of Hope-Stanford-Syntex CMV Study Group[J].N Engl J Med,1991,324(15):1005-1011.
[7]KOLB H J,SCHMID C,BARRET A J,et al.Graft-versus leukemia reactions in allogeneic chimeras[J].Blood,2004,103(3):767-776.
[8]LANGSOTON A A,REDEIL C,ALIENDO A M,et al.Development of drug-resistant herpes simplex virus infection after haploidentical hematopoietic progenitor cell transplantation[J].Blood,2002,99(9):1085-1088.
[9]YAO J,BECHTER C,WIESNETH M,et al.Multimer staining of CMVpp65 specific T cells for diagnosis and therapeutic purpose:a comparative study[J].Clin Infect Dis,2008,46(10):96-105.
[10]NEUDORGER J,SCHMIDT B,HUSTER K M,et al.Reversible HLA multimers(Streptamers)for the isolation of human cytotoxic T lymphocytes functionally active against tumorand virus-derived antigens[J].J Immunol Methods,2007,320(1-2):119-131.
[11] VOSS S,SKERRA A.Mutagenesis of a flexible loop in streptavidin leads to higher affinity for the Strep-tagⅡpeptide and improved performance in recombinant protein purification[J].Protein Eng,1997,10(8):975-982.
[12]KNABEL M,FRANZ T J,SCHIEMANN M,et al.Reversible MHC multimer staining for functional isolation of T-cell populations and effective adoptive transfer[J].Nat Med,2002,8(6):631-637.
[13]KEENAN R D,AINSWORTH J,KHAN N,et al.Purification of cytomegalo-virus-specific CD8 T cells from peripheral blood using HLA-peptide tetramers[J].Br J Haematol,2001,115(2):428-434.

