黄芪多糖对刺参肠道褐藻酸降解菌生物量及产酶活性的影响
辽宁省农业科学院大连生物技术研究所 孙永欣
大连理工大学环境与生命学院 汪婷婷 徐永平*
海参通过吞食周围环境中的泥土和动植物碎屑,在微生物的协助下完成繁重的消化吸收功能(Deming和 Colwell,1982), 进而转化成自身的蛋白质等营养成分。现已初步证实,刺参可以采食海藻,但其消化道中缺乏内源性褐藻酸酶 (唐黎,2006)。孙奕和陈玛(1989)报道,刺参肠道中的产褐藻酸酶菌占总菌数90%以上,在褐藻胶的降解中起到重要作用。本文考察黄芪多糖(APS)和不同粉碎粒径黄芪对刺参肠道中产褐藻酸酶菌数量的影响,并通过体外试验进一步研究APS对褐藻酸降解菌产酶活性的影响,为探讨APS对刺参消化道中褐藻酸降解菌的调控及其消化生理提供依据。
1 材料与方法
1.1 试验刺参 试验用刺参体重为 (49.3±5.65)g,由大连太平洋海珍品养殖公司提供。于水槽(体积为300 L)中充气暂养,每天更换1/3体积水,于傍晚投喂商品饲料,水温保持在12~15℃。经过2周适应期,进行正式养殖试验。
1.2 黄芪的预处理及试验日粮 采用3种制备工艺对黄芪进行加工,即普通粉碎后过60目(250 μm)筛绢网制备成黄芪粗粉;粗粉经振动磨(中国倍力技术工程有限公司)粉碎过300目筛绢网制备成黄芪超微粉 (直径为39~125 μm);超微粉制备过程中添加碱性化学试剂制备成黄芪化微粉(直径为39~125 μm)。将黄芪粗粉、超微粉和化微粉分别按的3.0%(m/m)剂量添加到基础饲料制备成饲料1、饲料2和饲料3。APS由西安天园生物制剂厂提供,此多糖在黄芪干燥根中的平均含量约17%(曹建军等,2006),以0.5%(m/m)剂量添加到基础饲料中制备成饲料4,基础日粮作为对照。试验中免疫增强剂添加剂量参考水产养殖无脊椎动物中常用量。基础日粮组成及营养水平见表1。
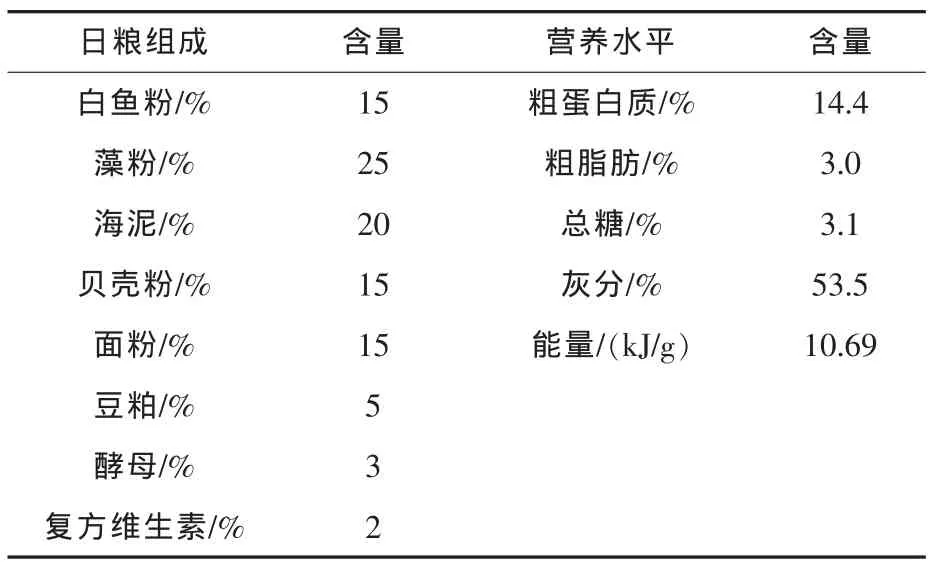
表1 基础日粮组成及营养水平
1.3 试验设计 正式试验采用循环流水式养殖系统,每个养殖单位为0.1 m3水族箱,每个水族箱中放置15只刺参,每个处理设3个重复,共使用15个水槽。养殖试验共60 d,期间循环水流量为500~800 mL/min,每天更换总体积1/3的水以保证水质。试验采用避光养殖,水温控制在16~18℃。每天投喂量为约占个体体重的3%。
1.4 肠道微生物试验
1.4.1 体内试验菌种来源 养殖试验结束后从各组刺参肠道中分离获得。
1.4.2 2216E海洋细菌培养基 蛋白胨0.5%,酵母膏0.1%,磷酸高铁0.001%,琼脂粉1.5%,溶于过0.22 μm滤膜的海水中,调pH值至7.6~7.8后灭菌,倒平板。
1.4.3 褐藻酸钠选择性培养基 褐藻酸钠0.5%,(NH4)2SO40.5%、K2HPO40.2%、MgSO4·7H2O 0.2%、NaCl 2.5%、琼脂 1.3%、FeSO4·7H2O 0.01%、调节pH 7.5为褐藻酸降解菌的筛选培养基。
1.4.4 体外试验用初筛培养基 同1.4.3。
1.4.5 体外试验用复筛培养基 液体种子培养基(庞敏等,2007):蛋白胨 0.5%,酵母提取物0.1%,褐藻酸钠0.5%,NaCl 3%,调节pH至7.5;摇瓶发酵培养基:褐藻酸钠 0.5%,(NH4)2SO40.5% ,K2HPO40.2% ,MgSO4·7H2O 0.2% ,NaCl 2.5%,调节 pH 7.5。
1.4.6 体外试验用APS APS(98%)分别按0%、0.05%、0.1%、0.2%添加到摇瓶发酵培养基中。
1.4.7 体外试验用菌种来源 从对照组刺参肠道泥样中分离获得。
1.5 数据统计分析 采用SPSS 13.0软件对数据进行独立样本t检验统计分析,P<0.05为差异显著。
1.6 方法
1.6.1 体内试验菌株的培养 每组各取3只,先用无菌水将刺参表面冲洗干净,用手术刀剖开腹腔,用镊子小心将消化道取出,挤出泥样,称取1.0 g,将其用稀释液(灭菌陈海水)稀释(10-1~10-9);同时将刺参肠道组织用灭菌陈海水冲洗干净,称取1.0 g置于匀浆器中,加入1 mL稀释液充分研磨后再加入8 mL稀释液摇匀,继续做适度稀释(10-1~10-9)。将肠道组织及泥样适当稀释倍数溶液分别取10 μL点于两种平板上,每个板上点9滴 (2216E平板点样的稀释倍数为10-7~10-9;褐藻酸钠选择性培养基点样的稀释倍数为10-1~10-3)。将点样后的平板置于25℃恒温培养24 h。采用平板计数法进行细菌定量。
1.6.2 体外试验菌株的初筛 取对照组刺参3只,解剖后取肠道组织,将中后肠部分中泥样挤出,无菌操作将采集的样品置于5 mL离心管中,用灭菌海水进行10-1稀释。将样品再按照10-2~10-5不等梯度进行稀释,取各稀释液0.1 mL涂布到初筛分离平板上。25℃恒温培养48 h,选取具有透明圈的菌落进行复筛。
1.6.3 体外试验菌株的复筛 将初筛出的菌株接入100 mL种子培养基(250 mL三角瓶)中,25℃150 r/min培养24 h,取培养至对数生长期的种子液3 mL接入200 mL含不同浓度APS的发酵培养基(500 mL三角瓶)中发酵培养。在25℃,150 r/min下培养 48 h,8000 r/min,4 ℃离心10 min,取上清用 3,5-二硝基水杨酸(DNS)法测定酶活。
1.6.4 褐藻酸酶活力测定 参照庞敏等(2007)的方法。
1.6.4.1 标准曲线的制作 精确称取100℃干燥至恒重的葡萄糖0.10 g,加蒸馏水溶解并定容至100 mL,配成1.00 mg/mL浓度的溶液,按表2在各25 mL比色管中加入溶液,沸水浴反应3 min,冷却加蒸馏水定容至25 mL后,以去离子水作为空白校正,用紫外分光光度计于520 nm下测吸光度值。

表2 葡萄糖标准曲线制作方法 mL
1.6.4.2 样品测定 将全部菌液4℃离心后取上清液进行酶活力测定。以反应液中还原糖的增加量作为检测酶活力的指标。
还原糖的测定采用DNS改良法。具体步骤:取0.5%褐藻酸钠溶液0.5 mL,加入0.1 mol/L醋酸-醋酸钠缓冲液2 mL、酶液2 mL,40℃水浴中糖化30 min,取出后立即置于沸水中水浴15 min使酶失活,得糖化液。取糖化液1 mL按标准曲线制作方法加显色剂比色。同时以1 mL煮沸的酶液代替酶做空白对照。
以无水葡萄糖做标准曲线,根据试验组和对照组的差值计算还原糖的产生量。1个酶活力单位定义为:每分钟产生1 μg还原糖所需的酶量。
2 结果与分析
2.1 褐藻酸降解菌在肠道中总异养菌中的比重从表3可见,添加不同饲料添加剂饲养的刺参肠道组织总异养菌数和褐藻酸降解酶菌数相差较大,APS组褐藻酸降解菌的相对量最大,其他4组较为接近。
2.2 产褐藻酸酶菌在肠道泥样总异养菌中的比重 从表4可见,试验各组的刺参肠道泥样中总异养菌数和褐藻酸降解菌数相差较大,从相对量比值可以看出,APS组褐藻酸降解菌相对量最大,较其他4组高出1~2个数量级。
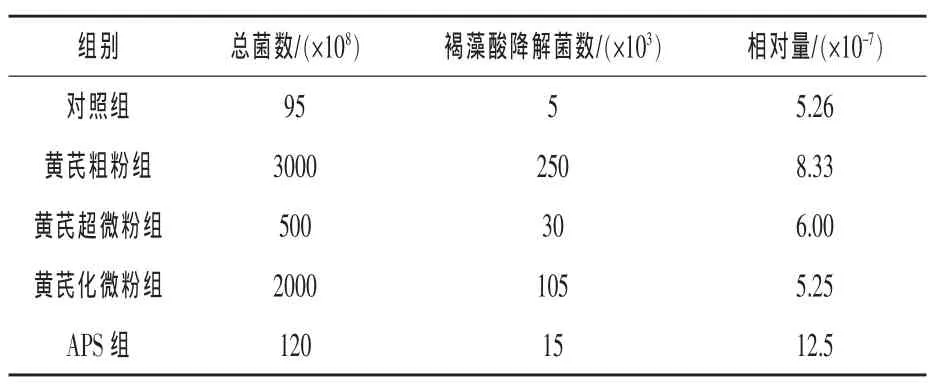
表3 各组刺参肠道中产褐藻酸酶菌的相对量
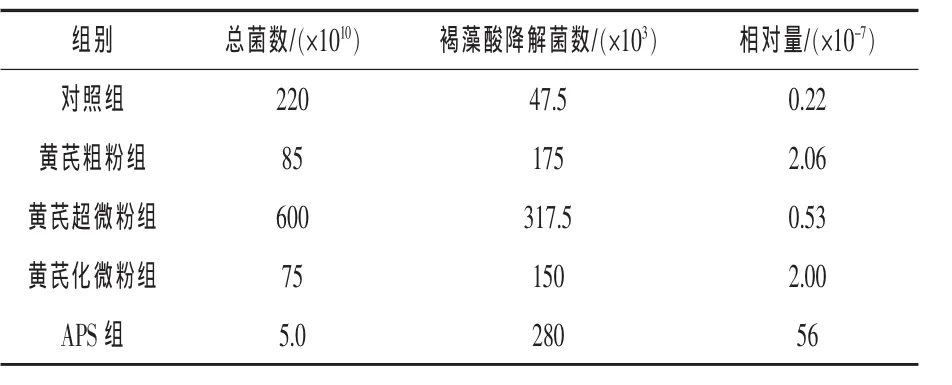
表4 各组刺参肠道泥样中产褐藻酸酶菌的相对量
2.3 体外试验中APS对产酶菌密度和酶活力的影响 见图1。无APS组中,褐藻酸酶活力较低,而添加APS后可提高产褐藻酸酶菌的产酶活力和生物量。在各试验组中,随着APS浓度的增加,相对酶活力和生物量呈先上升后下降的趋势,其中0.1%的添加组酶活力和生物量最高。

图1 不同浓度APS对产褐藻酸酶菌产酶活力和生物量的影响
3 讨论
褐藻酸酶也称为褐藻酸裂解酶,主要存在于微生物和食藻的海洋软体动物(如海螺、鲍、锉石鳖等)消化道中(刘晨光等,2000),现已从九孔鲍内脏器官中分离纯化出褐藻酸酶 (吴永沛和何碧烟,2002)。研究发现,在刺参消化道中可检测到该酶活性,但从幼体到成参褐藻酸酶活力一直处于较低水平(王吉桥等,2007)。孙奕和陈玛等(1989)研究表明,刺参肠道内具有降解褐藻胶活性的细菌占细菌总数的90%以上,这些细菌在褐藻胶的降解中起着重要作用。因此,刺参对褐藻胶消化主要依赖于肠道微生物。
从本试验中可以看出,不同组别刺参肠道中细菌数相差很大,由于刺参消化道中微生物主要来源于吞食的食物中,因此消化道中的微生物组成和生物量也很不稳定。孙奕和陈玛(1989)研究表明,刺参在饥饿状态下其肠道中细菌属数目比正常摄食状态下减少50%以上。尽管各组中总异养菌和产褐藻酸酶菌生物量差别较大,APS组中产褐藻酸酶菌比例最高。从刺参肠道泥样中发现,总异养菌数高于肠道中菌数,至少表明刺参肠道能富集来源于食物中的细菌。孙奕和陈玛(1989)、张红梅等(2003)研究表明,海泥中极少见到的柄杆菌属在饥饿刺参后肠中存在比例较高,这些肠道定植菌在刺参营养吸收、排斥其他菌群的繁殖等方面可能具有一定作用。刺参肠道中的泥样属于未完全消化的食物,其中不仅含有大量外来的细菌,还含有肠道中定植下来的细菌,因此数量高于肠道菌数。APS组中褐藻酸降解菌数比例明显高于其他各组,这与肠道中的情况相一致。此外,本试验中褐藻酸降解菌在总异养菌中所占的比例远低于90%,这与刺参所处的生活环境有直接关系。由于天然状态下,底泥中营养物质非常丰富导致细菌种类和数量繁多,底泥中的常见菌——弧菌属和假单胞菌属都具有很强的褐藻酸降解活性,被刺参摄入后在消化道中定植下来(孙奕和陈玛,1989),而这些菌在经过砂滤罐多次过滤后数量大大减少,刺参在无法摄入足够的细菌的情况下,其体内褐藻酸降解菌自然不足。此外,褐藻酸降解菌可在海藻藻体上大量富集(庞敏等,2007),天然条件下,刺参摄食海藻会带入大量的褐藻酸降解菌,但在试验条件下,人工饲料中该菌的含量会大为下降,这也是刺参体内褐藻酸降解菌比例很低的原因。
为了进一步阐明APS对褐藻酸降解菌的作用机制,本研究中采用了体外试验考察APS对褐藻酸降解菌生物量和产酶活性的影响。研究发现,培养基中添加APS后,褐藻酸降解菌生物量随着APS浓度增加先上升后下降,产酶活力也伴随着生物量而先上升后下降,因此APS可以作为褐藻酸降解菌的益生素,通过促进褐藻酸降解菌的生长、繁殖进而提高产酶活力。这也是多糖类物质通过调节肠道中微生物区系发挥免疫增强作用的主要原因(Helena等,2004)。在本试验中,褐藻酸降解菌生物量先升高后降低分析可能是生物量达到一定程度后,由于营养物质和空间所限,导致细菌生长的竞争性抑制,因此生物量下降。在本试验中,0.1%添加剂量最佳。
4 小结
本试验结果表明,饲料中添加APS能有效促进刺参肠道中褐藻酸降解菌生长,且0.1%添加量效果最佳,因此在人工养殖中可以通过饲料中添加APS改善肠道菌群从而提高其消化利用率。
[1]曹建军,王长如,梁宗锁,等.不同黄芪品种根中多糖的动态积累及多糖含量比较研究[J].西北植物学报,2006,26(6):1263 ~ 1266.
[2]刘晨光,刘成圣,刘万顺,等.海洋生物酶的研究和应用[J].海洋科学,2000,24(7):24 ~ 26.
[3]庞敏,王常红,韩宝芹,等.褐藻酸降解菌的筛选及产酶条件优化[J].中国海洋药物杂志,2007,26(3):34 ~ 40.
[4]孙奕,陈玛.刺参体内外微生物组成及其生理特征的研究[J].海洋与湖沼,1989,20(4):300 ~ 307.
[5]唐黎.刺参不同季节和发育时期酶活力与消化道形态结构的研究:[硕士学位论文][D].大连:大连水产学院,2006.
[6]王吉桥,唐黎,许重,等.仿刺参消化道的组织学及其4种消化酶活力的周年变化[J].水产科学,2007,26(9):481 ~ 484.
[7]吴永沛,何碧烟.九孔鲍褐藻酸酶、琼脂酶及纤维素酶的提取纯化[J].海洋科学,2002,26(3):4 ~ 7.
[8]张红梅,张磊,姜会民.甘露寡糖对生长期鲤鱼生长性能及肠道菌群的影响[J].中国饲料,2003,9:22 ~ 23.
[9]Deming J W,Colwell R R.Barophilic bacteria associated with digestive tracts of abyssal holothurians[J].Appl Environ Microbial,1982,44:1222 ~ l230.
[10]Helena T H,Renata Š,Tomáš H,et al.Commensal bacteria(normal microflora),mucosal immunity and chronic inflammatory and autoimmune diseases[J].Immunology Letters,2004,93:97 ~ 108.

