外科手术后全身性炎性反应综合征和严重脓毒症患者血浆血管加压素浓度及其相关因素分析
赵贤元 皋源 杭燕南 周嘉敏 陶中华 王鲁
(1.上海交通大学医学院附属仁济医院(东部)外科监护病房,上海 200127;2.复旦大学附属中山医院,上海 200032)
血管加压素(vasopressin,AVP)是一种由下丘脑室上核和室旁核的大细胞神经元合成的九肽激素,释放入血循环后主要发挥抗利尿以及升压作用。在脓毒症动物模型中血浆AVP浓度有不同程度的改变[1-2]。本研究测定了外科手术后全身性炎性反应综合征(SIRS)、严重脓毒症患者的血浆AVP浓度,并分析其与临床情况的相关性,为AVP的临床应用提供理论根据。
1 资料与方法
1.1 研究对象
1.1.1 入选标准 选取2009年3月—2010年3月入上海交通大学附属仁济医院外科监护病房(SICU)的手术后患者30例,按收入SICU 24 h内的临床过程分为对照组、SIRS组和脓毒症组,每组10例。对照组为手术前及入SICU后24 h内无SIRS的患者,SIRS组以及严重脓毒症组患者的诊断标准符合2001年美国胸病医师学会和美国危重病医学会(ACCP/SCCM)定义[3]。
1.1.2 排除标准 有已知的中枢神经系统疾病;AVP系统疾病;在研究期期间或是研究之前有过用AVP治疗病史;年龄<19岁或怀孕的患者。
1.1.3 治疗标准 所有治疗均符合《严重脓毒症和感染性休克治疗指南》[4]的治疗标准。辅助通气参数选择维持患者小潮气量(6~7 mL◦kg-1)通气,有创呼吸机辅助通气患者的镇静镇痛选用持续输注咪达唑仑(复合剂量2~3 mg,0.05 mg◦kg-1◦h-1维持)或是间断给予吗啡(5 mg◦次-1皮下注射,极量15~40 mg◦d-1)与枸橼酸芬太尼(0.05 mg◦次-1静脉缓慢推注)。合并肾损伤患者根据指针选用连续性静脉-静脉血液滤过(CVVHF)治疗。
1.2 方法
1.2.1 收集入选患者的一般资料 记录其人口统计学资料(年龄、性别、体质量等)、病史、慢性疾病以及治疗病史、手术史、血流动力学指标、血生物化学检查数据、感染源。对于入SICU时间>24 h的患者,根据其24 h内最差的实验室指标以及临床参数进行APACHEII评分[5-6]。
1.2.2 血样的采集 取入SICU 24 h内对照组、SIRS组、脓毒症组患者血浆5 mL待测,测定动脉血气指标。
1.2.3 临床资料收集 留取血样的同时测定并记录血流动力学参数、中心静脉压、患者生命体征。记录SICU治疗干预过程:用血管活性类药物的类别以及剂量,每日用镇静、镇痛剂的类别以及剂量,抗生素的类别,甾类药物应用与否以及其类别和剂量,辅助通气应用与否及其类别。并记录SICU入住时间及其转归。
1.2.4 动脉血气分析及血浆AVP浓度测定 取患者桡动脉血3 mL(肝素30μL抗凝)测定动脉血气指标。再次留取患者桡动脉血液10 mL,加入含0.3 mol◦L-1EDTA-Na溶液(200μL)采集管中,轻缓混匀迅速以3000 r◦min-1离心10 min,取上清液血浆低温保存(-70℃),待测。采用双抗体夹心酶联免疫吸附法(ELISA法)测定AVP浓度。
1.3 统计学分析 用SPSS13.0统计软件包进行数据处理,计量资料用表示。正态分布的连续变量用Kolmogorov-Smirnov检验。人口统计学及临床资料变量组间比较进行t检验或卡方检验及Fisher′s精确检验,多组均数间的比较采用单因素方差分析或Wilcoxon秩和检验。各组的血流动力学参数、测定的临床信息参数与AVP浓度的相关性检测使用Pearson相关分析。P<0.05为差异有统计学意义。
2 结 果
2.1 一般资料情况 3组患者的年龄、性别比较均无显著差异。脓毒症组患者APACHEII评分显著高于对照组患者及SIRS组患者。严重脓毒症组患者的呼吸机使用率高于对照组和SIRS组,且更多使用有创辅助通气。血管升压类药物的应用次数与剂量,严重脓毒症组高于对照组与SIRS组。严重脓毒症组的住院天数以及临床病死率也均高于对照组与SIRS组(表1)。该组患者亦均有明确的感染灶,肺部及腹部感染各6例,血培养阳性2例,3例存在多重感染。
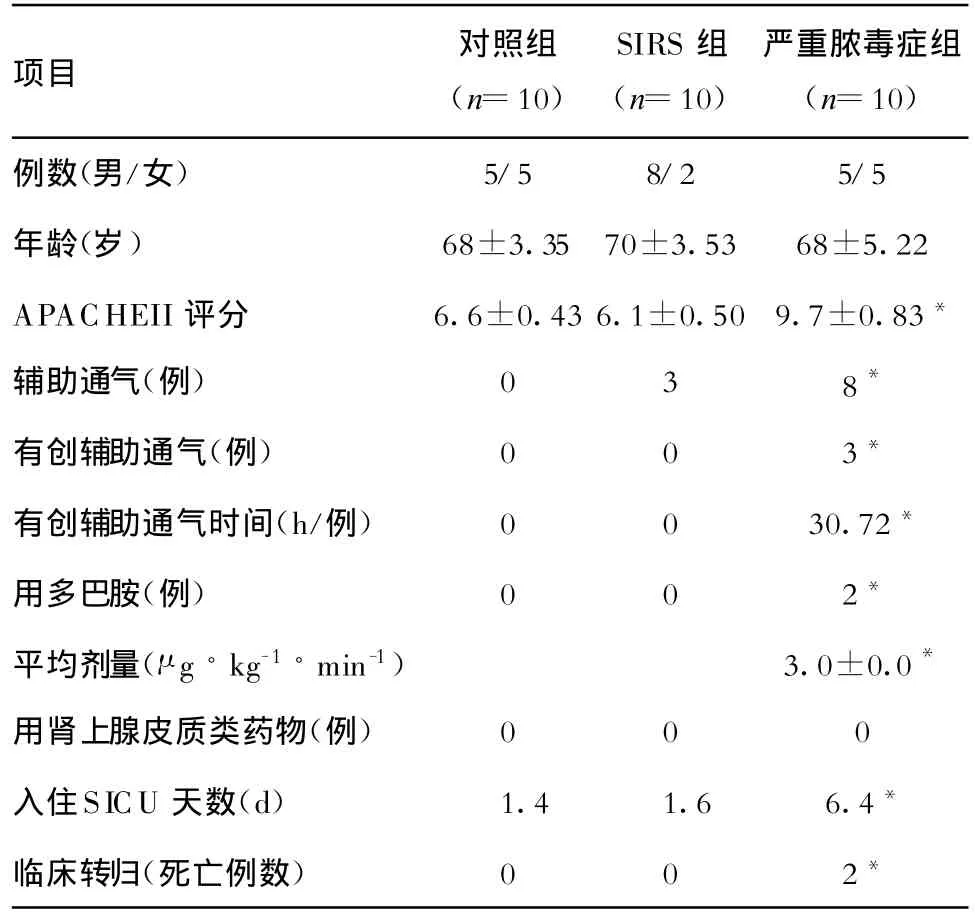
表1 3组患者的临床特征和转归情况比较
2.2 血浆AVP浓度比较 严重脓毒症组患者血浆AVP浓度(1300.6±87.5 pg◦mL-1)显著高于对照组(266.33±12.03 pg◦mL-1)和 SIRS组397.6±18.3 pg◦mL,但差异无统计学意义。
2.3 血流动力学参数、血电解质、动脉血气指标的变化及与血浆AVP浓度的关系 对照组、SIRS组及严重脓毒症组患者血流动力学参数、血电解质及动脉血气指标的变化见表2。血浆AVP浓度与对照组患者血Na+值、Ca2+值呈正相关(r=0.742,P=0.014;r=0.821,P=0.004),而仅与SIRS组患者血Na+值呈正相关(r=0.727,P=0.017),与严重脓毒症组患者血Na+值、Ca2+值则无相关(r=0.409,P=0.241)。血浆AVP浓度与严重脓毒症组患者平均动脉压(mean arterial pressure,MAP)呈正相关(r=0.544,P=0.015),与心率(HR)呈负相关(r=-0.706,P=0.023),而与对照组及SIRS组患者的MAP及H R均无相关(r=0.363,P=0.302;r=0.454,P=0.188),(表 3)。
表2 研究期间对照组、SIRS组、严重脓毒症组患者临床参数比较()
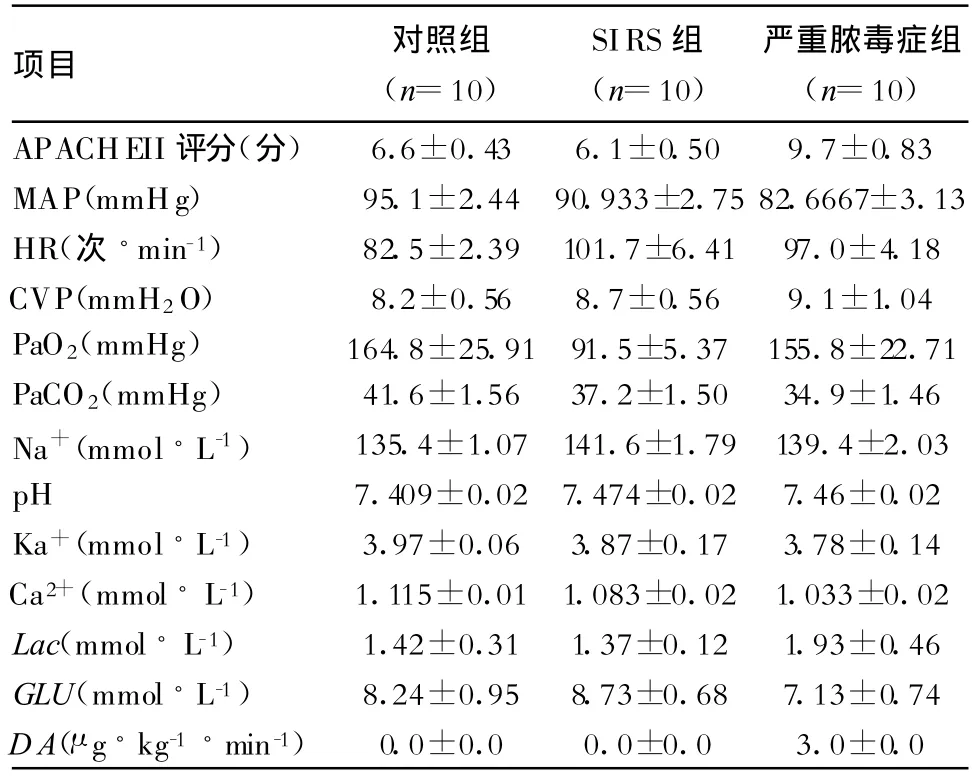
表2 研究期间对照组、SIRS组、严重脓毒症组患者临床参数比较()
注:MAP(平均动脉压)=(收缩压)/3+2×(舒张压)/3;HR,心率;CVP,中心静脉压;Lac,血清乳酸值;DA,多巴胺

表3 对照组、SIRS组和严重脓毒症组患者血浆AVP浓度(pg◦mL-1)与临床参数之间的相关性
3 讨 论
在本研究中测定了外科手术后无感染征象对照组、SIRS组、严重脓毒症组各 10例患者的血浆AVP浓度,发现严重脓毒症组患者血浆AVP浓度显著高于另外两组。
已有研究[2,7]提出尽管感染本身并不针对性地触发血浆AVP的释放,但感染引起的炎性介质以及内毒素本身能介导血浆AVP释放。既往动物实验结果也显示白细胞介素1或是肿瘤坏死因子α都能刺激AVP的释放[7-8]。另外,AVP的释放还受到酸中毒、疼痛、缺氧或神经内分泌等因素的影响[9],这些因素对于严重脓毒症患者的作用常明显高于无感染征象及SIRS患者。在感染内毒素以及炎性介质的刺激下,严重脓毒症患者血浆AVP浓度显著升高。
除上述各因素外,血乳酸、pH、PaO2水平的改变亦均与血浆AVP浓度升高相关[9],但血浆AVP浓度主要还是受到血浆渗透压与血压的调节[10]。本研究对生理学变量与血浆AVP浓度的相关分析结果提示,在严重脓毒症患者中AVP调节系统功能有别于无感染征象的术后患者与术后SIRS患者。在无感染征象的术后患者与术后SIRS患者中,其血Na+的改变与AVP浓度的改变呈正相关。然而在严重脓毒症患者中并未发现其与血Na+的相关性,相反,在该组患者中AVP浓度与平均动脉压相关,该结果提示在严重脓毒症时,维持动脉压是血浆AVP释放的强刺激因素,在低血压的刺激下AVP增加发挥效应。这也解释了Mutlu等[10]研究结果:在生理状态下,AVP主要发挥抗利尿作用,其分泌主要受血浆渗透压的影响(由血Na+反映)。低血压时,位于主动脉弓和颈动脉窦处的压力感受器兴奋,以及位于心房和肺静脉系统的容量感受器的兴奋,促使AVP的释放。此时AVP主要发挥升压的作用,几乎无抗利尿的作用。理论上,内毒素可刺激AVP的释放[2],在许多脓毒症的动物模型中,往往内毒素导致严重的低血压,这两方面的因素导致AVP大量的释放,使得循环中 AVP浓度升高[7-8]。但我们并不能区分是内毒素还是低血压直接影响AVP的释放,这需要更多的动物及临床实验证明。
有研究[11-12]显示AVP可以通过阻滞血管平滑肌的KATP通道激活,使Ca2+内流而发挥作用,缓解Ca2+消耗,提高了血循环内游离Ca2+的浓度,恢复血管平滑肌的正常收缩功能。而本研究结果则显示在对照组中AVP浓度仍与Ca2+呈正相关,但在经历SIRS与严重脓毒症的病理生理变化后,这一相关性因受影响而并未体现。
本研究还发现在严重脓毒症时,血浆AVP浓度与心率的变化呈负相关,提示血浆AVP在维持血压同时,并不引起心率的增快。有研究[13-14]表明AVP能选择性地舒张冠状动脉增加其灌注压;提高心肌细胞内Ca2+水平,直接引起正性肌力效应;同时减弱感染性休克时内毒素所致的NO的产生,逆转了该心肌抑制因素的负性肌力作用。通过以上3点能改善患者的心功能。甚至有报道[13,15]AVP能使快速性心率失常转复为窦性心律。但 Klinzing等[14-15]报道在感染性休克时,应用大剂量的AVP(0.06~1.8 U◦min-1)替代去甲肾上腺素引起心率减慢、心输出量(cardiac output,CO)减少以及心排血指数(cardiac index,CI)降低。故AVP对于心功能的具体影响,还需进一步的研究证实。
总之,本研究结果表明外科手术后严重脓毒症患者的AVP反馈功能有别于SIRS以及无感染征象的患者,其AVP浓度显著升高以维持动脉压,SIRS以及无感染征象患者的血浆AVP浓度变化与血Na+变化相关,而严重脓毒症患者的AVP浓度变化则与MAP以及HR相关,提示血流动力学的不稳定刺激了血浆AVP的分泌而发挥升压作用。
1 Parrillo JE.Pathogenetic mechanisms of septic shock[J].N Engl J Med,1993,328(20):1471-1477.
2 Wilson MF,Brackett DJ,T ompkins P,et al.Elevated plasma vasopressin concentrations during endotoxin and E.Coli shock[J].Adv Shock Res,1981,6:15-26.
3 American College of Chest Physicians/Society of Critical Care M edicine Consensus Conference.Definitions for sepsis and organ failure and guidelines for the use of innovative therapies in sepsis[J].Crit Care Med,1992,20(6):864-874,1250-1256.
4 Delinger RP,Carlet JM,Masur H,et al.Surviving sepsis campaign guidelines for management of severe sepsis and septic shock[J].Crit Care Med,2004,32(3):858-873.
5 Keats AS.The ASA classification of phy sical status--A recapitulation[J].Anesthesiology,1978,49(4):233-236.
6 Knaus WA,Wager DP,Draper EA,et al.The APACHEⅢprognostic system risk prediction of hospital mortality fo r critically ill hospitalized adults[J].Chest,1991,100(6):1619-1636.
7 Landmann R,Zimmerli W,Sansano S,et al.Increased circulating soluble CD14 is associated with high motality in gram negative septic shock[J].JInfect Dis,1995,171(3):639-644.
8 Raber J,Bloom FE.IL-2 induces vasopressin release from the hypothalamus and the amygdale:Role of nitric oxide-mediated signalling[J].J Neurosci,1994,14(10):6187-6195.
9 Landgraf R,Neumann I,Holsboer F,et al.Interleukin-1 beta stimulates both central and peripheral release of vasopressin and oxy tocin in the rat[J].Eur J Neurosci,1995,7(4):592-598.
10 Mutlu GM,Factor P.Role of vasopressin in the management of septic shock[J].Intensive Care Med,2004,30(7):1276-1291.
11 Holmes CL,Granton JT,Landry DW.Science review:vasopressin and the cardiovascular system part 2-clinical physiology[J].Critical Care,2004,8(1):15-23.
12 Landry DW,Oliver JA.The ATP-sensitive K+channel mediates hy potension in endotoxemia and hy poxic lactic acidosis in dog[J].J Clin Invest,1992,89(6):2071-2074.
13 Dünser MW,May r AJ,Ulmer H,et al.Arginine vasopressin in advanced vasodilatory shock:A prospective,randomized,controlled study[J].Circulation,2003,107(18):2313-2319.
14 Klinzig S,Simon M,Reinhart K,et al.High dose vasopressin is not superior to norepinephrine in septic shock[J].Crit Care M ed,2003,31(11):2646-2650.
15 Brackett DJ,Schaefer CF,T ompkins P,et al.Evaluation of cardiac output,total peripheral vascular resistance,and plasma concentrations of vasopressin in the conscious,unrestrained rat during endotoxemia[J].Circ Shock,1985,17(4):273-284.

