细菌磁小体的修饰及其在病原物检测中的应用
李爱华,唐 涛,张惠媛,汪 琦,田杰生,李 颖
1.中国农业大学生物学院,农业生物技术国家重点实验室,北京100193;
2.北京出入境检验检疫局食品安全检测中心,北京100026
细菌磁小体的修饰及其在病原物检测中的应用
李爱华1,唐 涛1,张惠媛2,汪 琦2,田杰生1,李 颖1
1.中国农业大学生物学院,农业生物技术国家重点实验室,北京100193;
2.北京出入境检验检疫局食品安全检测中心,北京100026
趋磁细菌可以在细胞内合成Fe3O4或F3S4颗粒,称为磁小体。磁小体粒径为纳米级,晶形稳定,有质膜包被,在免疫检测、临床诊断、靶向治疗、污水处理等方面均有很好的应用前景。文章主要介绍采用化学法和生物法对磁小体进行修饰,并利用修饰后的磁小体对病原物进行免疫磁性分离、前期诊断和痕量检测的方法。
磁小体;磁小体-抗体复合物;免疫磁性分离;免疫检测
0 引 言
趋磁细菌的发现引起了人们对生物趋磁现象的关注[1,2],目前已从自然界中分离到了多种趋磁细菌。这类细菌在细胞内合成Fe3O4或F3S4纳米磁性颗粒,被称为磁小体(magnetosome)[3]。趋磁细菌因有磁小体而能够感知地磁场,以确定其所在的方位。磁小体的合成是在胞内的一种泡囊中完成的,并受到严格的生物调控,其晶型稳定、颗粒均一。目前,磁小体已经成为生物学、磁学、化学、地质学、物理学等各领域的研究热点之一。其中,尤以磁小体在病原物的免疫磁性分离、检测、早期诊断等方面的应用研究最多。
1 磁小体的特征
磁小体在趋磁细菌体内呈链状排列 (图1A),具有磁导向作用。其主要成分是Fe3O4或Fe3S4[6~8]。它们大小均一,晶型稳定[9],直径约35~120 nm[10],该尺寸范围决定了磁小体具有单磁畴、顺磁性的特点[11]。磁小体的另一个显著的特点是其外部包被着双层质膜[12],图1B为纯净磁小体扫描电镜照片,可见每个颗粒具有完整的外膜。电镜观察发现,不同的趋磁细菌合成的磁小体形态各异,有八面体、六面体、棱片状、子弹头等多种形态[4,5](图1C)。磁小体外膜的主要成分与细胞质膜类似,是磷脂酰乙醇胺[13],膜上存在着大量的氨基和羟基[14,15]。人们利用这些基团,在磁小体上偶联蛋白、寡肽、药物、酶及荧光染料,构建了多种复合物,并进一步探索了这些复合物在病原物检测、基因转染、细胞分离、核酸提取、靶向治疗及磁共振成像等多方面的应用[16~21]。
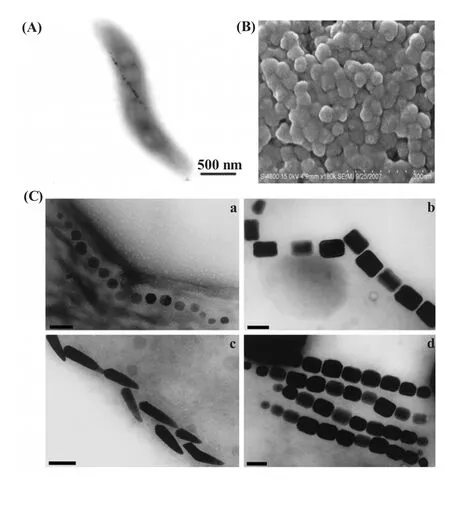
图1 (A)趋磁细菌MSR-1中的磁小体;(B)MSR-1的磁小体扫描电镜照片,其外有完整的膜包被;(C)多种磁小体的晶型及胞外结构,其晶体形态包括立方八面体(a)、长棱柱体(b,d)、子弹头状(c),磁小体在体内呈单链(a,b,c)或者多链排列(d)(标尺为100 nm)(图1C引自参考文献[5])Fig.1 (A)Magnetosome in a magnetotactic bacterium Magnetospirillum gryphiswaldense MSR-1;(B)Scanning electron micrograph of magnetosome from M.gryphiswaldense MSR-1 by SEM;(C)Electron micrographs of crystal morphologies and intra-cellular organization of magnetosomes found in various magnetotactic bacteria,shapes of magnetic crystals include cubo-octahedral(a),elongated hexagonal prismatic(b,d)and bullet-shaped morphologies(c),the particles are arranged in one(a,b,c)or multiple chains(d).(Bar equivalent to 100 nm)[5]
2 磁小体的修饰
1976年,挪威学者John Ugelstad首次研制了磁性微球。上世纪80年代初,他提出了免疫磁性分离 (immunomagnetic separation,IMS)的概念,其基本原理是将抗体偶连在磁性微球上,利用抗体特异性地捕获目标物,并通过磁性吸附将其从样品中分离出来,从而进行收集或检测。此后,这项技术在临床诊断、病原物或毒素检测、环境治理等各领域迅速推广,并实现了商业化。磁小体是一种生物来源的磁性纳米微球,其表面包被着磷脂双分子层,含有多种活性基团,易于与其它分子连接,可以作为多种功能分子的载体。
2.1 化学法修饰
1991年,Nakamura等[17]根据羟醛反应的原理,利用戊二醛将异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记的抗体与磁小体偶联,用以检测血清中免疫球蛋白G(immunoglobulin G,IgG)的含量。这是首次将磁小体用于免疫荧光检测中。1993年,Nakamura等[18]将Succinimidyl 3-(2-pyridyldithio)propionate(SPDP)分别与磁小体膜上的氨基及抗体的巯基共价偶联,形成了磁小体抗体复合物,每毫克磁小体可以偶联54~150 μg抗体。然而,上述偶联过程中需要先还原抗体中的二硫键,改变抗体的构型,这可能会影响抗原-抗体反应效果,因此磁小体抗体的偶联方法需要进一步改进。Bis(Sulfosuccinimidyl)Suberate(BS3)是具有两个N-乙酰琥珀酸亚胺脂的偶联剂[23],可分别共价结合磁小体膜上的氨基及抗体的氨基。该反应步骤简便,但反应时易发生磁小体之间的交联,影响磁小体和抗体的偶联效率。实验过程中,需摸索磁小体、抗体的最佳反应浓度及其比例,并进行严格控制。链霉亲和素 (streptavidin,SA)是阿维丁链霉菌 (Streptomyces avidinii)分泌的一种蛋白质,每个链霉亲和素分子可以结合4个生物素分子 (biotin),二者的亲和力高,结合常数达1015M-1。将磁小体和抗体分别用生物素修饰,然后利用链霉亲和素连接两者,形成复合物,可以实现磁小体和抗体的高效结合[24]。我实验室分别尝试了利用SPDP、BS3、生物素-亲和素偶联抗体和磁小体,发现每毫克磁小体在适宜条件下都可与200 μg以上的抗体结合,其中用SPDP偶联效率最高,每毫克磁小体可偶联300 μg抗体。在实际工作中,偶联剂的选择,往往需要根据抗体的性质和检测方法来确定。
2.2 生物法修饰
Protein A是一种从金黄色葡萄球菌 (Staphylococcus aureus)中分离出的胞壁蛋白,可与多数哺乳动物免疫球蛋白IgG的Fc段结合。1999年,Matsunaga[25]通过基因工程手段将Protein A与趋磁螺菌 (M.magneticum)AMB-1的磁小体膜蛋白MagA(47 kDa)融合表达,使其锚定在磁小体膜上,再利用Protein A与抗体结合构建成磁小体抗体复合物,用以检测人IgG。但MagA与磁小体膜结合不牢固,在一定程度上影响了复合物的稳定性。Mms16是磁小体膜上含量最高的蛋白,Yoshino等[26]通过G蛋白偶联受体 (G-protein coupled receptor,GPCR)与Mms16融合表达,将其装配在磁小体膜上,从而简化了GPCR的纯化过程,并能够获得保持原有构型和活性的GPCR。Mms13是磁小体膜上结合最为牢固的小分子蛋白[27],Tomoko等利用Mms13将荧光素酶锚定在磁小体膜上并在菌体内表达,所得荧光强度比利用Mms16、MagA锚定的荧光素酶的荧光强度高400~1000倍。将Mms13与Protein A融合表达,可用于检测IgG,其检测限达10 ng/mL[27~29]。图2描述了构建Protein A与Mms13的融合基因,并使其在趋磁螺菌AMB-1中表达,获取功能性磁小体的过程。比较发现,磁小体通过融合表达Protein A偶联抗体的效率比化学试剂偶联的效率高2 倍[30]。
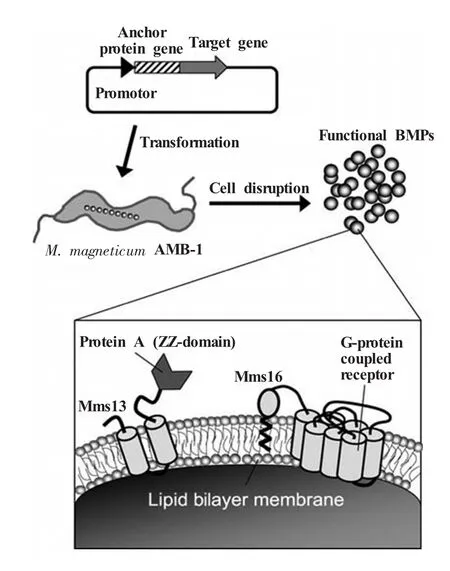
图2 利用融合表达构建功能磁小体[30]通过与磁小体膜上锚定蛋白融合表达,实现功能蛋白在磁小体膜上的表达。含有融合基因的质粒转化至趋磁细菌AMB-1中。功能蛋白的表达效率取决于锚定蛋白的表达水平。细胞破碎后即可提取功能磁小体Fig.2 Schematic diagram for the preparation of functional bacterial magnetic particles(BacMP)using the protein display technique[30]To express a functional protein onto BacMPs,the functional protein gene was fused to an anchor protein gene.A plasmid containing the fusion gene was transformed into M.magneticum AMB-1.Expression efficiency is strongly dependent on the expression level of the anchor protein. The functionalBacMPs produced were extracted by disrupting cells
3 目标物的检测
在应用磁小体抗体复合物的免疫检测中,被检测物既有完整的细胞,如单核细胞、大肠杆菌等[18,28,31],也有可溶性分子,如过敏原[16]、环境污染物、激素[32,33]、外源雌激素、胰岛素[30]及各种蛋白抗原等[34]。采用的检测方法主要包括两种:其一是先用磁小体抗体复合物对痕量目标物进行免疫磁性捕获,然后结合适当的检测方法,实现对目标物的检测;其二是将磁小体抗体复合物与抗原结合,使抗原具有磁性,通过检测磁性的强度,确定抗原的含量或浓度。其中前者使用较多。
3.1 免疫荧光检测
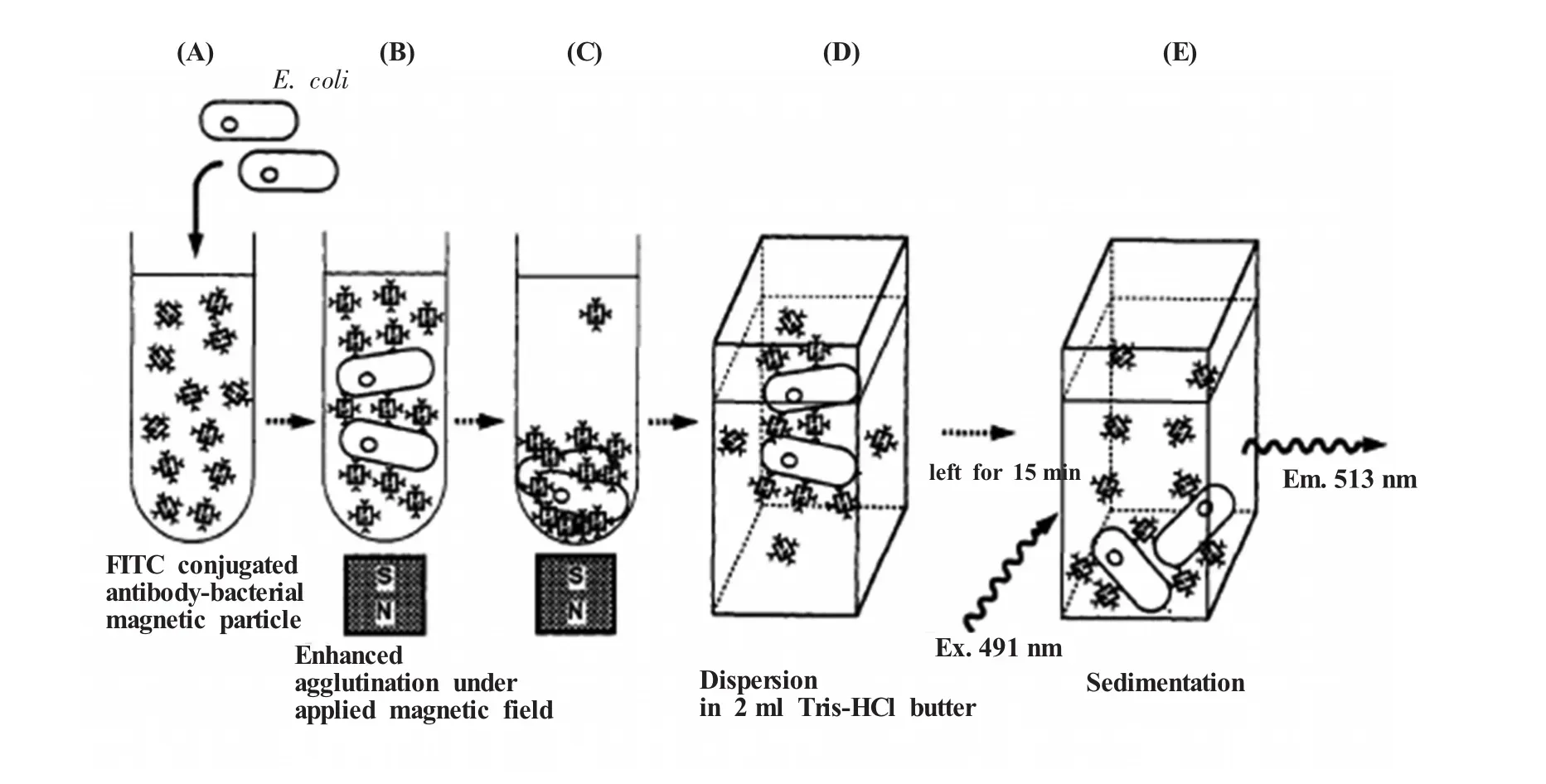
图3 FITC-抗体-磁小体复合物检测细菌示意图[18](A)FITC-anti-E.coli antibody-BMP与大肠杆菌混合。(B)磁小体在抗体与大肠杆菌的相互作用下结合在菌体表面,菌体被磁小体覆盖,并在外源磁场的作用下产生凝集现象。外源磁场有利于颗粒的聚集从而增强凝集现象的产生。(C)每个菌体表面结合多个磁小体抗体复合物,并发生沉淀现象。(D)样品重悬以释放没有和菌体结合的磁小体抗体复合物。(E)样品静置15 min,细胞-磁小体复合物沉淀,检测未结合的FITC-磁小体的荧光强度,荧光强度降低的程度与菌体的初始浓度有关Fig.3 Schematic diagram showing the principle of bacterial detecting using FITC-antibody-magnetosome[18](A)FITC-anti-E.coli antibody-BMP conjugates are mixed with E.coli cells.(B)BMPs bind to the E.coli cells via the FITC-labeled antibody and the cells are covered with magnetite. The magnetite-labeled cells form aggregates in the presence of an inhomogeneous magnetic field.(C)Many particles to bind to a single E.coli cell and the cell magnetite complexes sediment.(D)In order to release unbound BMPs which cosedimented with the cell/magnetite complexes,the sample was redispersed during the transfer to a cuvette.(E)After 15 min,the cell/magnetite complexes sediment and the residual fluorescence of FITC bound to free magnetic particles is determined.The extent of the decrease in fluorescence compared to the initial value allows determination of the bacterial concentration
Nakamura等[18]首次采用磁小体-抗体复合物结合免疫荧光技术检测致病菌。如图3所示,他们将异硫氰酸荧光素 (fluorescein isothiocyanate,FITC)标记的大肠杆菌 (Escherichiacoli)单抗固定在磁小体上,然后加入待测大肠杆菌悬液。大肠杆菌与磁小体上的抗体发生凝集反应而聚集在试管底部,磁铁吸附促进凝集反应,然后重悬反应体系,再静置。待发生凝集反应的菌体和磁小体抗体复合物沉淀后,检测体系的荧光强度。样品中菌体浓度越高,与菌体发生凝集反应的FITC-抗体-磁小体复合物越多,悬液中剩余的复合物便越少,悬液中的荧光强度随之逐渐减弱。实验结果显示,其检测范围为102~106cfu/mL。
陈继峰等[20]利用上述方法检测葡萄扇叶病毒 (GFLV)和李坏死斑病毒 (PNRSV),均获得理想结果,在感病组织被稀释106倍后仍能检测到这两种病毒。
该检测方法建立在磁小体-FITC-抗体复合物与大肠杆菌产生凝集反应的基础上。通过检测未与菌体结合的磁小体-FITC-抗体的荧光强度得出样品中菌体的浓度 (两者呈反比关系)。由于免疫荧光检测是一种灵敏度较高的检测方法,因此该方法能够检测较低浓度的菌体。但是,在实验中,FITC-抗体共价偶联在磁小体上,静置过程中有可能随磁小体的沉淀而沉淀,从而降低了悬液的荧光强度,造成表观检测灵敏度高于实际灵敏度,产生假阳性。
3.2 免疫化学发光检测
2004年,Tanaka等[33]将磁小体抗体复合物与免疫化学发光法结合,检测环境水中的17 β-雌二醇 (estradiol,E2)。他们将E2的抗体 (anti-E2)与磁小体偶联,并将所得磁小体抗体复合物和碱性磷酸酶标记的E2(ALP-E2)同时与水样反应。该体系的化学发光强度随样品中E2浓度的增加而逐渐减弱。在一定浓度范围内,体系光强度与样品E2浓度成线性反比关系。该方法最低检测限为20 ppt。
郭兰英等[19]利用磁小体抗体复合物结合双抗体夹心免疫化学发光的方法,对乙肝表面抗原进行检测,其最低检测限为0.1 ng/mL。随后,将该方法与市售ELISA试剂盒进行比较,同时检测50个临床样品和50个随机样品。结果发现,这两种方法对临床样品的检测结果完全吻合;而检测随机样品时,磁小体-抗体法检出的阳性样品比ELISA试剂盒检出的阳性样品多2个。经1个月的追踪观察发现,这两个样品确为阳性,说明磁小体-抗体法灵敏度更高。
将磁小体抗体复合物的富集作用与化学发光检测法相结合,能够实现提高检测灵敏度的目的。但值得注意的是,磁小体本身具有类似过氧化物酶的活性,该活性可能会在实验中对检测结果造成干扰。因此,应该尽量避免使用辣根过氧化物酶标记的抗体进行化学发光检测。
3.3 免疫磁性-PCR
2007年,Wacker等[34]将磁小体抗体复合物捕获目标物、双抗体夹心免疫检测和real-time PCR三者结合起来,建立了magneto immuno-PCR的方法,用于检测乙肝表面抗原HBsAg。如图4所示,首先构建磁小体抗体复合物,同时将核酸-抗体复合物与样品中的HBsAg结合;然后,利用磁小体抗体复合物捕获样品中结合了核酸-抗体的HBsAg,形成夹心复合物;最后通过real-time PCR针对核酸探针进行扩增,检测样品中的HBsAg。该方法的最低检测限为320 pg/mL,灵敏度高出magneto-ELISA 100倍。
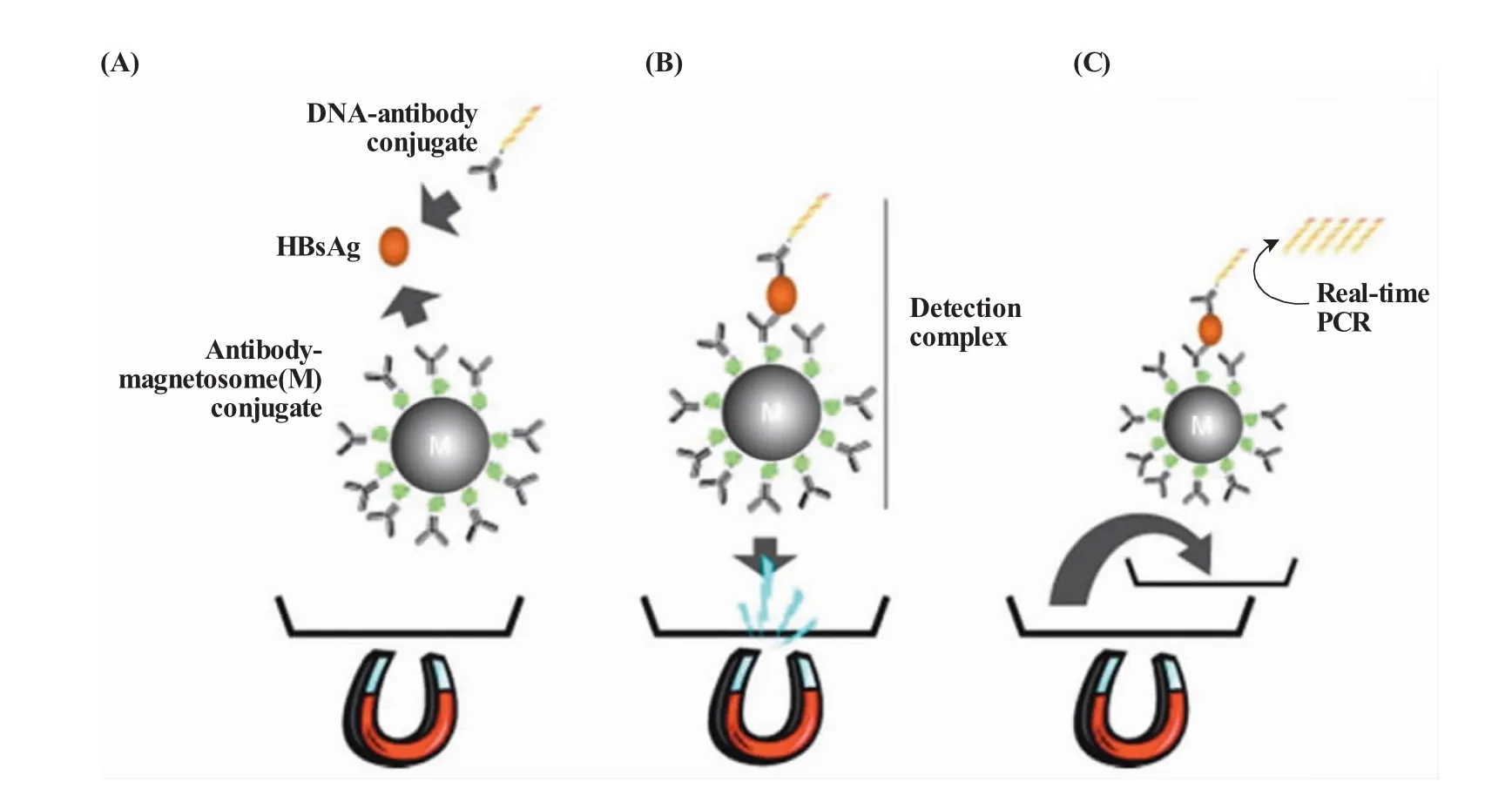
图4 磁性免疫PCR(M-IPCR)[34](A)构建可以特异性结合乙肝表面抗原的磁小体抗体复合物,同时利用DNA-抗体复合物结合样品中的乙肝表面抗原;(B)磁小体抗体复合物捕获结合有DNA-抗体的乙肝表面抗原,并在外加磁场的作用下富集,去除上清;(C)复合物重悬后,取一定体积的悬液置于微孔板中,微孔中含real-time PCR反应体系,可以检测捕获到的抗原Fig.4 Schematic drawing of the magneto immuno-PCR(M-IPCR)[34](A)HBsAg specific magnetosomeantibody conjugate and DNA-antibody conjugate are incubated simultaneously with the serum sample containing HBsAg resulting in a signal-generating detection complex;(B)The detection complex is concentrated using an externalmagneticfield. Subsequentwashing stepspermittheremovalofunbound materials; (C) After resuspending,a defined volume of the detection complex solution is transferred to a microplate containing the PCR mastermix to enable real-time PCR detection of the immobilized antigen
该方法将免疫磁性捕获与PCR相结合,一方面免疫磁性捕获去除了样品中可能对PCR造成干扰的物质,并浓缩了样品中的目标检测物;另一方面,PCR扩增进一步扩大了检测信号,提高了检测灵敏度。这种方法不仅灵敏度比ELISA高出100~10,000倍,而且在其可检测范围内,显示出了更好的线性关系。
本室构建了磁小体-多抗复合物,用于检测食品中的沙门氏菌 (Salmonella),其过程如图5所示。以沙门氏菌 (绿色)作为检测的目标菌株,以副溶血弧菌 (Vibrio parahaemolyticus,紫色)作为干扰菌株,人工污染6种常见的食品 (鸡蛋、果汁、饼干、猪肉、菠菜、牛奶)。将污染的样品经过梯度稀释后,用磁小体-抗体复合物特异性地捕获其中的沙门氏菌,磁场收集,以实时荧光定量PCR(FQ-PCR)检测捕获到的菌株的数量。实验发现,磁小体抗体复合物能够特异性地捕获样品中的沙门氏菌,其检测灵敏度为60 cfu/mL。该方法没有进行预增菌,用时3~4 h,而目前市售的检测试剂盒 (如Dynabeads),其检测限为100 cfu/mL,用时24 h。可见磁小体-多抗法的检测速度高于目前常用的方法。
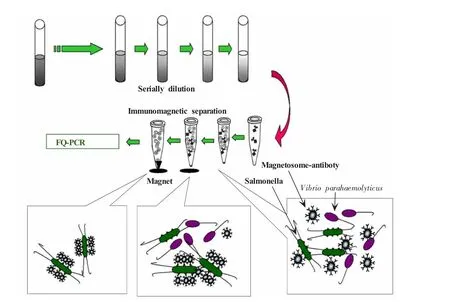
图5 磁小体抗体复合物免疫磁性分离沙门氏菌Fig.5 Schematic drawing of immunomagnetic separation(IMS)by magnetosome-antibody complex
3.4 与其它纳米材料的联合使用
蓖麻毒素是一种毒性很强的蛋白类毒素。庄洁等[35]将人工磁性纳米颗粒与蓖麻毒素抗体偶联形成复合物,并利用该复合物特异性捕获样品中的蓖麻毒素,然后与纳米胶体金标记的蓖麻毒素的另一种抗体形成双抗体夹心复合物。该夹心复合物中的纳米胶体金能够在对苯二酚存在的情况下,催化硝酸银析出单质银。将反应体系滴于微叉指电极上,生成的银颗粒填补了电极丝之间的空缺,使得微叉指电极的电容降低。电容的大小与蓖麻毒素含量呈反比关系,该方法的最低检测限为10 pmol/L。之后,用磁小体代替人工磁性纳米颗粒,背景噪音明显降低 (未发表数据)。
4 存在的问题
虽然一系列实验表明将磁小体用于免疫检测能获得理想的结果,但作为一种细菌合成的磁性纳米材料,磁小体的生化、物理等特征有待详细阐明。
4.1 磁小体膜的组分
目前缺乏对磁小体膜组分的全面详细的报道。Gorby等[36,37]曾对磁小体膜的特征进行了概括,指出磁小体膜中脂类主要含有中性脂和游离脂肪酸,其中糖脂、硫脂与磷脂的含量比为1∶4∶6,磷脂的主要种类是磷酯酰丝氨酸和磷脂酰乙醇胺。Han等[38]首次对磁小体表面基团进行了研究,发现磁小体表面氨基的含量为52.73 nmol/mg。而有关这些膜上氨基的种类、其它基团含量等问题仍无定论。对磁小体膜组成进行全面系统的分析,将有利于对磁小体进行更精确的修饰。
4.2 磁小体的分散性
在未经处理的情况下,人工纳米磁颗粒会发生聚集。虽然磁小体的表面有磷脂双分子层包被,且膜上存在负电荷,使它们之间产生了一定的排斥力,但使用过程中仍会产生聚集现象,使其不能均匀、稳定地悬浮于溶液中。磁小体的聚集容易导致实验结果不稳定,这种现象已成为磁小体应用研究中的限制因素。
2007年,Matsunaga等[39]为了改善磁小体的分散性,将融合表达Protein A的磁小体通过生物素-链霉亲和素体系固定在聚苯乙烯微球上,构建了一种新的复合物,称为“Beads on Beads”。实验结果证明,该复合物具有较好的分散性,并且磁性收集效率高,是一种高效的磁性免疫检测复合物。
我实验室尝试在缓冲液中添加不同的分散剂来改善磁小体的分散性,发现PEG和PVP的效果较好 (未发表数据)。但是如何彻底改善磁小体的分散性,同时又不影响磁小体和抗体的结合及磁小体-抗体复合物的活性,仍然需要进一步的探索。
4.3 磁小体的产量
由于趋磁细菌一般为微好氧或厌氧生长,对营养要求苛刻,人工培养水平低,难以获得大量细胞和磁小体,磁小体的应用研究仅限于实验室水平。截至2003年,国际上报道的磁小体最高产量为14 mg/L[40]。
2008年,孙建波等[41]突破了人工培养趋磁细菌的瓶颈,在42升自动发酵罐中有效地提高了细胞培养水平,磁小体的产量达42 mg/L。随后,刘江宁等[42]构建了高产磁小体的重组菌株,使磁小体产量提高至59 mg/L。目前,通过优化培养条件,磁小体的产量已稳定在80 mg/L左右,并有望进一步提高。
4.4 磁小体的标准化
随着磁小体应用研究的深入,制订磁小体质量标准成为亟待解决的问题。李想等[39]已经建立了一套回收、纯化磁小体的小型工艺,探讨了磁小体提取、纯化、灭菌和保存的方法,建立了采用能谱、红外光谱等手段测定磁小体纯度的方法。但目前的研究仅限于实验室水平,与工业化制备仍有差距,尚需制订适用于磁小体批量生产的质量标准。
5 展 望
与人工磁性材料相比,磁小体具有自身的优点:1)其大小均一,晶形和磁学性质稳定,易采用磁回收技术获得纯化颗粒;2)有脂膜包被,表面游离的各种基团可作为连接其它化合物的靶点,省略了人工包被的过程;3)能够通过融合表达的方法将多种外缘蛋白锚定在磁小体膜上,与化学偶联相比,其所得复合物更为稳定,且无需使用昂贵的双功能偶联剂,降低了磁性分离成本。以磁小体作为载体,将会成为磁性分离技术重要的发展趋势之一,因而在体外快速检测方面具有良好的应用前景。可见,以磁小体作为化合物及生物分子的载体具有多方面的优势,有望作为免疫磁性分离、检测技术的新成员。
致谢 感谢中国科学院生物物理所阎锡蕴研究员在纳米材料及毒素检测方面的指导和帮助,感谢中国科学院化学所电镜室况勋老师给予的帮助。
1. Blakemore R.Magnetotactic bacteria.Science,1975,190:377~379
2. Blakemore R,Maratea D,Wolfe RS.Isolation and pure culture ofa freshwatermagneticspirillum in chemically defined medium.J Bacteriol,1979,140:720~729
3. Balkwill D,Maratea D,Blakemore R.Ultrastructure of a magnetotactic spirillum.J Bacteriol,1980,141:1399~1408
4. BazylinskiDA,GarrattRA,FrankelRB. Electronmicroscopic studies ofmagnetosomes in magnetotactic bacteria.Microsc Res Tech,1994,27:389~401
5. Schüler D,Frankel RB.Bacterial magnetosomes:Microbiology,biomineralization and biotechnologicalapplications. Appl Microbiol Biotechnol,1999,52:464~473
6. Farina M,Esquivel DMS,Lins de Barros HGP.Magnetic iron-sulfurcrystalsfrom a magnetotacticmicroorganism.Nature,1990,343:256~258
7.Frankel RB,Papaefthymiou GC,Blakemore RP,O'Brien W.Fe3O4precipitation in magnetotactic bacteria. Biochim Biophys Acta,1983,763:147~159
8.Bazylinski DA,Heywood BR,Mann S,Frankel RB.Fe3O4and Fe3S4in a bacterium.Nature,1993,366:218~219
9.Mann S,Frankel RB,Blackmore RP.Structure,morphology and crystal growth of bacterial magnetite.Nature,1984,310:405~407
10. BazylinskiDA,GarrattRA,FrankelRB. Electronmicroscopic studies ofmagnetosomes in magnetotactic bacteria.Microsc Res Tech,1994,27:389~401
11.Moskowitz BM.Biomineralization of magnetic minerals.Rev Geophys,1995,33:123~128
12.Gorby YA,Beveridge TJ,Blakemore RP.Characterization ofthebacterialmagnetosomemembrane. JBacteriol,1988,170:834~841
13.Frankel RB,Bazylinski DA,Schüler D.Biomineralization of magnetic iron minerals in bacteria.Supramol Sci,1998,5:383~390
14.Tanaka M,Okamura Y,Arakaki A,Tanaka T,Takeyama H,MatsunagaT.Originofmagnetosomemembrane:Proteomic analysis of magnetosome membrane and comparison with cytoplasmic membrane.Proteomics,2006,6:5234~5247
15.Ceyhan B,Alhorn P,Lang C,Schüler D,Niemeyer CM.Semisynthetic biogenic magnetosome nanoparticles for the detection of proteins and nucleic acids.Small, 2006,2:1251~1255
16.Nakamura N,Matsunaga T.Highly sensitive detection of allergen using bacterial magnetic particles.Anal Chim Acta,1993,281:585~589
17.Nakamura N,Hashimoto K,Matsunaga T.Immunoassay method for the determination of immunoglobulin G using bacterialmagnetic particles. AnalChem,1991,63:268~272
18.Nakamura N,Burgess JG,Yagiuda K,Kudo S,Sakaguchi T,Matsunaga T.Detection and removal ofEscherichia coli using fluorescein isothiocyanate conjugated mono clonal antibody immobilized on bacterial magnetic particles.Anal Chem,1993,65:2036~2039
19.Guo LY,Wang QQ,Sun JB,Li ZY,Wang XQ,Li Y.Application of antibody-labeled magnetosomes in quantitative detection ofHBsAg with chemiluminescenceimmunoassays.Nanosc New Technol Rep,2006,11:55~59
20.Chen JF,Li Y,Wang ZF,Li JL,Jiang W,Li SH.High-sensitivity detection of fruit tree viruses using bacterial magnetic particles.J Integr Plant Biol,2009,51:409-413
21.Li X,Wang B,Jin HL,Jiang W,Tian JS,Guan F,Li Y.Bacterial magnetic particles(BMPs)-PEI as a novel and efficient non-viral gene delivery system.J Gene Med,2007,9:679~690
22.Matsunaga T,Kawasaki M,Yu X,Tsujimura N,Nakamura N.Chemiluminescence enzyme immunoassay using bacterial magnetic particles.Anal Chem,1996,68:3551~3554
23.Tanaka T,Matsunaga T.Detection of HbA1c by boronate affinityimmunoassay using bacterialmagnetic particles.Biosens Bioelectron,2001,16:1089~1094
24.Amemiya Y,Tanaka T,Yoza B,Matsunaga T.Novel detection system for biomolecules using nanosized bacterial magnetic particles and magnetic force microscopy. J Biotechnol,2005,120:308~314
25.Matsunaga T,Sato R,Kamiya S,Tanaka T,Takeyama H.Chemiluminescence enzyme immunoassayusing protein A-bacterial magnetite complex.J Magn Magn Mater,1999,194:126~134
26.Yoshino T,Takahashi M,Takeyama H,Okamura Y,Kato F,Matsunaga T.Assembly of G protein-coupled receptors onto nanosized bacterial magnetic particles using Mms16 as an anchor molecule.Appl Environ Microbiol,2004,70:2880~2885
27.Yoshino T,Matsunaga T.Efficient and stable display of functionalproteins on bacterialmagnetic particles using Mms13 as a novelanchormolecule. ApplEnviron Microbiol,2006,72:465~471
28.Matsunaga T,Takahashi M,Yoshino T,KuharaM,Takeyama H.Magnetic separation of CD14+cells using antibodybinding with protein A expressed on bacterial magnetic particles for generating dendritic cells.Biochem Biophys Res Commun,2006,350:1019~1025
29.Yoshino T,Hirabe H,Takahashi M,Kuhara M,Takeyama H,Matsunaga T.Magnetic cell separation using nano-sized bacterial magnetic particles with reconstructed magnetosome membrane.Biotechnol Bioeng,2008,101:470~477
30.MatsunagaT,SuzukiaT,TanakaaM,ArakakiaA.Molecular analysis of magnetotactic bacteria and development of functional bacterial magnetic particles for nano-biotechnology.Trends Biotechnol,2007,25:182~188
31.KuharaM,TakeyamaH,TanakaT,MatsunagaT.Magnetic cell separation using antibody binding with protein A expressed on bacterial magnetic particles.Anal Chem,2004,76:6207~6213
32.Matsunaga T,Ueki F,Obata K,Tajima H,Tanaka T,TakeyamaH,GodaY,FujimotoS. Fullyautomated immunoassaysystem ofendocrine disrupting chemicals using monoclonalantibodies chemically conjugated to bacterial magnetic particles.Anal Chim Acta,2003,475:75~83
33.Tanaka T,Takeda H,Ueki F,Obata K,Tajima H,Takeyama H,Goda Y,Fujimoto S,Matsunaga T.Rapid and sensitive detection of 17 beta-estradiol in environmental water using automated immunoassay system with bacterial magnetic particles.J Biotechnol,2004,108:153~159
34.Wacker R,Ceyhan B,Alhorn P,Schueler D,Lang C,Niemeyer CM. Magneto immuno-PCR: A novel immunoassay based on biogenic magnetosome nanoparticles.Biochem Biophys Res Commun,2007,357:391~396
35.Zhuang J,Cheng T,Gao L,Luo Y,Ren Q,Lu D,Tang F,Ren X,Yang D,Feng J,Zhu J,Yan X.Silica coating magnetic nanoparticle-based silver enhancement immunoassay for rapid electrical detection of ricin toxin.Toxicon,2010,55:145~152
36.Gorby YA,Beveridge TJ,Blakemore RP.Characterization ofthebacterialmagnetosome membrane. JBacteriol,1988,170:834~841
37.Grünberg K,Müller EC,Otto A,Reszka R,Linder D,Kube M,Reinhardt R,Schüler D.Biochemical and proteomic analysis of the magnetosome membrane in Magnetospirillum gryphiswaldense.Appl Environ Microbiol,2004,70:1040~1050
38.Han L,Li SY,Yang Y,Zhao FM,Huang J,Chang J.Comparison of magnetite nanocrystal formed by biomineralization and chemosynthesis.J Magn Magn Mater,2007,313:236~242
39.MatsunagaT,MaedaY,YoshinoT,TakeyamaH,Takahashi M,Ginya H,Aasahina J,Tajima H.Fully automated immunoassay for detection of prostate-specific antigen using nano-magnetic beads and micro-polystyrene bead composites,'Beads on Beads'.Anal Chim Acta,2007,597:331~339
40.Yang C,Takeyama H,Tanaka T,Matsunaga T.Effects of growth medium composition,iron sources and atmospheric oxygen concentrations on production of luciferase-bacterial magnetic particle complex by a recombinant Magnetospirillum Magneticum AMB-1. Enzyme Microb Technol,2001,29:13~19
41.Sun JB,Zhao F,Tang T,Jiang W,Tian JS,Li Y,Li JL.High-yield growth and magnetosome formation by Magnetospirillum gryphiswaldense MSR-1 in an oxygen-controlled fermentor supplied solely with air.Appl Microbiol Biotechno,2008,79:389~397
42.Liu J,Ding Y,Jiang W,Tian J,Li Y,Li J.A mutation upstream ofan ATPase gene significantly increases magnetosome production in Magnetospirillum gryphiswaldense. ApplMicrobiolBiotechnol,2008,81:551~558
This work was supported by a grant from The Funded by National High-Tech R&D Program(863 Program)(2007AA021805)
Modification of Bacterial Magnetosomes and Application of Magnetosome-Antibody Complex in Pathogen Detection
LI Aihua1,TANG Tao1,ZHANG Huiyuan2,WANG Qi2,TIAN Jiesheng1,LI Ying1
1.State Key Laboratories for Agro-biotechnology and College of Biological Sciences,China Agricultural University,Beijing 100193,China;
2.Food Safety Testing Centre,Beijing Entry-Exit Inspection and Quarantine Bureau,Beijing 100026,China
Mar 10,2010 Accepted:Jul 14,2010
TIAN Jiesheng,Tel:+86(10)62731440,E-mail:tianhome@cau.edu.cn
Magnetotactic bacteria synthesize Fe3O4or Fe3S4particlesin vivo,which are called magnetosome.Purified magnetosome are nano-sized and membrane-enclosed magnetic crystals with species-specific shape and size.They offer vast potential uses in immunoassay,diagnosis,targeting therapy,pollutant treatment and so on.Applications of magnetosome in magnetic immunoassay are briefly reviewed,including modification of magnetosome with chemical or biological methods,and their usage in immunomangtic separation and detection of pathogens.
Magnetosome;Magneotosome-antibody complex;Immunomagnetic separation;Immunoassay
2010-03-10;接受日期:2010-07-14
国家高技术研究与发展项目(863项目)(2007AA021805)
田杰生,电话:(010)62731440,E-mail:tianhome@cau.edu.cn
Q939.99
Biophysics Reports2010年8期
