碳纳米管作为核酸类物质转运载体的研究进展
张卫奇,许海燕
中国医学科学院基础医学研究所,北京协和医学院基础学院生物医学工程系,北京 100730
碳纳米管作为核酸类物质转运载体的研究进展
张卫奇,许海燕
中国医学科学院基础医学研究所,北京协和医学院基础学院生物医学工程系,北京 100730
基因治疗与RNA干扰治疗在遗传性疾病、恶性肿瘤、病毒感染等疾病治疗中具有巨大的潜力和应用前景。目前商业化的病毒载体和其它一些转染方法在转染效率和安全性方面仍需进一步的改进。近年来纳米生物医学研究的结果显示,碳纳米管有可能成为一种新型的基因转染与RNA干扰载体,具有转染效率高、毒性相对较小等优点。本文对碳纳米管作为核酸载体在基因治疗和RNA干扰治疗中的研究进展做了综合评述,对碳纳米管-核酸复合物的制备、表征及其在细胞环境中的去向等方面的研究进展也做了简要介绍。
碳纳米管;核酸;非病毒载体;基因转染;RNA干扰
0 引 言
基因治疗和RNA干扰(RNAi)在遗传性疾病、恶性肿瘤、病毒感染等疾病治疗中具有巨大的潜力和应用前景,但是,外源基因与siRNA序列的自身特性限制了其在疾病治疗中的应用,比如,在生理环境下易被核酸酶降解而半衰期短,进入细胞能力弱而导致转染效率低。病毒载体和其它一些转染方法可以克服上述部分困难,但是在基因治疗和RNAi应用中仍然存在一定的不足,例如病毒载体具有转染效率高的优点,但可能引起细胞发生突变和引发免疫反应;商业化脂质体对原代细胞转染效率低且可能引起炎症反应[1~3]。随着纳米技术的发展,纳米载体在核酸物质转运中的应用研究迅速增多,其中碳纳米管的独特性质吸引了越来越多的关注,作为一种新型的核酸物质转运载体已经显示出了其诱人的优势。
1 碳纳米管与核酸分子的相互作用及复合物的制备
碳纳米管可以看成由单层或多层石墨烯绕中心轴卷曲而成的无缝的纳米级管,根据石墨烯的层数而分为两种:单壁碳纳米管(single wall carbon nanotubes,SWNTs)和多壁碳纳米管(multi-wall carbon nanotubes,MWNTs)。碳纳米管与核酸的相互作用是成功组装碳纳米管-核酸复合物的关键。目前大多数研究集中在碳纳米管与单链DNA(ssDNA)的相互作用方面[4~7]。尽管ssDNA没有具有生物功能的序列,但是它与碳纳米管的相互作用可以帮助理解碳纳米管与双链DNA(dsDNA)和siRNA序列之间的相互作用,而这两个序列正是基因转染和RNA干扰(RNAi)中所应用的。研究结果显示,ssDNA与dsDNA均能通过疏水相互作用和核酸碱基与碳纳米管管壁芳香烃环之间的π-叠加作用而缠绕在碳纳米管上[6,8]。除疏水作用外,表面带有正电荷的碳纳米管能够通过静电作用将质粒吸附在碳纳米管表面,且吸附量与其表面修饰的基团类型和正电荷的密度相关[9,10]。碳纳米管与ssDNA的相互作用是具有核酸序列依赖性的,有趣的是,大部分研究中使用的序列都是GT重复序列[4,8,11,12]。然而来源于λDNA片段的随机顺序序列亦被证明可以缠绕到碳纳米管表面[13]。此外,核酸分子的长度会影响碳纳米管-核酸复合物的形态,长DNA序列会以更疏松的方式缠绕在碳纳米管周围,而且选择性更低[12]。
图1给出了碳纳米管与核酸分子形成复合物的几种途径。非共价吸附是制备碳纳米管-核酸复合物的一种常用方法。疏水相互作用、π-叠加作用和静电相互作用都可以驱使核酸缠绕或是吸附在正电修饰和未修饰的碳纳米管表面[14,15]。共价结合则是另外一种途径:核酸分子通过共价键连接于碳纳米管两端或是碳纳米管表面的修饰基团上,这种结合方式被认为比非共价吸附更稳定[16,17],但是在生理条件下,核酸分子从碳纳米管上释放出来可能会有困难[18]。在文献报道中,上述两种方法制备的碳纳米管-核酸复合物均表现出高转染效率,在某些情况下甚至可以高于商业化脂质体[19,20]。部分原因可能是碳纳米管对核酸酶形成了一定的空间位阻,对其所载核酸起到了保护作用[21]。在碳纳米管表面进一步修饰靶向基团和标记分子后,可以形成一个多功能的碳纳米管-核酸复合物,在进行靶向基因转染和RNAi的同时实现示踪[22]。由于各实验报道中应用的细胞种类、核酸序列以及碳纳米管的类型各有不同,目前仍难以判断哪种方式制备的碳纳米管-核酸复合物在基因转染和RNAi中具有更好的功能。除了将核酸分子结合到碳纳米管表面外,分子动力学模拟的结果显示,核酸分子还可以嵌入碳纳米管的内腔[23],此策略已在实验上应用于基因转染[24]。

图1 碳纳米管与核酸分子的相互作用示意图 (A)核酸分子通过π-叠加和疏水作用缠绕于原位合成碳纳米管上;(B)核酸分子通过静电相互作用吸附于带有正电荷的碳纳米管表面;(C)核酸分子嵌入碳纳米管内腔;(D)核酸分子通过共价键与碳纳米管连接Fig.1 The interaction between carbon nanotubes and nucleic acids (A)Nucleic acids wrap the pristine CNTs through π-stacking and hydrophobic interactions; (B) Nucleic acids are absorbed to the cationic-functionalized CNTs through electrostatic interaction;(C)Nucleic acids are inserted into the inner space of CNTs;(D)Nucleic acids are linked with CNTs through covalent bonding
2 碳纳米管-核酸复合物的表征
证明基因或siRNA序列是否与碳纳米管复合形成了碳纳米管-核酸复合物是非常关键的步骤。由于核酸分子自身的负电荷和紫外吸收特性,电泳和紫外吸收光谱可作为鉴定复合物形成的基本方法[9,25]。核酸与碳纳米管的导电性有明显差异,因此可以应用电子透射显微镜(TEM)来分辨碳纳米管-核酸复合物的形成[15,20]。原位合成的碳纳米管在电子显微镜视野下呈聚集状态;由于核酸修饰提高了碳纳米管的水分散性,碳纳米管-核酸复合物通常散落于电子显微镜视野下[26]。应用分辨率更高的超显微镜,如原子力显微镜(AFM)、扫描探针显微镜(SPM)和扫描隧道显微镜(STM),可以得到碳纳米管-核酸复合物的直径和高度数据[6,7]。碳纳米管表面存在的氮和磷元素可以间接提示碳纳米管-核酸复合物的形成[25]。除上述方法外,热失重分析(thermal gravity analysis,TGA)、茚三酮试验(Kaiser Test)等方法也被用来定性或定量分析碳纳米管-核酸复合物[20]。由于碳纳米管与核酸均具有独特的光学特性,所以光谱分析也可以用来表征碳纳米管与核酸分子之间是否形成了复合物。碳纳米管与核酸分子复合后,其拉曼光谱中的G带(约1580 cm-1)发生减弱[17,27]。碳纳米管表面包覆有DNA寡聚体时,其圆二色谱(circular dichroism,CD)会出现特征性的改变[5,28]。此外,当碳纳米管或核酸分子上标记有荧光分子或是量子点时,也可以利用标记基团的荧光特性对碳纳米管-核酸复合物进行表征[29,30]。
3 碳纳米管-核酸复合物在细胞中的定位
在转染过程中,外源基因或siRNA序列进入细胞核或细胞质发挥其生物功能。当碳纳米管作为载体时,核酸也应经过类似的过程表达蛋白或是沉默基因表达,但整个过程可能复杂许多。大量的实验已经表明,碳纳米管-核酸复合物可以高效率地进入细胞。目前认为碳纳米管-核酸复合物进入细胞的机制主要有两种,一是能量依赖的内吞途径,另一种是不需要能量的机械刺穿方式。前者主要通过被膜小泡(clathrin-coated pits)介导,后者因不需要能量而被认为没有细胞选择性[15,31]。究竟碳纳米管-核酸复合物进入细胞是否只与上述某个单一途径有关,还是存在其它入胞机制,或是几种途径同时存在,目前仍然不清楚[32],困难之一是实验手段还十分有限,某些方法的有效性还需要进一步的验证。Moon等人[33]发现,用Cy3标记的ssDNA-SWNTs复合物在含血清培养基中与HeLa细胞共孵育后,培养基中的核酸酶会导致Cy3染料脱落并大量进入细胞。因此当利用荧光分子标记核酸,对碳纳米管-核酸复合物进行示踪时,应谨慎处理实验条件和实验结果。
碳纳米管-核酸复合物进入细胞后可定位于内涵体[16]、溶酶体[11]、细胞质[17]及细胞核[34]。外源基因必须定位于细胞核才能完成外源蛋白表达,而siRNA序列定位于细胞质是完成RNAi的前提[1,35]。目前普遍认为,细胞内环境 (如酸度、离子浓度等)的变化会使以非共价方式构建的碳纳米管-核酸复合物中的核酸更容易释放。此外,利用二硫键将siRNA序列与碳纳米管连接,复合物被内吞后,其二硫键会在溶酶体内被酶解,siRNA序列得到释放而进入胞质,完成基因沉默[16]。值得注意的是,在体外环境中,复合于碳纳米管上的DNA仍然能指导其编码蛋白的合成[36],这提示连接于碳纳米管上的DNA在细胞中仍有可能具有功能,从而可以完成外源基因的表达。
迄今还很少有研究关注碳纳米管-核酸复合物在完成其生物功能后的归属。Strano等人[37]发现,由DNA寡聚体修饰的SWNTs在细胞重复分裂后仍然聚集于细胞当中。在随后的研究中,他们利用碳纳米管的自身荧光和实时监控技术,发现修饰有d(GT)15的SWNTs可以被外排出细胞[11,38]。这种现象可以部分地解释碳纳米管-核酸复合物相对较小的细胞毒性,因为这种外排可以使碳纳米管较少残留于细胞内。
4 碳纳米管作为核酸物质转运载体的研究进展
近年来许多实验室致力于利用碳纳米管作为载体进行基因和RNAi治疗,在抗肿瘤治疗方面的研究尤其突出。已有的研究结果显示,碳纳米管可以通过物理吸附或者化学连接的方式复合大量的核酸序列,同时能够有效保护核酸免受核酸酶降解;碳纳米管-核酸复合物可高效转染各种类型细胞,与商业化脂质体载体相比,表现出较低的细胞毒性;此外,碳纳米管可廉价合成且技术成熟,而且与各种生物大分子的连接比较简单易行,具有多功能化的潜能。这些特性使碳纳米管成为新型核酸载体的重要候选者之一。
4.1 碳纳米管作为基因载体
碳纳米管作为基因载体已经成功转染了多种动物细胞和具有细胞壁的植物细胞,以及大肠杆菌[24,39,40],表1总结了主要的一些实验结果。Kostarelos等率先报道了碳纳米管可以将β-gal基因转入动物细胞[15]。随后,他们发现以不同正电基团修饰的碳纳米管作为基因载体时,报告基因的表达水平取决于DNA与碳纳米管的复合强度,而复合强度与DNA和碳纳米管的正、负电荷比相关[9]。与此相似,MWNTs表面的电荷状态影响其所载基因的转染效率,只有带正电荷的氨基化MWNTs才能有效地转染动物细胞[10]。Leong等人[18]利用PEI修饰碳纳米管,得到的转染效率比单独使用PEI高3倍。Scherman等人[41]以非共价结合方式在SWNTs和MWNTs上修饰两种不同两性阳离子分子,用以转运lucirerase基因进入细胞。他们发现碳纳米管的直径和表面修饰的两性分子均与转染效率密切相关。Narain等人[42]发现以表面带有阳离子多糖的SWNTs作为载体,基因的转染效率可与商业化lipofectamin相当。为检测碳纳米管-核酸复合物的细胞毒性,Prakash等人[43]以sw480细胞作为模型,发现碳纳米管-核酸复合物的转染效率虽然较脂质体低,但其细胞毒性却比脂质体小很多。
碳纳米管作为基因载体时,还可以通过物理作用来提高基因转染效率。Cai等人[39,44]以内腔包含有镍颗粒的碳纳米管作为载体,将细胞置于外加磁场时,这种磁性碳纳米管可高效地将外源基因转入细胞,达到很高的转染效率。这种方法可以高效转染常规方法难以转染的原代神经元等细胞,并且不会引起B细胞的非特异性激活。Iwata等人[45]在金电极表面包被一层自组装膜,将碳纳米管吸附其上,再吸附质粒DNA。通过外界电脉冲的作用在细胞膜上形成微孔,电极上吸附的质粒被转运进入细胞,实现了高效转染的目的。还有一种方案是将碳纳米纤维构建成垂直转染阵列,通过针状碳纳米纤维的机械刺穿作用,将复合在其表面的外源基因直接导入目的细胞,有趣的是这种转染方法细胞毒性却比较小[46~48]。

表1 碳纳米管作为基因表达载体在多种细胞模型中的应用Table 1 Carbon nanotubes as gene expression vector in various cell models
4.2 碳纳米管作为RNAi载体
碳纳米管作为RNAi载体已经成功将siRNA序列或反义寡核苷酸序列(asODN)转运进入多种细胞,并在细胞水平和动物水平上实现对特定基因表达的沉默(表2)。Zhang等人[17]将myc asODN通过酰胺键连接到碳纳米管,这种复合物有效地沉默了HL-60细胞内的myc蛋白表达,导致细胞发生凋亡。Dai等[16,19]将siRNA通过二硫键与PEG化的磷脂分子连接,磷脂分子的尾部通过非特异性吸附结合于碳纳米管表面。这种方法构建的复合物中的siRNA通过二硫键在溶酶体内发生酶解而得以释放,从而有效地沉默了目的基因的表达,所达到的沉默效率比lipofectamine高。利用上述相同的碳纳米管-siRNA复合物设计,
Bottini等[49]有效地沉默了PTPN22在T淋巴细胞中的表达;Westerblad等人[29]通过下调TRPC3基因表达,证明TRPC3可以作为胰岛素抗性和Ⅱ型糖尿病治疗的靶标。

表2 碳纳米管作为基因沉默载体在细胞模型和动物体内的应用Table 2 Carbon nanotube as gene silencing vector
正电基团修饰的碳纳米管常被用来转运siRNA序列进入目的细胞,而且具有毒性相对较小的特点。氨基化的碳纳米管在室温下与Cyclin A2 siRNA序列孵育后,通过静电吸附作用形成了碳纳米管-siRNA复合物。这种复合物可以有效地下调癌基因Cyclin A2的表达,且未观察到明显的毒性[50,51]。Jia等人[30]将量子点标记的端粒酶asODN与修饰有PEI的碳纳米管复合后,在有效地沉默端粒酶表达并诱使细胞发生凋亡的同时,对asODN进行了示踪。这种带有量子点的碳纳米管-asODN复合物对目的细胞表现出很低的毒性。Hu[52]和Prato[53]研究组分别构建了树枝状大分子修饰的碳纳米管作为siRNA转运载体,在细胞水平沉默了目的基因的表达。此外,碳纳米纤维阵列亦可用来在细胞水平进行RNAi。Sayler等人[54]利用这种阵列,将含CFP干扰序列的shRNA结构成功转入目的细胞并有效地沉默了CFP基因的表达。
碳纳米管作为RNAi载体的体内研究也取得了进展。Yang等[25]将SWNTs与TERT siRNA偶联,通过给荷瘤小鼠直接瘤内静脉注射SWCNTs与siRNA的复合物,有效地抑制了肿瘤的生长。Kostarelos等人[20]以Calu 6肿瘤小鼠为模型,实验组瘤内注射MWNTs-PLK1 siRNA复合物,对照组瘤内注射脂质体-siRNA复合物,发现实验组小鼠的肿瘤生长得到有效抑制,且小鼠存活期得到明显延长。将未经修饰的碳纳米管与HIF-1α siRNA进行简单的超声混合即可形成碳纳米管-siRNA复合物。在瘤内注射这种复合物后,可以有效地干扰HIF-1α的表达并抑制小鼠肿瘤的生长[55]。McCarroll[56]用SWNTs-ApoB siRNA复合物有效地下调了小鼠肝脏ApoB表达和血浆中的胆固醇水平,且静脉注射siRNA用量少于1 mg/kg,这个剂量是临床应用中的一个可行剂量。
4.3 碳纳米管作为其它类型核酸的转运载体
碳纳米管能够运载核酸的性质还有一些特殊的应用研究(表3)。例如,由于带负电荷,具有佐剂性质的CpG序列很难进入细胞。Bianco等[57]用正电修饰的碳纳米管与CpG序列复合,有效地将CpG带入目的细胞而增强了其免疫激活功能。另一个特殊应用是通过互补寡核苷酸片段的相互结合作用,使碳纳米管在肿瘤组织中发生自组装。例如在碳纳米管上分别修饰RGD配体(靶向分子)、放射金属元素(示踪分子)及寡核苷酸序列,这种携带多种功能分子的碳纳米管进入肿瘤微血管后,由于寡核苷酸片段间的相互作用而发生自组装,形成复合物阻塞微血管,达到抑制肿瘤生长的目的[58]。尽管上述修饰过程比较繁琐复杂,但为进行抗肿瘤治疗提供了一种新的策略。此外,Gmeiner等人[26]在对荷瘤小鼠进行热疗时,发现DNA修饰的碳纳米管的热疗效果比未修饰的碳纳米管更好,这是由于DNA的修饰增加了碳纳米管的水分散性,使其获得了更高的热效应。
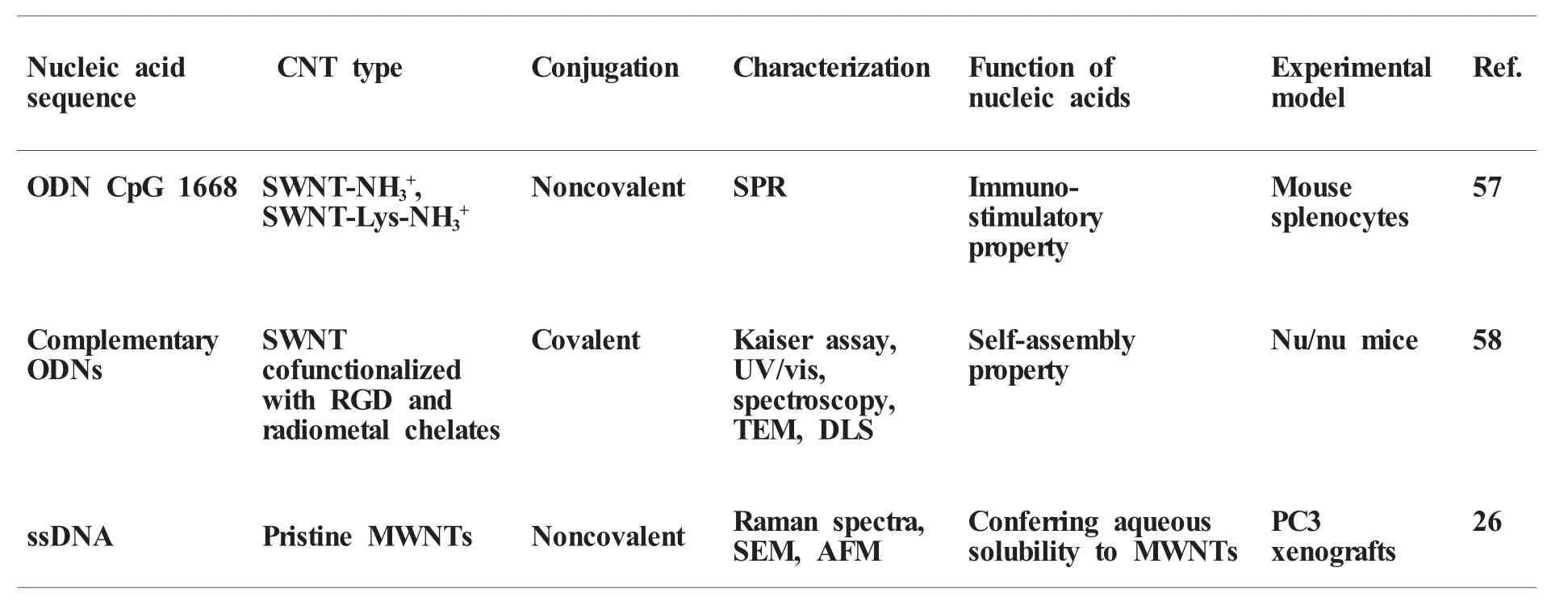
表3 碳纳米管在运载其它核酸药物方面的应用Table 3 CNTs as delivery vehicles for other nucleic acids drugs
4.4 碳纳米管作为核酸转运载体的靶向性
除了载体之外,基因传递的靶向性也是基因治疗与RNAi干扰中急需解决的重要问题。迄今,在体外条件下尚少见在碳纳米管-核酸复合物上连接靶向分子进行转染的文献报道,在动物水平的转染实验中,绝大多数研究采用了瘤内注射的方式。碳纳米管作为一类新的核酸载体,在实现纳米载体的靶向递送方面具有很大的发展空间。碳纳米管表面在连接核酸分子的同时,还可以与具有靶向性的分子相结合,成为具有定向传递功能的复合物。肿瘤细胞会高表达某些分子,在碳纳米管连接上这些分子的抗体或者配体后,如单克隆抗体Fab片段、核酸适配子(aptamer),有望使碳纳米管-核酸复合物对肿瘤细胞产生特异性的攻击作用。Scheinberg等[58]利用RGD多肽作为靶向分子,引导更多的碳纳米管-核酸复合物作用于肿瘤细胞,显示了碳纳米管-核酸复合物获得靶向的可行性。此外,利用内腔中包含有镍颗粒的碳纳米管作为核酸载体,在外界磁场的驱动下于体外可以高效转染原代神经元细胞,通过物理作用实现了靶向的功能[39]。
5 小 结
与传统的核酸转运载体相比,碳纳米管已经表现出其独特的优势。目前碳纳米管作为基因和RNAi载体仍处于研究阶段,离临床疾病治疗和商业化应用还有很大的距离。碳纳米管作为核酸转运载体的研究应该首要解决以下问题:1)进一步了解碳纳米管-核酸复合物在细胞中的定位、代谢以及核酸发挥功能的作用机制;2)在体内水平对碳纳米管-核酸复合物进行综合研究,建立优化的给药方式,将复合物靶向到特定的器官或组织;3)综合评价碳纳米管-核酸的生物学效应,对制作工艺进行标准化,从而使来自不同实验室的结果具有更好的比较性。
参考文献:
1.Patil SD,Rhodes DG,Burgess DJ.DNA-based therapeutics and DNA delivery systems:a comprehensive review.AAPS J,2005,7:61~77
2.Verma IM,Somia NV.Gene therapy—promises,problems and prospects.Nature,1997,389:239~242
3.Zhang JS,Liu F,Huang L.Implications of pharmacokinetic behavior of lipoplex for its inflammatory toxicity.Adv Drug Deliv Rev,2005,57:689~698
4.Zheng M,Jagota A,Strano MS,Santos AP,Barone PW,Chou SG,Diner BA,Dresselhaus MS,McLean RS,Onoa GB,Samsonidze GG,Semke ED,Usrey ML,Walls DJ.Structure-based carbon nanotube sorting by sequence-dependent DNA assembly.Science,2003,302:1545~1548
5.Dukovic G,Balaz M,Doak P,Berova ND,Zheng M,McLean RS,BrusLE. Racemicsingle-walled carbon nanotubesexhibitcirculardichroism whenwrappedwith DNA.J Am Chem Soc,2006,128:9004~9005
6.Lahiji RR,Dolash BD,Bergstrom DE,Reifenberger R.Oligodeoxyribonucleotide association with single-walled carbonnanotubesstudiedbySPM. Small,2007,3:1912~1920
7. Yarotski DA,Kilina SV,Talin AA,Tretiak S,Prezhdo OV,Balatsky AV,Taylor AJ.Scanning tunneling microscopy of DNA-wrapped carbon nanotubes.Nano Lett,2009,9:12~17
8. Heller DA,Jeng ES,Yeung TK,Martinez BM,Moll AE,Gastala JB,Strano MS. Opticaldetection ofDNA conformational polymorphism on single-walled carbon nanotubes.Science,2006,311:508~511
9. Singh R,Pantarotto D,McCarthy D,Chaloin O,Hoebeke J,Partidos CD,Briand JP,Prato M,Bianco A,Kostarelos K. Binding and condensation ofplasmid DNA onto functionalized carbon nanotubes:Toward the construction of nanotube-based gene delivery vectors.J Am Chem Soc,2005,127:4388~4396
10.Gao LH,Nie LH,Wang T,Qin YZ,Guo Z,Yang D,Yan X. Carbon nanotube deliveryofthe GFP gene into mammalian cells.Chembiochem,2006,7:239~242
11.Jin H,Heller DA,Strano MS.Single-particle tracking of endocytosis and exocytosis of single-walled carbon nanotubes in NIH-3T3 cells. Nano Lett,2008,8:1577~1585
12.Yang Q,Wang Q,Gale N,Oton CJ,Cui L,Nandhakumar IS,Zhu Z,Tang Z,Brown T,Loh WH.Loosening the DNA wrapping around single-walled carbon nanotubes by increasing the strand length.Nanotechnology,2009,20:195603~195607
13.Gigliotti B,Sakizzie B,Bethune DS,Shelby RM,Cha JN.Sequence-independenthelicalwrapping ofsingle-walled carbon nanotubes by long genomic DNA.Nano Lett,2006,6:159~164
14.Zheng M,Jagota A,Semke ED,Diner BA,McLean RS,Lustig SR,Richardson RE,TassiNG. DNA-assisted dispersion and separation of carbon nanotubes.Nat Mater,2003,2:338~342
15.Pantarotto D,Singh R,McCarthy D,Erhardt M,Briand JP,Prato M,Kostarelos K,Bianco A.Functionalized carbon nanotubes for plasmid DNA gene delivery.Angew Chem Int Ed,2004,43:5242~5246
16.Kam NW,Liu Z,Dai H.Functionalization of carbon nanotubes via cleavable disulfide bonds for efficient intracellular delivery of siRNA and potent gene silencing.J Am Chem Soc,2005,127:12492~12493
17.Cui DF,Tian FJ,Coyer SR,Wang J,Pan BR,Gao FG,He R,Zhang Y. Effectsofantisense-myc-conjugated single-walled carbon nanotubes on HL-60 cells.J Nanosci Nanotechnol,2007,7:1639~1646
18.Liu Y,Wu DC,Zhang WD,Jiang X,He CJ,Chung TS,Goh SH,Leong KW.Polyethylenimine-grafted multiwalled carbon nanotubes forsecure noncovalentimmobilization and efficient delivery of DNA.Angew Chem Int Ed,2005,44:4782~4785
19.Liu Z,Winters MA,Holodniy M,Dai H.siRNA delivery into human T cellsand primarycellswith carbon-nanotube transporters.Angew Chem Int Ed,2007,46:2023~2027
20.Podesta JE,Al-Jamal KT,Herrero MA,Tian B,Ali-Boucetta H,Hegde V,Bianco A,Prato M,Kostarelos K.Antitumor activity and prolonged survival by carbon-nanotube-mediated therapeuticsiRNA silencing in a human lung xenograft model.Small,2009,5:1176~1185
21.Wu Y,Phillips JA,Liu H,Yang R,Tan W.Carbon nanotubesprotectDNA strandsduring cellulardelivery.ACS Nano,2008,2:2023~2028
22.Prato M,Kostarelos K,Bianco A.Functionalized carbon nanotubes in drug design and discovery.Acc Chem Res,2008,41:60~68
23.Gao H,Kong Y,Cui D.Spontaneous insertion of DNA oligonucleotides into carbon nanotubes.Nano Lett,2003,3:471~473
24.Rojas-Chapana JA,Troszczynska J,Firkowska I,Morsczeck C,Giersig M.Multi-walled carbon nanotubes for plasmid delivery intoEscherichia colicells.Lab Chip,2005,5:536~539
25.Zhang Z,Yang XY,Zhang YH,Zeng BF,Wang S,Zhu TL,Roden RB,Chen YJ,Yang R.Delivery of telomerase reverse transcriptase small interfering RNA in complex with positively charged single-walled carbon nanotubes suppresses tumor growth.Clin Cancer Res,2006,12:4933~4939
26.Ghosh S,Dutta S,Gomes E,Carroll D,D'Agostino R,Olson J,Guthold M,Gmeiner WH.Increased heating efficiency and selective thermal ablation of malignant tissue withDNA-encasedmultiwalledcarbonnanotubes. ACS Nano,2009,3:2667~2673
27.Li Z,Wu Z,Li K.The high dispersion of DNA-multiwalledcarbon nanotubesand theirproperties. AnalBiochem,2009,387:267~270
28.Li X,Peng YW,Ren JW,Qu XM.Carboxyl-modified single-walled carbon nanotubes selectively induce human telomerici-motifformation. Proc NatlAcad SciUSA,2006,103:19658~19663
29.Lanner JT,Bruton JD,Assefaw-Redda Y,Andronache Z,Zhang SL,Severa D,Zhang ZB,Melzer W,Zhang SL,Katz A,Westerblad H.Knockdown of TRPC3 with siRNA coupled to carbon nanotubes results in decreased insulin-mediated glucose uptake in adult skeletal muscle cells.FASEB J,2009,23:1728~1738
30.Jia N,Lian Q,Shen H,Wang C,Li X,Yang Z.Intracellulardelivery ofquantum dots tagged antisense oligodeoxynucleotides by functionalized multiwalled carbon nanotubes.Nano Lett,2007,7:2976~2980
31.Kam NW,Liu Z,Dai H.Carbon nanotubes as intracellular transporters for proteins and DNA:An investigation of the uptake mechanism and pathway.Angew Chem Int Ed,2006,45:577~581
32.Ali-Boucetta H,Kostarelos K.Carbon nanotube cell biology:Not just a simple interaction.Eur J Nanomed,2008,1:29~32
33.Moon HK,Chang CI,Lee D-K,Choi HC.Effect of nucleases on the cellular internalization offluorescent labeled DNA-functionalized single-walled carbon nanotubes.Nano Res,2008,1:351~360
34.Kam NW,O'Connell M,Wisdom JA,Dai H.Carbon nanotubes as multifunctionalbiologicaltransporters and near-infrared agents for selective cancer cell destruction.Proc Natl Acad Sci USA,2005,102:11600~11605
35.Krajcik R,Jung A,Hirsch A,Neuhuber W,Zolk O.Functionalization of carbon nanotubes enables non-covalent binding and intracellular delivery of small interfering RNA for efficient knock-down of genes.Biochem Biophys Res Commun,2008,369:595~602
36.Rege K,Viswanathan G,Zhu G,Vijayaraghavan AS,Ajayan PM,Dordick JS.In vitrotranscription and protein translation from carbon nanotube-DNA assemblies.Small,2006,2:718~722
37.Heller DA,Baik S,Eurell TE,Strano MS.Single-walled carbon nanotube spectroscopy in live cells:Towards long-term labels and optical sensors.Adv Mater,2005,17:2793~2799
38.Jin H,Heller DA,Sharma R,Strano MS.Size-dependent cellular uptake and expulsion ofsingle-walled carbon nanotubes:Single particle tracking and a generic uptake model for nanoparticles.ACS Nano,2009,3:149~158
39.Cai D,Mataraza JM,Qin ZH,Huang Z,Huang J,Chiles TC,Carnahan D,KempaK,RenZ. Highly efficient moleculardelivery into mammalian cells using carbon nanotube spearing.Nat Methods,2005,2:449~454
40.Liu Q,Chen B,Wang Q,Shi X,Xiao Z,Lin J,Fang X.Carbon nanotubes as moleculartransportersforwalled plant cells.Nano Lett,2009,9:1007~1010
41.Richard C,Mignet N,Largeau C,Escriou V,Bessodes M,Scherman D.Functionalization of single-and multi-walled carbon nanotubeswith cationicamphiphilesforplasmid DNA complexation and transfection.Nano Res,2009,2:638~647
42. AhmedM,JiangX,DengZ,NarainR. Cationic glyco-functionalized single-walled carbon nanotubes as efficient gene delivery vehicles.Bioconjug Chem,2009,20:2017~2022
43.Kulamarva A,Bhathena J,Malhotra M,Sebak S,Nalamasu O,Ajayan P,Prakash S. In vitro cytotoxicity of functionalized single walled carbon nanotubes for targeted gene delivery applications. Nanotoxicology,2008,2:184~188
44.Cai D,Doughty CA,Potocky TB,Dufort FJ,Huang Z,Blair D,Kempa K,Ren ZF,Chiles TC.Carbon nanotubemediated delivery ofnucleic acids does notresultin non-specific activation of B lymphocytes.Nanotechnology,2007,18:365101~365110
45.Inoue Y,Fujimoto H,Ogino T,Iwata HI.Site-specific gene transfer with high efficiency onto a carbon nanotube-loaded electrode.J R Soc Interface,2008,5:909~918
46.McKnight TE,Melechko AV,Griffin GD,Guillorn MA,Merkulov VI,Serna F,Hensley DK,Doktycz MJ,Lowndes DH,Simpson ML. Intracellularintegration ofsynthetic nanostructures with viable cells for controlled biochemical manipulation.Nanotechnology,2003,14:551~556
47.McKnight TE,Melechko AV,Hensley DK,Mann DGJ,Griffin GD,Simpson ML.Tracking gene expression after DNA delivery using spatially indexed nanofiberarrays.Nano Lett,2004,4:1213~1219
48.Fletcher BL,McKnight TE,Melechko AV,Simpson ML,Doktycz MJ. Biochemicalfunctionalization ofvertically aligned carbon nanofibres. Nanotechnology,2006,17:2032~2039
49.Delogu LG,Magrini A,Bergamaschi A,Rosato N,Dawson MI,BottiniN,BottiniM. Conjugation ofantisense oligonucleotides to PEGylated carbon nanotubes enables efficient knockdown of PTPN22 in T lymphocytes.Bioconjug Chem,2009,20:427~431
50.Wang X,Song Y,Ren J,Qu X.Knocking-down cyclin A(2)by siRNA suppresses apoptosis and switches differentiation pathways in K562 cells upon administration with doxorubicin.PLoS One,2009,4:e6665
51.Wang X,Ren J,Qu X.Targeted RNA interference of cyclin A2 mediated by functionalized single-walled carbon nanotubes induces proliferation arrestand apoptosis in chronicmyelogenousleukemiaK562cells. Chem Med Chem,2008,3:940~945
52.Pan B,Cui D,Xu P,Ozkan C,Feng G,Ozkan M,Huang T,Chu B,LiQ,He R,Hu G. Synthesisand characterization of polyamidoamine dendrimer-coated multiwalled carbon nanotubesand theirapplication in gene delivery systems. Nanotechnology,2009,20: 125101~125109
53.Herrero MA,Toma FM,Al-Jamal KT,Kostarelos K,Bianco A,Da Ros T,Bano F,Casalis L,Scoles G,Prato M.Synthesis and characterization ofa carbon nanotubedendron series for efficient siRNA delivery.J Am Chem Soc,2009,131:9843~9848
54.MannDG,McKnightTE,McPhersonJT,HoytPR,Melechko AV,Simpson ML,Sayler GS.Inducible RNA interference-mediated gene silencing using nanostructured gene delivery arrays.ACS Nano,2008,2:69~76
55.Bartholomeusz G,Cherukuri P,Kingston J,Cognet L,Lemos R,Leeuw TK,Gumbiner-Russo L,Weisman RB,Powis G.In Vivotherapeutic silencing of hypoxia-inducible factor 1 alpha(HIF-1)using single-walled carbon nanotubes noncovalently coated with siRNA.Nano Res,2009,2:279~291
56.McCarroll J,Baigude H,Yang C,Rana TM.Nanotubes functionalized with lipids and natural amino acid dendrimers:a new strategy to create nanomaterials for delivering systemic RNAi.Bioconjugate Chem,2010,21:56~63
57.Bianco A,Hoebeke J,Godefroy S,Chaloin O,Pantarotto D,Briand JP,Müller S,Prato M,Partidos CD.Cationic carbon nanotubes bind to CpG oligodeoxynucleotides and enhance their immunostimulatory properties.J Am Chem Soc,2005,127:58~59
58.Villa CH,McDevitt MR,Escorcia FE,Rey DA,Bergkvist M,Batt CA,Scheinberg DA.Synthesis and biodistribution of oligonucleotide-functionalized,tumor-targetable carbon nanotubes.Nano Lett,2008,8:4221~4228
This work was supported by a grant from National Basic Research Program of China(973 Programe)(2010CB934002)
Current Progress of Carbon Nanotubes as Novel Class Carrier for Nuleic Acid Substance
ZHANG Weiqi,XU Haiyan
Department of Biomedical Engineering,Institute of Basic Medical Sciences,Chinese Academy of Medical Sciences&Peking Union Medical College,Beijing 100730,China
Mar 10,2010 Accepted:May 14,2010
XU Haiyan,Tel:+86(10)65296437,E-mail:xuhy@pumc.edu.cn
GeneandRNAitherapieshaveshownagreattherapeuticpotentialagainstthehereditary diseases,cancers,virus infections,and many other diseases as well.However,the existing commercialized virus vectors and other transfection protocols still have their deficiency such as unexpected side effects and low transfection efficiency during the delivery process.With the rapid advance of nanobiomedcine in recent years,carbon nanotubes(CNTs)have demonstrated their advantages as one potential vector with enhanced transfection efficiency and less toxic effects.This review is attempting to summarize the research progress of CNTs as a class of novel vector to deliver nucleic acids in gene therapy and RNA interference,as well as to introduce the fabrication,physicochemicalcharacterization and fate ofcarbon nanotube-nucleicacid conjugates interior the cells.
Carbon nanotubes;Nucleic acid;Non-virus vector;Gene transfection;RNAi
2010-03-10;接受日期:2010-05-14
国家重大科学研究计划项目(2010CB934002)
许海燕,电话:(010)65296437,E-mail:xuhy@pumc.edu.cn
R318.08,Q782

