纳米颗粒抗菌机理的研究进展
马万顺,崔 燕,赵玉云,郑文富,张 伟,蒋兴宇,张文杰
1.北京林业大学理学院,北京 100183;2.国家纳米科学中心,北京 100190;3.东南大学,南京 210096
纳米颗粒抗菌机理的研究进展
马万顺1,2,崔 燕2,3,赵玉云2,郑文富2,张 伟2,蒋兴宇2,张文杰1
1.北京林业大学理学院,北京 100183;2.国家纳米科学中心,北京 100190;3.东南大学,南京 210096
随着具有抗菌效应的纳米颗粒被大量报道,纳米颗粒的抑菌杀菌机理也成为重要的研究领域并取得一定进展,本文综述了常见纳米颗粒作用机理的研究进展。当前大多数实验表明,纳米颗粒引起细胞膜的破坏是其抗菌抑菌效应的主要原因,结合已有研究,作者提出,纳米颗粒抑菌杀菌分为四个阶段:同细胞的接触、与细胞膜的相互作用及对膜的破坏、胞内杀菌和细菌死亡。文中重点分析探讨了纳米颗粒同细菌细胞膜作用过程中一些待解答的基础性问题。最后通过比较发现,纳米颗粒同抗生素作用方式相异,而与抗菌肽的作用模式相近,细菌对纳米颗粒较难产生耐药性,这对当前治疗耐药菌株的感染有良好的前景。
纳米颗粒;抗菌机理;抗生素;抗菌肽
0 引 言
在人类使用抗生素治疗传染病的80年里,多重药物耐受性菌株大量产生,世界卫生组织(WHO)2007年报告,目前70%~90%的痢疾(志贺氏菌属)、肺炎(肺炎球菌性)、淋病和医院感染(金黄色葡萄球菌)对第一代抗生素耐药,这极大地增加了病人的痛苦和治疗费用。具有抑菌抗菌作用的纳米颗粒的不断报道,给医疗保健领域带来了曙光,开发和应用纳米抗菌剂使得深入研究纳米颗粒的抗菌机理显得尤为迫切。另一方面,纳米颗粒的生物安全和环境效应正引起环境卫生部门和科学家的广泛关注[1]。微生物是生态系统中的分解者,大量被释放到环境中的纳米颗粒,将会对人体和其他生物机体,以及环境中的微生物生态系统造成怎样的影响?即纳米颗粒的毒性和生态效应,更需要关注和研究。纳米技术是一柄双刃剑,使人类受益,同时也会有潜在危害,了解纳米颗粒的抗菌机理,对于评估其在复杂生态系统中的风险尤为重要。
目前,人们已经开发了各种各样的纳米颗粒,并详细表征了它们的物化性质和抗菌活性,以及对哺乳动物细胞的毒性。许多纳米颗粒都表现出良好的抗菌性能,且对动物细胞的毒性较低,这些纳米颗粒可以作为新型的抗菌剂,目前已有部分产品用于临床。但对它们抑菌杀菌的微观分子机制还没有清晰的描述,甚至对同一种纳米颗粒都存在相反的观点,如,银纳米颗粒[2~6]和C60[7~9]的抗菌活性至今仍有不同的解释。本文综述了目前国内外对常见纳米颗粒抗菌机理的研究进展,整合了当前人们对纳米颗粒抑菌杀菌生化和生物物理过程中的认识,提出纳米颗粒抗菌过程可以分为四个阶段,分析了抗菌机理研究中所面临的难点和基础性问题,最后将纳米颗粒与传统抗生素类药物进行对比,分析其作用方式的异同,以促进纳米颗粒抗菌机理进一步研究,同时为理性地设计高抗菌性能产品并更好的规避纳米产品的潜在危险提供指导。
需要说明的是,对于能够杀灭或是抑制微生物(包括细菌、霉菌、衣原体、立克次体、病毒甚至原生动物)的材料,人们通常都称为抗菌材料(antimicrobial materials)。这是一种广义的抗菌概念,比较准确地应该叫“抗微生物”。在本文中,除非特殊说明,一般指其狭义的概念——抗细菌(antibacteria)。
1 抗菌纳米材料
纳米材料(nanomaterials)至少在一个维度上处于0.1~100 nm范围内。纳米颗粒一般为球形或类球形,由数目极少的原子簇或分子簇组成,是一种介于宏观块体和微观原子/分子之间的介观系统[1]。在这个尺度范围内的抗菌材料,根据其来源和作用方式的不同,大致可以分为三种类型:纳米化的传统抗菌材料、无机金属和金属氧化物纳米颗粒,以及新型表面改性的纳米颗粒。
第一类,纳米化的传统抗菌材料。传统抗菌材料(如抗生素、抗菌肽和壳聚糖等)以纳米脂质体和纳米粒等形式给药,可以提高药物在机体中的传输效率,增强药物的稳定性和靶向性,极大拓展了传统药物在临床治疗和日常生活中的适用范围,提高了治疗指数,是目前临床使用纳米抗菌药物的主要形式。纳米化后,药物的抗菌活性还是依靠自身携带的抗菌剂分子。
第二类是无机金属纳米颗粒和金属氧化物类,以及其掺杂形式的纳米颗粒。包括银(Ag)、铜(Cu)、二氧化钛(TiO2)、氧化镁(MgO)、氧化铜(CuO)和氧化锌(ZnO),以及碲化镉(CdTe)量子点等。表现出对革兰氏阴性(G-)和革兰氏阳性菌(G+)较强的杀菌性能。
第三类是将富勒烯(C60等)、聚苯乙烯(polystyrene,PS)及其他有机和无机金属纳米颗粒进行表面改性。这些纳米颗粒经过改性后显示出抑菌抗菌活性,如,无抗菌活性PS颗粒当表面被引入聚乙胺分子后,则显示出较强的抗菌活性[10]。
自纳米颗粒抗菌现象发现以来,人们就一直从生物学和生物物理学两个方面进行研究。其中,生物学研究侧重表征纳米颗粒抗菌效应的大小和生物安全性,生物物理学则旨在发现宏观生物学效应的分子基础,为理性地设计高抗菌性能产品和更好的规避潜在的危险提供指导。纳米颗粒抗菌活性的表征通常参考抗生素等标准化的方法进行,但由于各个实验室使用的菌株和纳米颗粒有差异,且同一种纳米颗粒也会因合成的工艺方法的差别,在颗粒大小、晶型结构、表面形貌和成分等物性上不同,不同实验室所得到的结果并不完全一致。三种类型的抗菌纳米颗粒中,除第一类的抗菌纳米颗粒抗菌机制相对明确外,后面两类的抗菌机理都没有被解释清楚。表1总结了当前常见的各种具有抗菌效应的纳米颗粒在作用机理方面的研究进展。

表1 常见抗菌纳米颗粒的作用机理研究进展Table 1 Antibacterial mechanisms of nanoparticles
2 纳米颗粒的抑菌过程
目前,纳米颗粒的抗菌机制尚未获得一致的认识,它们同细菌细胞相互作用的动态过程许多细节还未清晰地认知,但是借助于众多的分析工具和研究手段,尤其是电镜和荧光显微镜等可视化手段,结合抗生素、抗生肽和具有抗菌效应的表面研究,已经积累了一些认识。根据已有的这些认识,纳米颗粒的抗菌效应可以大致概括为图1所示的几种机制,其抑菌的过程可以分为如下四个阶段:纳米颗粒同细菌的接触;同细胞膜的相互作用及引起膜的透化;胞内杀死阶段;细菌死亡。在这四个阶段中,随着纳米颗粒和菌株的不同,它们发生相互作用的方式和结果可能不尽相同,某些情况下纳米颗粒与细胞膜发生相互作用,使细胞膜结构和功能严重破坏;而某些情况下抗菌效应可能来自纳米颗粒穿膜后对胞内成分生物学功能的干扰[20]。
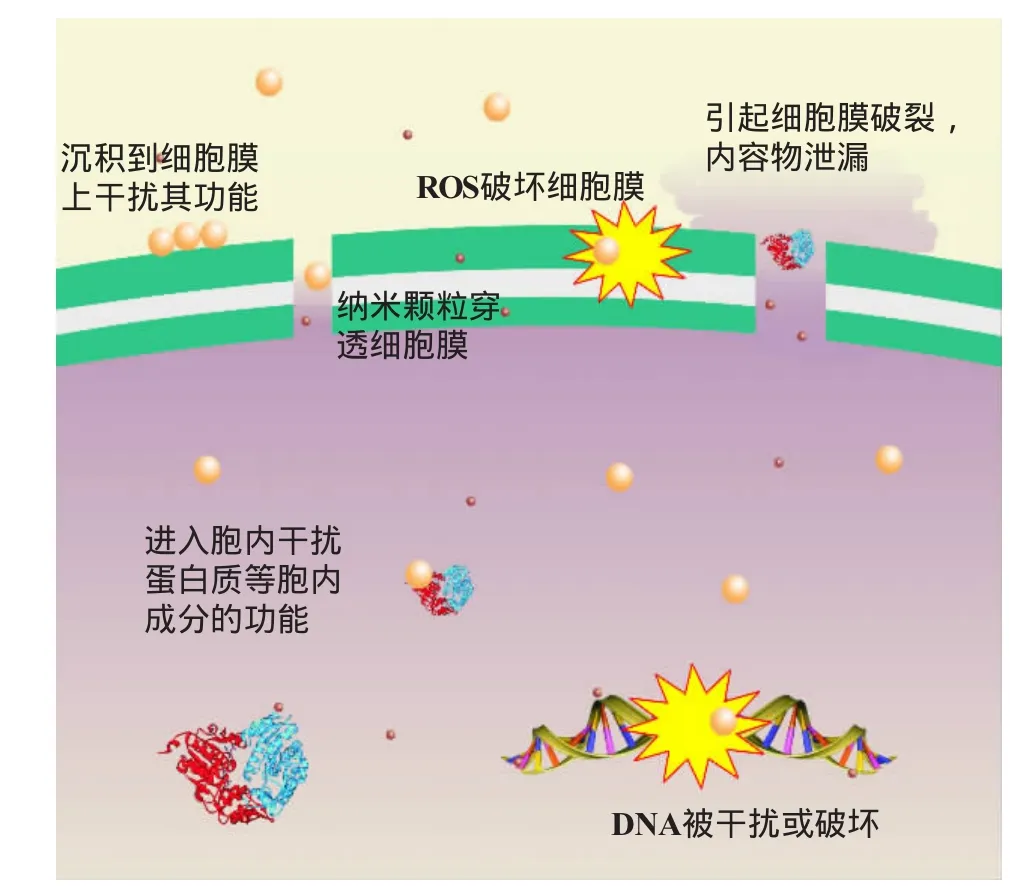
图1 纳米颗粒抗菌效应的可能机理 ①沉积到细胞表面的纳米颗粒干扰细胞膜的功能;②纳米颗粒产生的ROS破坏细胞膜的成分和结构;③纳米颗粒的穿膜效应引起膜的破坏和内容物泄漏;④纳米颗粒进入胞内干扰或破坏蛋白质和核酸等生命分子的功能。黄色颗粒表示纳米颗粒,棕色小颗粒表示纳米颗粒释放的小分子成分Fig.1 Possible models for antibacterial mechanisms ofnanoparticles①Todisturbfunctionsof biomembrane by deposited nanoparticles on bacterial surface;②Disruption of the bacterial cell membrane by ROS produced by nanoparticles;③Disruption of bacterial cellmembraneand leakageofintercellular content by nanoparticlesacrossthemembrane;④Tointerfere intercellular metabolism by disturbed the function of proteins and DNA.The yellow balls denote nanoparticles,and the small brown balls denote molecules released by nanoparticles
2.1 纳米颗粒与细胞膜的接触
在透射电镜和扫描电镜照片中,纳米颗粒往往吸附在细菌表面(图1),一些研究者提出,纳米颗粒同细菌的接触是抑菌或杀菌过程的一个必要条件[26]。浮游生长的细菌表面细胞外基质少,纳米颗粒同细菌表面接触机会多,易感性强;而生物膜(biofilms)中存在大量的胞外基质,减少了同纳米颗粒的直接接触,易感性弱。这一定程度上支持该观点。金属氧化物等纳米颗粒可以产生活性氧自由基(reactive oxygen species,ROS),其中纳米颗粒引起的主要是O2·和OH·,ROS十分活泼,几乎可以同接触到的所有生物分子发生反应,这使得它们的寿命和作用距离都很短。例如,O2·的寿命仅为10-6到10-5s,OH·仅能同周围的分子反应[17,27]。因此可以认为,只有同细菌接近或者接触才能使ROS发挥效应。
关于细菌和纳米颗粒的接触,存在静电相互作用和受体介导的特异性相互作用两种观点,其中静电相互作用被普遍认可。生理条件下,绝大多数的细菌表面呈负电性,理论上,带正电荷的纳米颗粒同细菌吸引而吸附,带负电荷的纳米颗粒同细菌排斥。但是研究却发现,两种电荷的纳米颗粒都可以吸附到细菌的表面,这可能同纳米颗粒表面的电荷测定方法和细菌表面的异质性 (heterogeneity)有关。纳米颗粒表面电荷的性质通常用表面电势 (ζ-电势)来表示,它受颗粒的表面成分、吸附的离子,以及溶液中的离子种类和强度影响。已报道SiO2NP、FeNP、AgNP、AuNP、TiO2NP、ZnONP等的ζ-电势受到溶液pH值、离子强度和表面包被成分的影响[26]。在细菌和纳米颗粒混合的复杂体系中,纳米颗粒的ζ-电势往往已不同于测定值,这时测定值不能反映真实值,这是方法学上的一种局限,虽然该类方法目前仍在广泛使用。细菌表面整体上呈负电性,但不同区域所含的分子不同,电荷性质有别,而且同一分子也存在不同电荷的基团,因此纳米颗粒可以同细菌表面的异性电荷区域或基团相互吸引而结合到细菌表面。细菌表面电荷的不同会影响纳米颗粒同胞体静电力的大小,以及对细菌毒性的强弱[28]。通过受体介导的纳米颗粒同菌体的结合,见于抗菌肽纳米颗粒,如Nisin[22]。Nisin能够同细胞壁合成的基本前体LipidsⅡ特异性结合,促使G+细菌膜上孔洞的形成,从而对细菌有很强的杀伤力[29]。
2.2 同细胞表面的相互作用及引起膜的透化
电镜和原子力显微镜等可视化手段表明,各种纳米颗粒到达细菌表面后往往引起细胞膜产生形貌上的变化(图2~4展示了部分纳米颗粒作用后的细胞形貌),图2展示了氨基修饰的C60同S.oneidensis MR-1作用时纳米颗粒沉积在细菌表面,引起胞体产生无法修补的大孔洞[19];图3显示出ZnONP不但改变了细菌的外部形貌,而且可以穿过细胞膜内化到E.coli细胞的胞体内[15];图4显示了ZnO颗粒对细胞形貌和完整性的破坏[30]。还有AgNP作用的E.coli细胞膜出现许多凹陷,且大量的AgNP嵌入细菌的细胞膜[31];CdTe量子点作用于E.coli胞体,使原本相对光滑的表面产生大凹陷,且深度远大于细胞壁的厚度[20]。荧光染色和酶学等方法也表明,纳米颗粒引起了细胞完整性或渗透屏障的破坏直至膜的透化。由于细菌细胞膜在营养物的吸收和分泌物释放、物质代谢和能量产生,以及细胞的生长分裂等多个生命的基本环节都发挥着重要的作用,细胞膜的完整性和功能的破坏会同时造成内容物大量泄漏,因此绝大多数的研究者都将纳米颗粒诱导细菌死亡的直接原因归结为膜的破坏。膜结构和功能的破坏会导致能量合成受阻,这可能是AgNP等纳米颗粒干扰膜蛋白等的合成、加工和正确组装,以致大量膜蛋白的前体在细胞质中积累的直接原因。
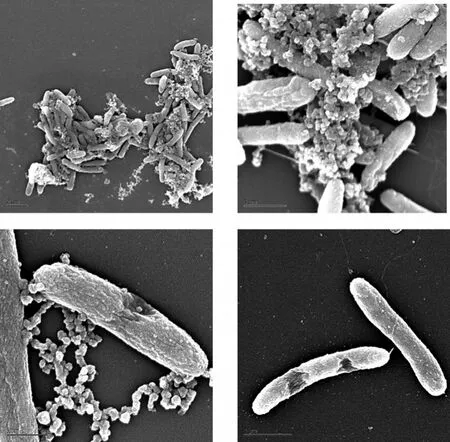
图2 氨基修饰的C60作用于S.oneidensisMR-1[19]可见纳米颗粒沉积在菌体表面并引起胞体产生巨大孔洞Fig.2 NH2-C60caused cell ofS.oneidensisMR-1 to produce holes[19]

图3 ZnONP内化到E.coli细胞胞体内的透射电镜超薄切片图片[15]Fig.3 The internalization of ZnONP into E.coli[15]
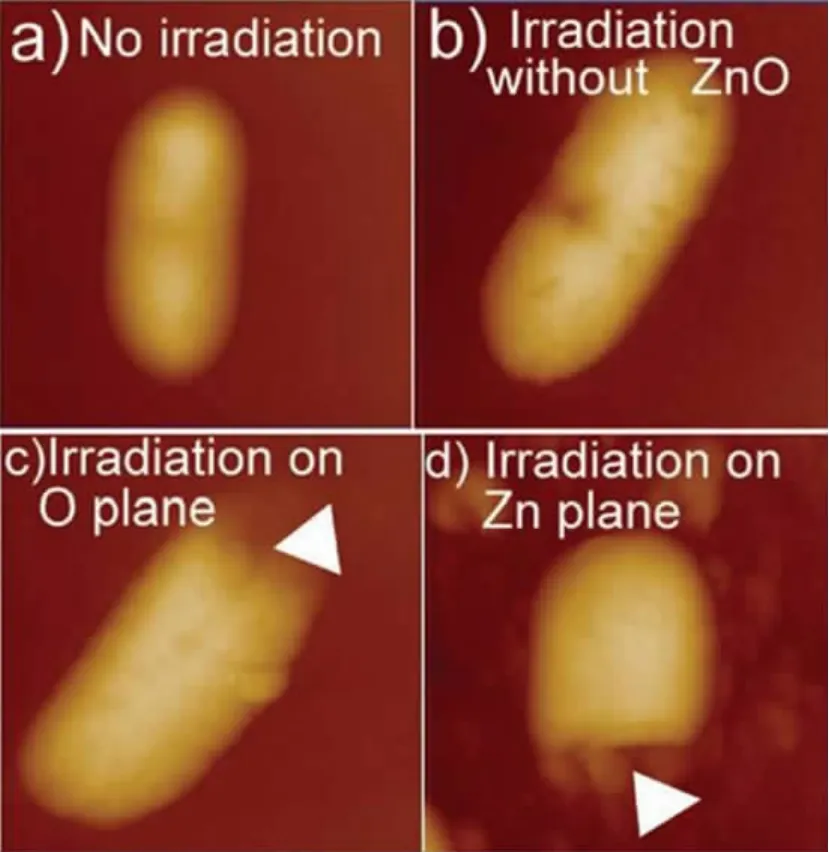
图4 在紫外线和ZnONP作用下的E.coli的原子力显微镜照片[30](A)没有紫外线和ZnONP,细胞结构完整;(B)紫外线照射下,细胞出现凹陷;紫外线照射在O晶面(C)和Zn晶面(D),对细菌造成破坏Fig.4 The photos ofE.coliexposed at VU and ZnONP taken by AFM[30](A)No UV and ZnONP,no damage;(B)Exposed in UV,pits appeared;The severe damage of cells,when irradiation on O plane(C)and Zn plane(D)
纳米颗粒相对尺度较大,当纳米颗粒进入细胞时会严重地破坏细胞膜的结构和渗透性。当把一些具有抗菌效应的纳米颗粒修饰或者沉积到宏观材料表面上,这些表面也表现出杀菌抑菌效应[32~34],或者把一些宏观材料的表面作同第三类纳米抗菌纳米颗粒同样的修饰(如表面修饰一层PEI等)也表现出抗菌效应,因此笔者认为,绝大多数纳米颗粒表面分子或结构对细菌膜的破坏,是杀菌抑菌作用的主要机制。由于纳米颗粒有更高的比表面积和更高的药物负载量,故表现出更高的抗菌效应。
纳米颗粒到达细菌表面直至引起细胞膜的透化,是纳米颗粒发挥抗菌效应最重要的过程之一,探讨纳米颗粒同生物膜相互作用是本领域的基础性课题。但由于生物膜本身的复杂性和分析手段的局限,这一复杂的生物物理和生化过程还有多个问题未被认识清楚。
其一,纳米颗粒在细胞膜上的作用位点,是膜上的蛋白质还是磷脂分子抑或是其他的成分,其专一性如何?金属氧化物纳米颗粒产生的ROS可以氧化膜的多种成分[19],这些损伤的脂多糖(lipopolysaccharides,LPS)、磷脂的脂链,会从膜上脱落或者引起膜的结构重排和形貌的改变,使细菌膜的渗透性发生变化,直至出现一些凹陷和孔洞;而对于那些非ROS因素杀菌的纳米颗粒,还没有证据明确表面纳米颗粒的作用位点究竟是磷脂分子层,还是膜蛋白或者其它分子。对G-而言,我们并不清楚致密有序的LPS和磷脂双分子层同纳米颗粒发生了怎样的相互作用,而使细胞膜发生重排乃至溶解、破裂,尽管一些实验也揭示了纳米颗粒同磷脂膜相互作用时磷脂膜的构象和完整性的变化过程[35]。利用支持性脂双层膜(supported lipid bilayers)发现,纳米颗粒,如聚阳离子化合物(polyethyleneimine和diethylaminoethyl-dextran等)和无机颗粒(Au-NH2,SiO2-NH2),能够诱导脂膜的破坏,包括形成孔洞、膜变薄或者膜的溶解[36]等一系列相行为的变化。实验发现,极性的纳米颗粒可以使沉积在云母表面上的磷脂膜形成1.2~22 nm的孔洞[37]。羧基化修饰的C60可以作用于G+菌,但对G-菌没有影响,而氨基化的C60则可以引起E.coli和S.oneidensis MR-1这些G-菌的细胞膜渗漏,造成细胞死亡,对于G+菌却没有影响[19],而这两类细菌在膜结构上,除了肽聚糖层外还在磷脂成分上有着显著的差别。磷脂成分的不同可能是两种纳米颗粒表现出不同抗菌效应的重要原因之一。另外,纳米颗粒表面对细菌表面电荷的中和作用,会干扰膜电势,影响细胞对一些离子和极性分子的吸收,从而抑制细菌的生长。
其二,表观抑菌浓度同细菌膜表面阈值浓度的关系,即表面沉积多少纳米颗粒才能引起细菌死亡。由于纳米颗粒和细菌之间较强的静电力使吸附速率大于解离速率,因此细菌表面吸附的纳米颗粒的浓度往往要大于最初溶液中纳米颗粒的浓度,两者之间的较为精确的数量关系还有待研究。影响阈浓度的参数很多,如纳米颗粒的类型和颗粒的尺寸,以及表面成分、菌株膜的成分和结构、溶液的环境等。影响阀浓度的另外一个可能的重要因素是许多细菌细胞膜的膜电位 (Δψ),推测Δψ牵动着纳米颗粒泳向非极性细胞膜环境,并有效地降低了孔洞形成的能量障碍。
其三,纳米颗粒是如何穿过细胞膜的?细菌的超薄切片显示纳米颗粒不但在细胞表面上积累,也可以进入胞体[15](见图2),一些研究者还捕捉到纳米颗粒正好嵌在细胞膜中这一穿膜过程的“中间态”。细菌的细胞膜既是屏障又是物质进出的通道,对于各种通道分子而言,纳米颗粒尺寸过大,在G-菌的外膜中,孔蛋白 (porins)是外界分子进出胞体的主要通道,但允许通过的一般为小于600 D的分子,几乎所有的纳米颗粒都会因尺寸过大而被“限行”。有研究者[26]曾提出,孔蛋白GspD理论上可以介导直径为1~9 nm的纳米颗粒的进入,但目前还未被证实。原核细胞中会不会存在类似真核细胞的胞吞现象呢?目前未见报道。笔者也分析了已发表文献中所附的电镜照片,未发现胞内的纳米颗粒周围存在典型的内陷膜结构。目前,较为合理的推测是,纳米颗粒同细菌细胞膜相互作用时,使磷脂膜由规则的、连续的凝胶相或液晶相,变为倒六角相等孔洞结构这样的复杂状态,甚至大面积破裂,纳米颗粒在静电作用等的牵引下或以布朗运动方式进入胞内。
遗憾的是,上述几个问题的认识还不够深入。这一方面是由于细胞膜结构的复杂和研究手段的匮乏;另一方面,抗菌纳米颗粒的应用相对不足,导致机理研究落后。加之纳米颗粒的作用机制会因细菌的特异性、纳米颗粒的浓度、微生物细胞膜的生物物理性质等不同而异,而且同一种微生物也可能有几种不同的作用机制,更增添了认识的难度。因此,需要研究者用多种方法、从不同角度来研究,以期得到更为全面的认识。
2.3 胞内杀菌
现在,大多数的研究者都将纳米颗粒引起细菌死亡的主要原因归结为,纳米颗粒破坏了细胞膜的完整性引起膜的透化,但是也不能排除纳米颗粒进入细胞和细菌内部而与重要的功能分子发生相互作用,使生长受到抑制。许多的体外实验表明,纳米颗粒可以同胞内的多种成分,如DNA和各种蛋白质,发生相互作用。不过实际情况中,纳米颗粒到达胞内后能否有效地干扰这些成分的生物学功能,还没有明确的报道。一些现象则与体外实验相反,例如,AgNP对E.coli表达的绿色荧光蛋白信号没有影响[38],也有研究发现纳米颗粒对细菌的中心代谢系统(如三羧酸循环)没有显著的影响[19]。综合地推测,纳米颗粒在胞内可能有如下几种干扰效应:1)使胞内成分发生絮凝反应;2)抑制细胞壁生成,影响细菌分裂;3)结合到染色体等遗传物质上,影响染色体的复制和基因的表达,抑制蛋白质等成分合成;4)干扰各种酶促反应,影响代谢反映;5)影响细胞膜生成,抑制隔膜形成。
2.4 细菌的“死亡”
无论是膜结构的破坏还是干扰了内部代谢活动,抑或是这几种效应的累积,细菌的生长繁殖得到抑制,甚至完整的生命结构不复存在了,从宏观上讲,这都是细菌的死亡。
3 纳米颗粒与其它抗菌药物的比较
与抗生素、抗菌肽相比,纳米颗粒属于一种新型的抗菌剂,在提高药效、降低成本、改善安全性上还有很大的发展空间。现阶段,纳米颗粒产品,多在一些体外杀菌、医用材料的表面消毒和日常饮用水处理净化,以及日用品的表面消毒等方面使用,其中AgNP的应用最为广泛[39]。表2中比较了纳米颗粒、抗生素和抗菌肽的抗菌机制和应用,可以发现,纳米颗粒同抗菌肽在作用方式上有较大的相似性,它们通过干扰破坏细胞膜的功能和结构,从而起到抗菌抑菌的作用。

表2 纳米颗粒同抗生素和抗生肽作用机制的比较Table 2 The comparisons among antibacterial nanoparticles,antibiotics and antibacterial peptides
与传统抗生素相比,纳米颗粒的优势之一就是能有效地作用于多重耐药性菌,原因如下:1)传统抗生素对细菌的作用靶点通常是单一的蛋白或者蛋白复合物(如青霉素结合蛋白、拓扑异构酶等),而纳米颗粒同抗生肽类似,主要是非特异性地作用在细菌细胞膜上,引起膜的破坏;2)作为生命体都有一定的自身保护机制,这种在个体层次或者群体层次上的保护机制即耐药机制。有研究者发现细菌也会对纳米颗粒的胁迫产生保护机制,例如Liu等[40]发现细菌所分泌的胞外基质(extracellular polymeric substance),可以明显地降低氮掺杂的TiO2纳米颗粒的杀菌性能。有报道称nC60存在时,革兰氏阴性菌P.putida的环丙烷脂肪酸(cyclopropane fatty acids)量增多,而革兰氏阳性菌B.subtilis中单不饱和顺式或反式分支脂肪酸有所增多,这些变化都会增强细胞膜的稳定性[26],从而利于细菌的生存。由于纳米颗粒同抗生肽作用相似,细菌通过变异来完全改变膜的性质从而产生耐药菌的几率是比较低的;传统抗生素的抗药菌在底于MIC浓度下培养几代即可产生,耐药菌产生频率约为10-7至10-10[29]。纳米颗粒同抗生素有较大差异,由于尺寸上的差异,纳米颗粒太大,不能像抗生素那样专一抑制关键酶的作用位点而干扰细菌的生长和繁殖,但是它独特的结构和表面大量特殊基团所产生的效应,可以破坏细胞膜的功能和结构,引起通透性的改变。一些研究者[41]将抗菌肽作用模式形象地称作割开细胞膜的“分子刀”,那么纳米颗粒则像是掷在细菌细胞膜上的一颗颗“分子炸弹”,破坏了细胞膜的结构。
抗生素、抗菌肽和纳米颗粒等抗菌剂各有长处和应用范围,有很强的市场互补性,将来也许会出现综合这几类药物的联合抗菌剂,用来治疗日益增多的耐药菌。
3 结语和展望
具有抗菌作用的纳米产品的大量开发和应用,将是促进纳米颗粒抗菌机理研究的推动力。当前的微纳米技术,已可以对单个微生物细胞进行跟踪研究;通过更高分辨率的可视化方法以及其他一些光谱等分析手段,可以实时观测单个细胞死亡过程中纳米颗粒同细胞膜和胞质分子相互作用的分子细节,为我们认识纳米颗粒的生物物理过程提供有利的帮助;日渐成熟的基因组学、蛋白质组学和生物信息学等组学技术的应用,可以揭示纳米颗粒对细菌的基因表达、蛋白质合成以及整体新陈代谢产生的干扰。综合各种手段,全面系统地认识纳米颗粒抗菌机理,将会在今后一段时期取得不断的进步。纳米颗粒抗菌机理的深入认识,将有助于我们设计更高效、更安全的纳米颗粒,也可更好地评估和规避纳米颗粒所产生的负面效应。
致谢 感谢国家纳米科学中心王黎明博士对文章提出的宝贵意见。
参考文献:
1. Nel A,Xia T,Madler L,Li N.Toxic potential of materials at the nanolevel.Science,2006,311(5761):622~627
2. Morones JR,Elechiguerra JL,Camacho A,Holt K,Kouri JB,Ramirez JT,Yacaman MJ.The bactericidal effect of silvernanoparticles. Nanotechnology,2005,16(10):2346~2353
3.Pal S,Tak YK,Song JM.Does the antibacterial activity of silver nanoparticles depend on the shape of the nanoparticle? A study ofthe gram-negative bacterium Escherichia coli. Appl Environ Microbiol,2007,73(6):1712~1720
4.Lok CN,Ho CM,Chen R,He QY,Yu WY,Sun H,Tam PK,Chiu JF,Che CM. Silvernanoparticles:Partial oxidation and antibacterial activities.J Biol Inorg Chem,2007,12(4):527~534
5.Lok CN,Ho CM,Chen R,He QY,Yu WY,Sun H,Tam PK,Chiu JF,Che CM.Proteomic analysis of the mode of antibacterial action of silver nanoparticles.J Proteome Res,2006,5(4):916~924
6. Su HL,Chou CC,Hung DJ,Lin SH,Pao IC,Lin JH,Huang FL,Dong RX,Lin JJ.The disruption of bacterial membrane integrity through ROS generation induced by nanohybrids of silver and clay.Biomaterials,2009,30(30):5979~5987
7. Lee J,Fortner JD,Hughes JB,Kim JH.Photochemical production ofreactive oxygen species by C60in the aqueous phase during uv irradiation.Environ Sci Technol,2007,41(7):2529~2535
8. Lyon DY,Alvarez PJ.Fullerene water suspension(nC60)exerts antibacterialeffects via ROS-independentprotein oxidation.Environ Sci Technol,2008,42(21):8127~8132
9. Zhang XD,Su HJ,Zhao Y,Tan TW.Antimicrobial activities of hydrophilic polyurethane/titanium dioxide complex film under visible light irradiation.J Photochem Photobiol A-Chem,2008,199(2-3):123~129
10.Beyth N,Houri-Haddad Y,Baraness-Hadar L,Yudovin-Farber I,Domb AJ,Weiss EI.Surface antimicrobial activity and biocompatibility of incorporated polyethylenimine nanoparticles.Biomaterials,2008,29(31):4157~4563
11.Li WR,Xie XB,Shi QS,Zeng HY,Ou-Yang YS,Chen YB.Antibacterial activity and mechanism of silver nanoparticles on Escherichia coli. ApplMicrobiolBiotechnol,85(4):1115~1122
12.丁 浩,童忠良,杜高翔.纳米抗菌技术.北京:化学工业出版社,2007.244 Ding H,Tong ZL,Du GX.Nano antibacteria technology.Beijing:Chemical Industry Press,2007.244
13.Yoon KY,Hoon Byeon J,Park JH,Hwang J.Susceptibility constants ofEscherichia coliandBacillus subtilisto silver and copper nanoparticles.Sci Total Environ,2007,373(2-3):572~575
14.Ruparelia JP,Chatterjee AK,Duttagupta SP,Mukherji S.Strain specificity in antimicrobialactivity ofsilver and copper nanoparticles.Acta Biomater,2008,4(3):707~716
15.Brayner R,Ferrari-Iliou R,Brivois N,Djediat S,Benedetti MF,FievetF. Toxicologicalimpactstudiesbased on Escherichia colibacteria in ultrafine ZnO nanoparticles colloidal medium.Nano Lett,2006,6(4):866~870
16.Zeyons O,Thill A,Chauvat F,Menguy N,Cassier-Chauvat C,Orear C,Daraspe J,Auffan M,Rose J,Spalla O.Direct and indirect CeO2 nanoparticles toxicity for Escherichia coli and synechocystis.Nanotoxicology,2009,3(4):284~295
17.Thill A,Zeyons O,Spalla O,Chauvat F,Rose J,Auffan M,Flank AM. Cytotoxicity ofCeO2nanoparticles for Escherichia coli.Physico-chemical insight of the cytotoxicity mechanism.Environ Sci Technol,2006,40(19):6151~6156
18.Adams LK,Lyon DY,McIntosh A,Alvarez PJ.Comparative toxicity of nano-scale TiO2,SiO2and ZnO water suspensions.Wat Sci Technol,2006,54(11-12):327~334
19.Tang YJ,Ashcroft JM,Chen D,Min G,Kim CH,Murkhejee B,LarabellC,Keasling JD,Chen FF.Charge-associated effects of fullerene derivatives on microbial structural integrity and central metabolism.Nano Lett,2007,7(3):754~760
20.Lu Z,Li CM,Bao H,Qiao Y,Toh Y,Yang X.Mechanism of antimicrobial activity of CdTe quantum dots.Langmuir,2008,24(10):5445~5452
21.Pinto-Alphandary H,Andremont A,Couvreur P.Targeted delivery of antibiotics using liposomes and nanoparticles:Research and applications.Int J Antimicrob Agents,2000,13(3):155~168
22.LiuLH,XuKJ,WangHY,TanPKJ,FanWM,Venkatraman SS,Li LJ,Yang YY.Self-assembled cationic peptide nanoparticles as an efficient antimicrobial agent.Nat Nanotechnol,2009,4(7):457~463
23.RabeaEI,BadawyME,StevensCV,SmaggheG,Steurbaut W.Chitosan as antimicrobial agent:Applications and mode ofaction. Biomacromolecules,2003,4(6):1457~1465
24.Qi L,Xu Z,Jiang X,Hu C,Zou X.Preparation and antibacterialactivity ofchitosan nanoparticles. Carbohyd Res,2004,339(16):2693~2700
25.No HK,Young Park N,Ho Lee S,Meyers SP.Antibacterial activity of chitosans and chitosan oligomers with different molecular weights.Int J Food Microbiol,2002,74(1-2):65~72
26.Neal AL.What can be inferred from bacterium-nanoparticle interactions about the potential consequences of environmental exposure to nanoparticles? Ecotoxicology,2008,17(5):362~371
27.KangS,HerzbergM,RodriguesDF,ElimelechM.Antibacterial effects of carbon nanotubes:Size does matter!Langmuir,2008,24(13):6409~6413
28.Feris K,Otto C,Tinker J,Wingett D,Punnoose A,Thurber A,Kongara M,Sabetian M,Quinn B,Hanna C,Pink D.Electrostatic interactions affect nanoparticle-mediated toxicity to gram-negative bacterium pseudomonas aeruginosa pao1.Langmuir,2010,26(6):4429~4436
29.侯晓姝,胡宗利,陈国平,李 勇,王炳琴,李栀恩.抗菌肽的抗菌机制及其临床应用.微生物学通报,2009,36(1):97~105 Hou XS,Hu ZL,Chen GP,Li Y,Wang BQ,Li ZE.Antimicrobial peptides: Antibacterial mechanism and therapeutic use.Microbiology,2009,36(1):97~105
30.Wang Y,Huang F,Pan D,Li B,Chen D,Lin W,Chen X,Li R,Lin Z.Ultraviolet-light-induced bactericidal mechanism on ZnO single crystals. Chem Comm,2009,44:6783~6785
31.Sondi I,Salopek-Sondi B.Silver nanoparticles as antimicrobial agent:A case study on E. colias a modelfor gram-negative bacteria.J Colloid Interf Sci,2004,275(1):177~182
32.Lyon DY,Brown DA,Alvarez PJ.Implications and potential applications ofbactericidalfullerene watersuspensions:Effect of nC(60)concentration,exposure conditions and shelf life.Wat Sci Technol,2008,57(10):1533~1538
33.Lyon DY,Brunet L,Hinkal GW,Wiesner MR,Alvarez PJ.Antibacterial activity of fullerene water suspensions(nC60)is not due to ros-mediated damage.Nano Lett,2008,8(5):1539~1543
34.Lyon DY,Fortner JD,Sayes CM,Colvin VL,Hughe JB.Bacterial cell association and antimicrobial activity of a C60water suspension.Environ Toxicol Chem,2005,24(11):2757~2762
35.Wang B,Zhang LF,Bae SC,Granick S.Nanoparticleinduced surface reconstruction of phospholipid membranes.Proc Natl Acad Sci USA,2008,105(47):18171~18175
36.Leroueil PR,Berry SA,Duthie K,Han G,Rotello VM,McNerny DQ,Baker JR Jr,Orr BG,Holl MMB.Wide varieties of cationic nanoparticles induce defects in supported lipid bilayers.Nano Lett,2008,8(2):420~424
37.Roiter Y,Ornatska M,Rammohan AR,Balakrishnan J,Heine DR,Minko S.Interaction of nanoparticles with lipid membrane.Nano Lett,2008,8(3):941~944
38.Gogoi SK,Gopinath P,Paul A,Ramesh A,Ghosh SS,Chattopadhyay A. Green fluorescentprotein-expressing Escherichia colias a model system for investigating the antimicrobialactivities ofsilvernanoparticles. Langmuir,2006,22(22):9322~9328
39.Chen X,Schluesener HJ.Nanosilver:A nanoproduct in medical application.Toxicol Lett,2008,176(1):1~12
40.Liu Y,Li J,Qiu XF,Burda C.Bactericidal activity of nitrogen-doped metal oxide nanocatalysts and the influence ofbacterialextracellularpolymericsubstances(EPS). J Photochem Photobiol A:Chem,2007,190(1):94~100
41.Chen XY,Tang HZ,Even MA,Wang J,Tew GN,Chen Z.Observing a molecular knife at work.J Am Chem Soc,2006,128(8):2711~2714
This work was supported by grants from The National Natural Science Foundation of China(90813032)and National Basic Research Program of China("973"Program)(2009CB930001)
Progress of Antibacterial Mechanisms Study on Nanoparticles
MA Wanshun1,2,CUI Yan2,3,ZHAO Yuyun2,ZHENG Wenfu2,ZHANG Wei2,JIANG Xingyu2,ZHANG Wenjie1
1.School of Science,Beijing Forest University,Beijing 100183;
2.Laboratory of Nanomedicine and Nanobiology,National Center for Nanoscience Technology of China,Beijing 100190;
3.Southeast University,Nanjing 210096
Aug 9,2010 Accepted:Aug 11,2010
ZHANG Weijie,Tel:+86(10)62336098,E-mail:wjzhang@bjfu.edu.cn
An explosive number ofreportson antimicrobial nanoparticleshasnot yet translate into a comprehensive understanding of how these materials affect bacteria at the molecular level of.This review aims to summarize some of these antibacterial mechanisms.We propose that contacts,nanoparticlesmediated disruption of bacterial membranes,interactions between NPs and bacterial components within the membrane and bacteria death,are generally necessary steps in this process.We compare the differences of actions between nanoparticles,antibiotics and antimicrobial peptides.
Nanoparticles;Antibacterial mechanisms;Antibiotics;Antibacterial peptides
2010-08-09;接受日期:2010-08-11
国家自然科学基金项目(90813032)、国家重大科学研究计划基金项目(2009CB930001)
张文杰,电话:(010)62336098,E-mail:wjzhang@bjfu.edu.cn
R318.08,Q939.92

