上转换发光成像技术与靶向成像应用
陈 敏, 熊丽琴, 李富友
复旦大学化学系和先进材料实验室,上海 200433
上转换发光成像技术与靶向成像应用
陈 敏, 熊丽琴, 李富友
复旦大学化学系和先进材料实验室,上海 200433
上转换发光是指稀土离子吸收两个或两个以上低能光子 (近红外光)而辐射一个高能光子(可见光)的发光现象。与传统紫外激发相比,上转换发光由于采用近红外光激发而具有高的组织穿透深度、弱的生物样品损伤且无生物样品自发荧光,这些优点表明上转换发光在生物成像方面具有广阔的应用前景。文章介绍了基于稀土上转换发光过程的显微成像技术和活体成像技术,及其在肿瘤靶向成像领域的应用。
上转换发光;稀土纳米材料;生物成像;靶向
0 引 言
随着生物医学研究的不断深入,重大疾病的早期诊断和发病机制的研究迫切需要相关科学技术的不断发展。可视化的生物成像技术在生命科学和医学领域扮演着越来越重要的角色。相比于其它生物成像技术而言,荧光成像具有价格低廉、成像快速的特点,并具有分子水平的敏感性 (单分子成像)[1]。其中,荧光探针在荧光成像中起到对观察对象进行标记和示踪的作用[2]。有机荧光团是人们最早用于染色生物样品的发光材料,也是目前使用最为广泛的荧光探针,但其光稳定性差,不适于长时间连续观察;此外,其吸收和发射带较宽,Stokes位移较小,在多色成像时易串色。半导体量子点具有光稳定性好且发射峰窄的特点,在生物医学研究中备受重视[3,4]。但是,半导体量子点的潜在生物毒性和化学不稳定性限制了它在生物成像领域的进一步应用。而且,荧光染料和量子点通常是用高能量紫外(ultraviolet,UV)或者可见光作为激发光,带来了一些明显的缺点,如较低的光穿透深度、可能的生物组织破坏,以及生物样品的自发荧光等。
近年来,上转换发光纳米材料 (upconversion nanophosphors,UCNPs)作为新一代生物发光标记,受到了人们的广泛关注。上转换发光 (upconversion luminescence,UCL)是指稀土离子吸收两个或两个以上低能光子而辐射一个高能光子的发光现象,通常是指近红外(near infrared,NIR)光转换为可见光[5]。迄今为止,上转换材料主要是掺杂稀土元素的固体化合物,利用稀土元素的亚稳态能级特性,可以吸收多个低能量的长波辐射,从而使人眼看不见的红外光变成可见光 (图1)。相比有机荧光染料和量子点等下转换发光标记而言,上转换发光标记因采用近红外连续激光作为激发源,具有较深的光穿透深度、无生物背景荧光干扰、对生物组织几乎无损伤等显著优势[6~9]。这些特征使UCNPs在生物成像领域拥有巨大的应用前景。
1 单光子激发发光、双光子激发发光及上转换发光的成像形式比较
稀土的上转换发光是一个连续光激发的多光子发光过程,它不同于普通的单光子发光和双光子荧光过程[5]。我们对UCNPs的上转换发光的成像形式、有机染料 (以罗丹明B为例)的单光子及双光子激发发光的成像形式进行了比较 (图2),发现三者有显著的差别。在罗丹明B的单光子激发中,除了焦点处的染料分子产生荧光,焦平面上下的染料分子也被激发产生荧光 (图2A)。非焦面的荧光会严重地影响焦面处的图像,为了消除非焦面发光的影响,共聚焦荧光显微镜采用了针孔技术。在罗丹明B的双光子激发中,由于激发功率和发射强度存在平方关系,只有激光束聚焦的焦点处的染料分子被有效激发而发光 (图2B);因此,双光子荧光成像具有内在的三维分辨率,不需要使用针孔技术。对UCNPs的上转换发光而言,沿着激发光的路径都有上转换发光 (图2C)。此外,稀土离子的摩尔吸光系数很低,对激发光的能量改变很小,因此上转换发光在焦平面上方和下方呈对称的圆锥形分布。用980 nm飞秒激光激发得到的结果与上述现象相同。产生这一现象的原因源于UCNPs独特的上转换发光机制,在这一过程中,多光子的吸收和能量转移是通过一系列实际存在的中间能级实现的,表现为激发功率和UCNPs的上转换发光强度之间存在非线性关系。以上实验结果说明:UCNPs的上转换发光的成像形式明显不同于有机染料的单光子及双光子激发发光的成像形式。同时,非焦面的上转换发光信号对UCNPs用于生物成像非常不利[6]。
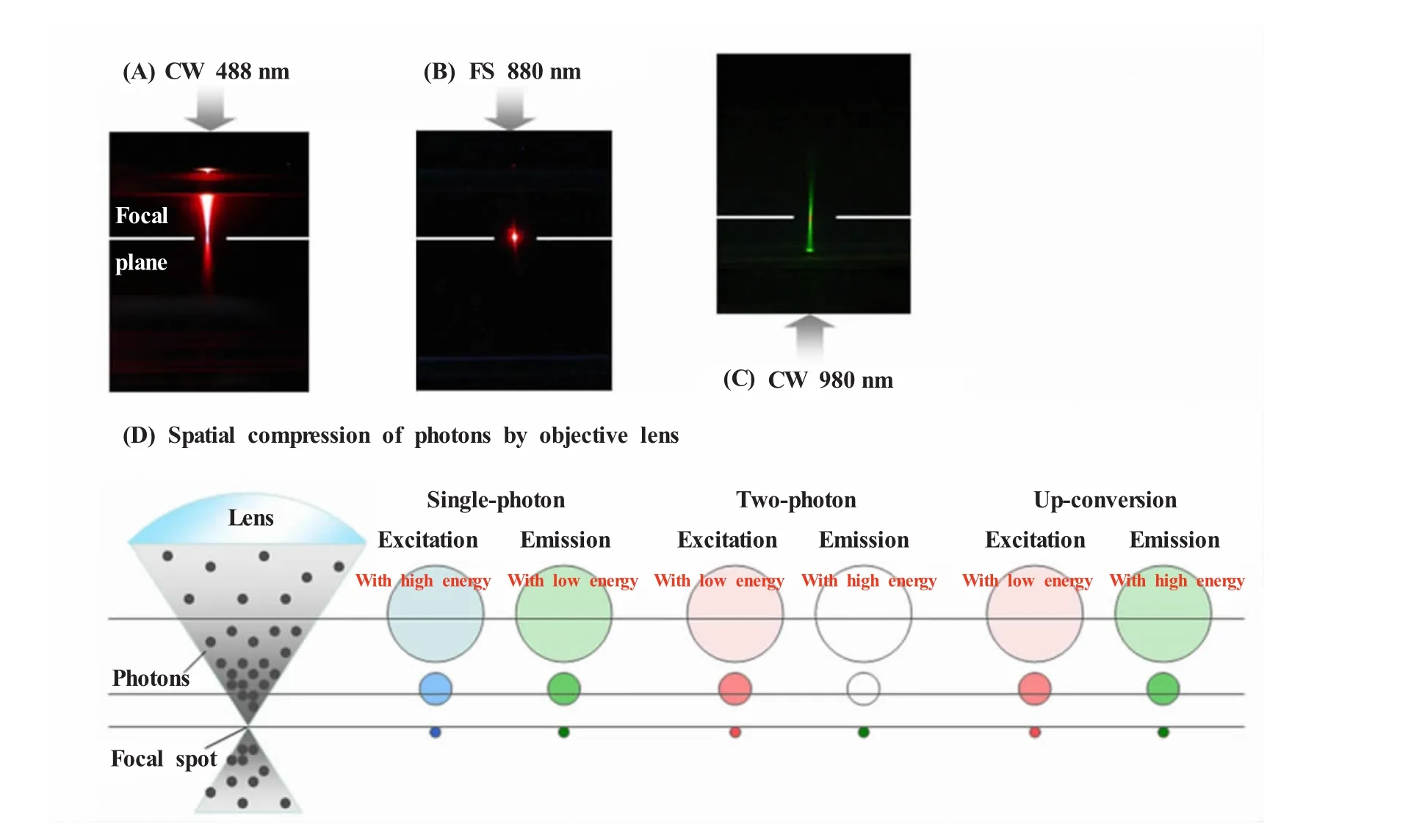
图2 有机染料的单光子(A)、双光子(B)激发发光及UCNPs的上转换发光(C)的成像原理和形式,以及激发光通过物镜聚焦之后的光子分布示意图(D)[6]焦点处的光子密度最大,随着与焦点的距离增大,光子密度迅速下降Fig.2 Principles and imaging modalities of single-photon emission(A),two-photon emission(B),and upconversion luminescence(UCL)(C),and the spatial compression of photons by the objective lens is shown in part (D)[6]The excitation photon density is greatest at the focal spot and rapidly decreases with distance from this region
2 基于上转换发光的显微成像技术
基于上述工作,2009年,我们发展了激光扫描上转换发光显微成像 (laser scanning up-conversion luminescence microscopy,LSUCLM)技术,图3给出了激光扫描上转换发光显微镜的光路图。激光器发出的980 nm连续激光,首先通过整合扫描镜,然后被物镜聚焦到样品上;从扫描点上产生的发射光被整合扫描镜反射,然后通过一个反式的激发二色分镜 (短通),以滤掉980 nm激发光;发射光随后通过共聚焦针孔和一个选择收集波长范围的狭缝光栅或带通滤光片,最后进入光电倍增管而被检测。其中,引入共聚焦针孔技术可以有效地消除非焦面的上转换发光的干扰,同时避免了焦面内散射光的影响,从而提高分辨率。由于共聚焦针孔技术具有“光学切片”能力,用LSUCLM可以对上转换发光图像进行三维重建,实现三维上转换发光成像[6]。
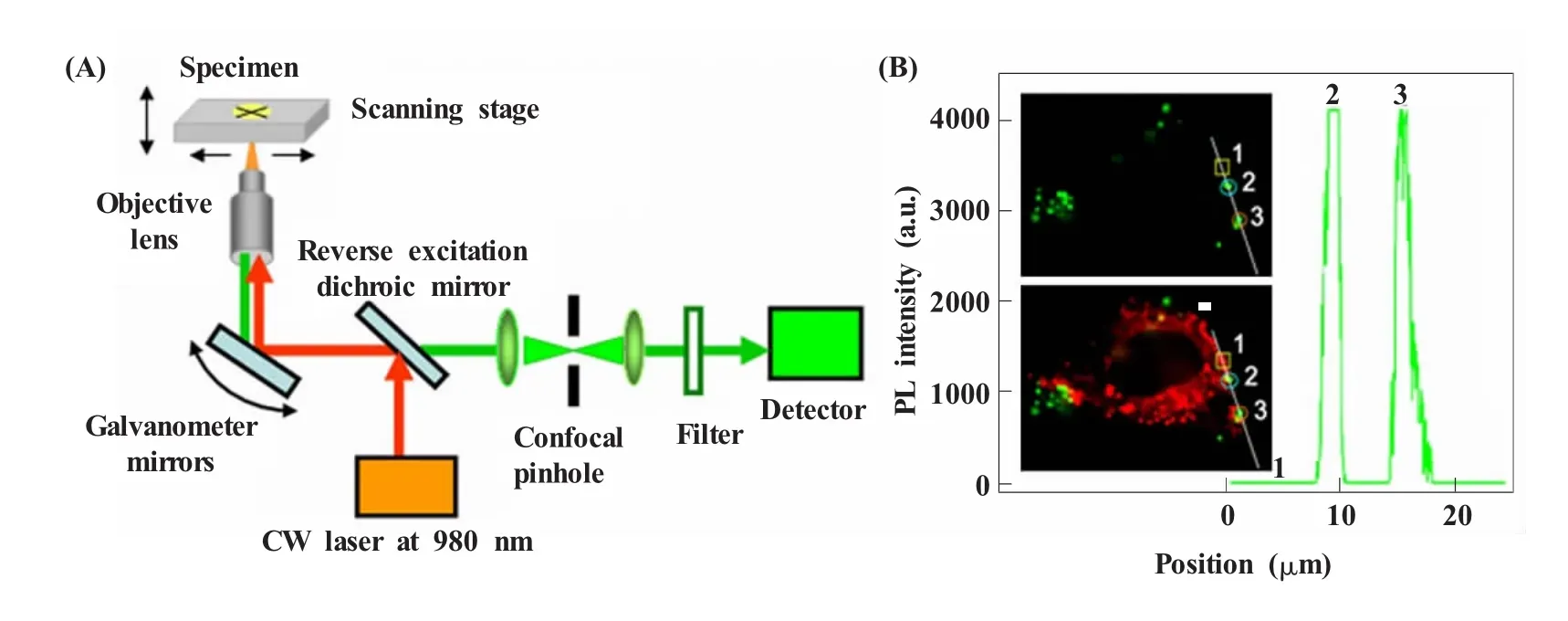
图3 (A)LSUCLM的光路图;(B)DiI与UCNPs同时标记的单个活HeLa细胞成像图像[6]Fig.3 (A)Laser path diagram of LSUCLM;(B)Image of a live HeLa cell dual-labeled with DiI and UCNPs[6]
我们还考察了LSUCLM成像的灵敏度和光漂白能力。用DiI(红色)和低浓度(50 μg/mL)的UCNPs(绿色)对活细胞进行标记 (图3)。值得注意的是,尽管UCNPs的上转换发光信号的收集范围 (500~600 nm)已经覆盖了DiI信号采集范围 (560~600 nm),单细胞的上转换发光图像上仍然没有来自DiI和自发荧光的信号。这归功于传统发光材料对980 nm光的单光子吸收很弱,且传统发光材料在连续光激发下同时吸收两个光子的几率很低。因此,以UCNPs为探针的LSUCLM成像方法,能够完全消除来自内源性荧光物质和同时标记的荧光染料的背景干扰,对所要成像的对象具有高灵敏度。我们进一步将LSUCLM用于UCNPs和有机染料 (DAPI、DiI)共染色的HeLa细胞成像,考察了UCNPs的光稳定性。如图4所示,980 nm连续激光的持续照射对UCNPs和有机染料的光漂白很弱,和普通共聚焦显微成像相比,LSUCLM的光漂白更弱[6]。
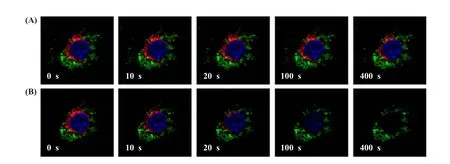
图4 LSUCLM和普通共聚焦荧光显微成像的光漂白情况比较[6]DAPI、DiI和UCNPs的发光信号分别用蓝色、红色和绿色表示。(A)使用高功率980 nm连续激光 (焦面处功率为~19 mW)激发UCNPs,同时使用低功率的405和543 nm激光 (焦面处功率分别为~15和0.8 μW)分别激发DAPI和DiI;(B)同时使用高功率的405、543和980 nm激光 (焦面处功率分别为~1.6、0.13和19 mW)Fig.4 Comparison of photobleaching in LSUCLM and conversional confocal microscopy imaging[6]The luminescence signals of DAPI and DiI are shown in blue and red,respectively,and that of UCNPs is displayed in green in the pseudocolor image.(A)Excitation was provided by a CW laser at 980 nm at a high power(~19 mW in the focal plane),whereas the excitations at 405 and 543 nm were controlled at a very low power(~15 and 0.8 μW in the focal plane for 405 and 543 nm,respectively);(B)Simultaneous excitations was provided by CW lasers at 405,543 and 980 nm with powers of approximately~1.6,0.13,and 19 mW in the focal plane,respectively
和传统的单光子、双光子荧光成像技术相比,以UCNPs为发光探针的LSUCLM由于采用了980 nm连续激光作为激发源,具有很多独特的优点:1)对有机染料和UCNPs的光漂白均非常低,可用于长期成像;2)完全消除了来自内源性荧光物质和同时标记的荧光染料的背景干扰,对所要成像的对象具有超高的选择性和灵敏度;3)使用廉价的近红外连续激光器作激发光源,有望被更多的研究者使用;4)可以和普通共聚焦荧光成像系统很好地联用,可以对UCNPs和有机荧光染料等多种探针同时标记的生物样品成像,能显示复杂的生物样品中更多的细节。由于LSUCLM具有上述优势,这一成像技术在化学、材料科学、生命科学及医学研究中具有广阔的应用前景[6]。
3 基于上转换发光的活体成像技术
荧光活体成像技术使研究人员能够直接观察活体动物体内的基因表达和细胞活动,正在被越来越广泛地应用于生物学及医学研究领域[10~12]。然而,生物样品的自发荧光会在活体成像过程中显得更加突出,对标记分子的荧光信号造成非常严重的干扰。基于上转换发光的激光扫描上转换发光显微成像技术,能够很好地解决细胞内的背景荧光干扰,从而实现在无自发荧光环境下的信号探测[6]。但动物活体成像自发荧光干扰的问题尚未解决,仍然需要进一步的研究。为此,我们搭建了一台稳态激光泵浦上转换发光小动物活体成像系统。如图5所示,半导体激光器 (中心波长为980 nm)产生的稳态激光束均通过光纤导入,沿激光束前进方向上依次放置扩束透镜和光束整形镜,在两束激光束侧下方放置样品台,小动物位于样品台上;通过发射滤光片选择一定波长范围的信号,由EMCCD接收。我们利用该系统成功地将稀土上转换发光成像技术用于小动物活体成像。在成像过程中,只需将小动物麻醉而不需要将其处死、解剖,便可在成像系统上进行观察。这充分显示了该系统能够直接对具有上转换发光性质的材料进行安全和实时的活体成像。
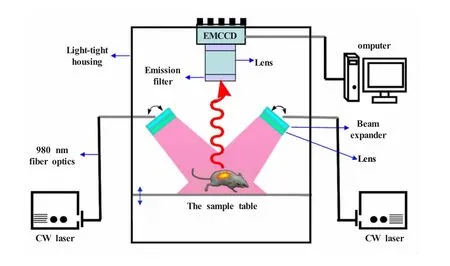
图5 基于上转换发光的活体成像系统的实验装置示意图[7]半导体激光器 (中心波长为980 nm)采用输出功率为0~5 W可调的激光器,检测器是Andor DU897 EMCCDFig.5 Diagram depicts the experimental setup for the up-conversion luminescencein vivoimaging system[7]Two external 0~5 W adjustable CW 980 nm lasers were used as the excitation sources,and an Andor DU897 EMCCD was used as the signal collector
多年来,对荧光显微成像技术的改进主要集中在减少背景荧光、降低光漂白、降低设备成本等方面。基于上转换发光的活体成像系统安装半导体激光器 (中心波长为980 nm)具有以下优点:1)该系统是一种高灵敏度的成像技术,生物样品内源性荧光物质和常用的有机荧光染料不具备上转换发光性能,这使得该系统能有效地消除生物样品自发荧光和有机荧光染料发光等背景荧光的干扰;2)该系统是一种能对生物样品进行较长时间连续观察的成像技术,由于稳态激光泵浦的上转换发光材料在稳态近红外激光激发下几乎不被光漂白,而且稳态近红外激光对有机荧光染料的光漂白很弱,对生物样品的损伤小;3)该系统价廉,易于推广。与双光子荧光探针采用昂贵的飞秒激光器相比,采用980 nm连续光半导体激光作为激发光源,价格低廉,易于普及[7]。
4 上转换发光纳米材料在肿瘤靶向成像中的应用
肿瘤细胞表面存在这样一些特异性的受体,会在肿瘤组织中过度表达,而在正常组织中不表达或低表达。借助这些受体介导的内吞作用,利用配体-受体的高度结合能力,将所结合的特异性配体靶向转运到特定的组织和细胞,以达到肿瘤组织靶向分布和显像的目的。近几年来,高质量的上转换发光纳米粒子的控制合成逐渐成熟,以及以上转换发光为基础的显微成像技术和活体成像技术的出现,使得UCNP用于肿瘤细胞的靶向成像得以实现[7,13~17]。
偶联生物分子的上转换发光纳米粒子已经运用于肿瘤跟踪等方面的活体靶向成像。精氨酸-甘氨酸-天冬氨酸 (arginine-glycine-aspartic acid,RGD)肽和叶酸 (folic acid,FA)是重要的配体,将RGD肽、叶酸连接到UCNPs上用于肿瘤细胞的成像最近被陆续报道[7,13,14,16]。基于RGD肽与αvβ3整合素受体之间的高亲和力,同时为了满足细胞﹑组织和活体成像对材料有不同穿透深度的需求,我们设计合成了具有绿光、红光和近红外光发射的稀土上转换发光纳米材料UCNPs(NaYF4∶20%Yb,1.8%Er,0.2%Tm)作为荧光探针用于RGD肽标记[7]。无胸腺的裸鼠活体成像结果显示:RGD肽标记的UCNPs具有很好的肿瘤靶向效果。组织切片的Z扫描成像数据证明,上转换成像甚至在组织深度600 μm仍没有自发荧光干扰。值得说明的是,上转换发光在活体中荧光信号的区域 (region of interest,ROI)分析显示出,上转换发光成像在肿瘤和背景之间的信噪比高至~24(图6),而这是单光子和双光子荧光成像无法达到的效果。
5 展 望
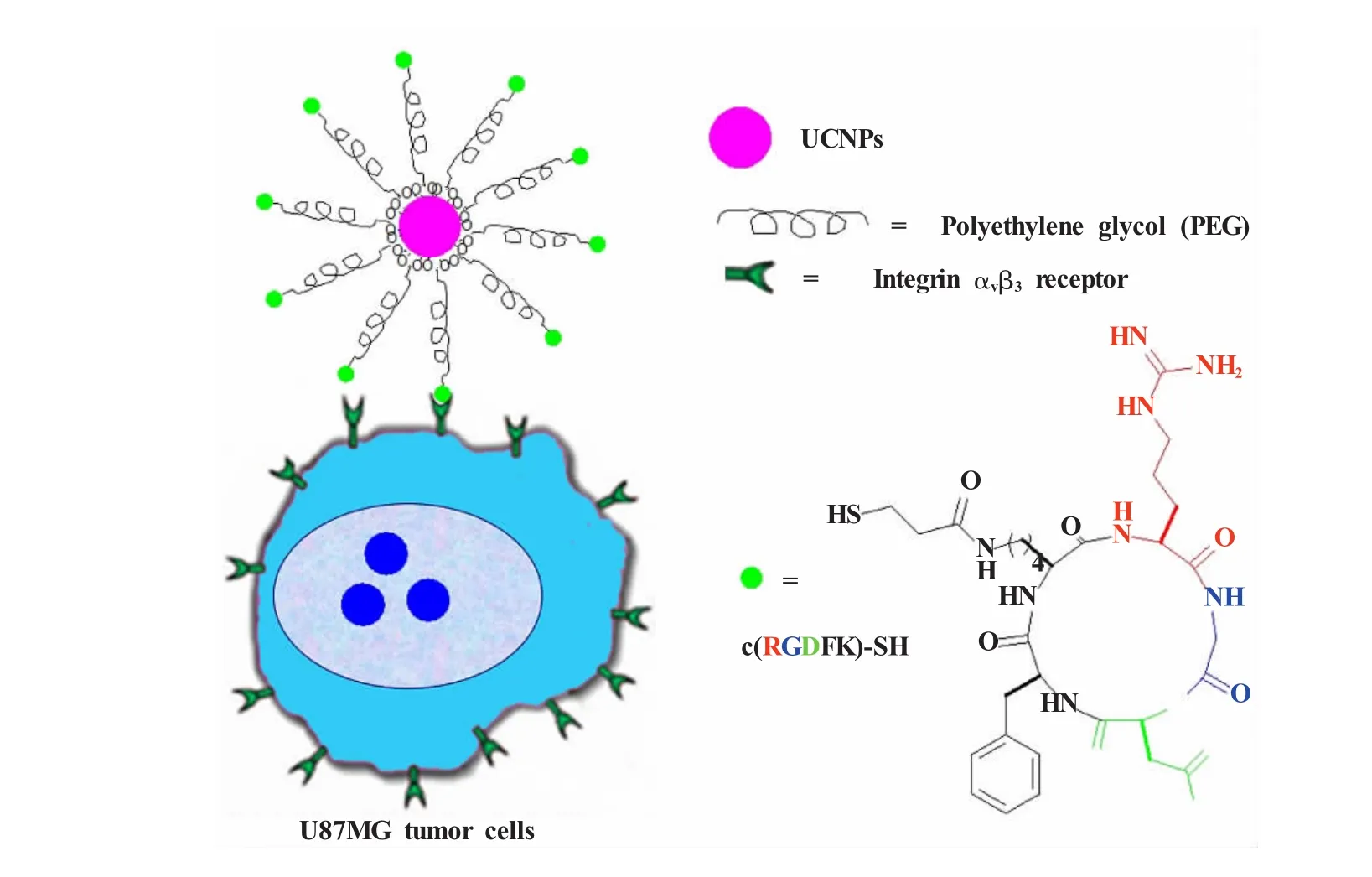
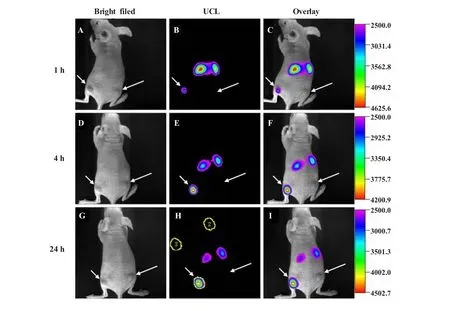
图6 经尾静脉注射UCNPs-RGD后24 h内不同时间点时裸鼠的上转换发光成像图[7]U87MG肿瘤(αvβ3整合素高表达,左后腿,用短箭头显示),MCF-7肿瘤(αvβ3整合素低表达,右后腿,用长箭头显示),(功率≈80 mW/cm2,老鼠表面温度≈21.5℃)Fig.6 Time-dependentin vivoup-conversion luminescence imaging of subcutaneous U87MG tumor(left hind leg,indicated by short arrows)and MCF-7 tumor(right hind leg,indicated by long arrows)borne by athymic nude mice after intravenous injection of UCNP-RGD over a 24 h period[7]All images were acquired under the same instrumental conditions(power≈80 mW/cm2and temperature≈21.5℃ on the surface of the mouse)
生物成像的最终目的是通过荧光标记探针实现对生物样本中单个生物分子进行超灵敏检测,欲提高生物成像的效果以及检测灵敏性,就需要寻找信号稳定、标记简便、安全无毒、检测灵敏的标记物。近年来,关于上转换发光技术在生物医学应用方面的一些研究结果表明:上转换发光纳米材料具有光稳定性好、化学稳定性高、吸收和发射带很窄、发光寿命长、潜在生物毒性小等优点;另外,采用近红外连续激光作为激发光源,具有较深的光穿透深度、对生物组织几乎无损伤、无生物背景荧光干扰等显著优势。上转换发光纳米材料的这些特征正是生物成像的理想标记物应具备的。可上转换发光纳米材料成像技术毕竟是纳米材料科学跟生物医学“联姻”的产物,与有机染料和量子点相比,其在生物检测和生物成像方面的应用研究还处于起步阶段,相关应用还停留在细胞和活体动物实验阶段,尚未进入临床应用。随着上转换发光技术的进步,可以预见,上转换发光纳米材料具有巨大的临床应用潜力,将会为肿瘤检测、基因表达、蛋白质分子检测、药物受体定位、药物筛选和药物疗效评价等方面提供有效的技术支持。
1.Stephens DJ,Allan VJ.Light microscopy techniques for live cell imaging.Science,2003,300(5616):82~86
2. Haugland RP. A guide to fluorescentprobes and labelling technologies.10th ed.Molecular Probes:Eugene,Oregon,2005[2010-04-10]. http://www.probes.com and www.invitrogen.com
3. Bruchez M,Moronne M,Gin P,Weiss S,Alivisatos AP.Semiconductor nanocrystals as fluorescent biological labels.Science,1998,281(5385):2013~2016
4. Chan WCW,Nie SM.Quantum dot bioconjugates for ultrasensitive nonisotopic detection.Science,1998,281:2016~2018
5. Auzel F.Upconversion and anti-stokes processes with f and d ions in solids.Chem Rev,2004,104(1):139~173
6.Yu MX,Li FY,Chen ZG,Hu H,Zhan C,Yang H,Huang CH.Laser scanning up-conversion luminescence microscopy for imaging cells labeled with rare-earth nanophosphors.Anal Chem,2009,81(3):930~935
7.Xiong LQ,Chen ZG,Tian QW,Cao TY,Xu CJ,Huang CH. High contrastupconversion luminescence targeted imagingin vivousing peptide-labeled nanophosphors.Anal Chem,2009,81(21):8687~8694
8.Wu SW,Han G,Milliron DJ,Aloni S,Altoe V,Talapin DV,Cohen BE,SchuckPJ. Non-blinking and photostable up-converted luminescence from single lanthanide-doped nanocrystals.Proc Natl Acad Sci USA,2009,106(12):10917~10921
9.Hu H,Yu MX,Li FY,Chen ZG,Gao X,Xiong LQ,Huang CH.Facile epoxidation strategy for producing amphiphilic up-converting rare-earth nanophosphors as biological labels.Chem Mater,2008,20(22):7003~7009
10.Hilderbrand SA,Shao FW,Salthouse C,Mahmood U,WeisslederR. Upconverting luminescentnanomaterials:application toin vivobioimaging.Chem Commun,2009,28:4188~4190
11.Kobayashi H,Kosaka N,Ogawa NM,Morgan NY,Smith PD,Murray CB,Ye XC,Collins J,Kumar GA,Bell H,Choyke PL.In vivomultiple color lymphatic imaging using upconverting nanocrystals.J Mater Chem,2009,19(36):6481~6484
12.Nyk M,Kumar R,Ohulchanskyy TY,Bergey EJ,Prasad PN.High contrastin vitroandin vivophotoluminescence bioimaging using near infrared to near infrared up-conversion in Tm3+and Yb3+doped fluoride nanophosphors.Nano Lett,2008,8(11):3834~3838
13.Xiong LQ,Chen ZG,Yu MX,Li FY,Liu C,Huang CH.Synthesis,characterization,and in vivo targeted imaging ofamine-functionalized rare-earth up-converting nanophosphors.Biomaterials,2009,30(29):5592~5600
14.Hu H,Xiong LQ,Zhou J,Li FY,Cao TY,Huang CH.Multimodal-luminescence core-shell nanocomposites for targeted imaging of tumor cells.Chem Eur J,2009,15(14):3577~3584
15.Zhou J,Sun Y,Du X,Xiong LQ,Hu H,Li FY.Dual-modalityin vivoimaging using rare-earth nanocrystals with near-infrared to near-infrared(NIR-to-NIR)upconversion luminescence and magnetic resonance properties.Biomaterials,2010,31(12):3287~3295
16.Zako T,Nagata H,Terada N,Utsumi A,Sakono M,Yohda M,Ueda H,Soga K,Maeda M. Cyclic RGD peptide-labeled upconversion nanophosphors for tumor cell-targetedimaging. Biochem BiophysResCommun,2009,381(1):54~58
17.Wang M,Mi CC,Wang WX,Liu CH,Wu YF,Xu ZR,Mao CB,Xu SK. Immunolabeling and NIR-excited fluorescent imaging of HeLa cells by using NaYF4:Yb,Er upconversion nanoparticles. ACS Nano,2009,3(6):1580~1586
Upconversion Luminescence Imaging Techniques and Their Application in Targeted Bioimaging
CHEN Min,XIONG Liqin,LI Fuyou
Department of Chemistry&Advanced Materials Laboratory,Shanghai 200433,China
Apr 21,2010 Accepted:Jul 16,2010
LI Fuyou,Tel:+86(21)55664185,E-mail:fyli@fudan.edu.cn
Upconversion luminescence involves conversion of two or more low energy photons,usually near infrared(typically 980 nm),to higher energy visible emission through multiple photon absorption or energy transfer.Compared with the traditional ultraviolet excitation,upconversion luminescence exhibits deep tissue penetration depth,minimalphotodamage to biologicalsamples and non-autofluorescence ofbiological samples.Therefore,upconversion luminescence has great application prospects in biological imaging.Herein,on basis ofthe unique upconversion luminescence ofrare earth materials,the novelupconversion luminescence imaging technologies including upconversion luminescence microscopy and upconversion luminescence whole-body imaging have been developed for application in targeted bioimagingin vitroandin vivo.
Upconversion luminescence;Rare-earth nanomaterial;Bioimaging;Target
2010-04-21;接受日期:2010-07-16
李富友,电话:(021)55664185,E-mail:fyli@fudan.edu.cn
Q334

