用活体小动物SPECT/CT影像系统检测纳米材料和药物在体内的生物效应
马会利,王秩秋,钱 锋,梁兴杰
1.国家纳米科学中心纳米材料生物医学效应和纳米安全中科院重点实验室,北京100190;
2.Laboratory of Molecular Imaging,Department of Radiology,Howard University,Washington,DC 20060,USA;
3.西门子(中国)有限公司,医疗业务领域,分子影像产品部,上海 201318
用活体小动物SPECT/CT影像系统检测纳米材料和药物在体内的生物效应
马会利1,王秩秋2,钱 锋3,梁兴杰1
1.国家纳米科学中心纳米材料生物医学效应和纳米安全中科院重点实验室,北京100190;
2.Laboratory of Molecular Imaging,Department of Radiology,Howard University,Washington,DC 20060,USA;
3.西门子(中国)有限公司,医疗业务领域,分子影像产品部,上海 201318
研究疾病在小动物模型体内的动态生物过程促进了高分辨率影像学方法的发展。这些方法能够阐明疾病或肿瘤在发生和发展过程中的分子相互作用,评价药物和显影剂的生物效应,并可动态连续监测药物在同一个体的治疗效果。单光子发射型计算机断层成像仪(single photon emission computed tomography,SPECT)在这些应用中具有很多优势。应用SPECT对标记核素发射的γ-射线信号探测分析,可获得病变组织或药物的三维空间分布信息。SPECT联合X-射线诊断设备CT(computed tomography)组成的SPECT/CT系统可辅助界定生物过程的解剖学背景,提高SPECT数据的定位准确度。文章概述了小动物SPECT/CT的特点、成像原理、核素的选择,及其在纳米材料和药物(如脂质体、碳纳米管、纳米粒包括聚合物、胶束和量子点等)方面的应用和研究进展。
SPECT/CT;小动物成像;药物载体;纳米材料
0 引 言
上世纪90年代,分子生物学在心脏疾病、神经系统疾病、肿瘤,以及其他病理过程研究中得到了广泛的应用。但是,由于动物体内检测模型的复杂程度远高于体外模型测定系统,生物分子或化学药物等在体外的研究不一定能真实体现其在活体动物体内的作用机制,而很少有疾病可直接在患者体内进行研究。因此,小动物模型成为分子水平的基础研究与疾病临床诊断和治疗之间的重要桥梁,同时也是体外研究过渡到体内研究的重要方法之一。多年以来,小动物模型的研究主要依赖于组织切片、显微镜观察、放射自显影等,这些研究方法不能对模型动物进行动态实时观测,而且,多数检测手段都需要将动物处理后才能进行,得到的实验结果并不一定是活体动物体内的真实结果。目前,分子影像学,例如单光子发射型计算机断层成像(single photon emission computed tomography,SPECT)和正电子发射断层成像(positron emission tomography,PET)技术,可研究疾病或肿瘤在单个活体动物中的动态生物过程,而且SPECT和PET都已经临床应用于患者的体内成像[1]。SPECT联合X-射线诊断设备CT(computed tomography)组成的SPECT/CT系统可辅助界定生物过程的解剖学背景。近年来,小动物SPECT/CT成像系统已经成功应用于基础研究和转化医学上(translational medicine)。SPECT/CT在临床上主要用来监测心肌灌注,以及对肿瘤、脑疾病等的诊断和治疗[2]。
与其他成像系统相比,SPECT/CT成像的主要优点有:1)在活体生物体内研究并可融合定量分析、靶向性评价、高灵敏度(可达到10-10~10-11mol/L水平)、非侵入性等特点,可在接近生理或病理状态下得到较全面的数据,从而使研究结果更接近于实际情况。2)可选择的放射性核素(radionuclide)范围广泛,易获得,且标记方法较简单;而PET所用的同位素药物需用加速器产生,合成方法复杂,干扰因素多。3)可同时对多种放射性核素成像,因此可同时研究多种分子机制或生物过程。4)成像机理为利用仪器收集探测动物体内放射性核素衰变发射的γ-射线信号,对信号进行分析成像。γ-射线对组织的穿透能力比较强,基本不受组织深度的影响。许多疾病的病变部位都是在动物体内被多层组织覆盖、包裹,不易被其他检测手段(例如超声波或光学方法)检测到,SPECT/CT对研究疾病在动物模型中(例如转基因动物模型)的发病机制和治疗具有较大优势。5)与小动物PET和核磁共振断层扫描MRI(magnetic resonance imaging)成像系统相比,SPECT/CT系统造价低,仪器体积小,结构紧凑;缺点是空间分辨率(一般大于1 mm)低于MRI[1,2]。
1 SPECT/CT的成像原理和显像剂
SPECT成像是基于利用γ-摄相机检测注入到体内的放射性核素自身衰变产生的γ-射线进行分析来获得三维图像,其成像原理如图1所示[3]。SPECT主要由探头、电子学线路、计算机影像处理系统和显示记录装置4部分组成。探头由准直器、晶体、光导、光电倍增管、前置放大器和计算电路等组成。电子学线路包括光电倍增管的高压电源、线性放大器和脉冲高度分析器等。计算机影像处理系统由硬件和软件两个部分组成。硬件是计算机影像处理系统本身的各个部分,软件是各种程序的总称。硬件和软件的组合才构成了完整的计算机影像处理系统。SPECT的显示记录装置种类很多,常用的方法有3种:1)用γ-相机直接拍摄示波器荧光屏上的影像,不需冲洗胶片,10~15 s即可获得影像的正片;2)用多幅γ-相机记录影像,这种γ-相机使用单面CT胶片,影像大而清晰,是目前使用较多的显示记录方法;3)激光打印或热升华打印记录。
该成像系统可定量地分析放射性核素标记的分子、药物、材料在心肌、肿瘤、神经系统等疾病部位分布的动态过程。SPECT常与CT结合起来组成SPECT/CT系统,CT主要用来提供准确的解剖学定位信息[2]。在小动物成像系统(microSPECT)中,常用的小动物包括小鼠和大鼠。目前常用的小动物SPECT影像系统主要有GE公司生产的Explore speCZT/CT成像系统、西门子公司生产的可用于临床前活体动物研究的InveonTM系列产品,以及Bioscan公司生产的NanoSPECT/CT®影像系统等。
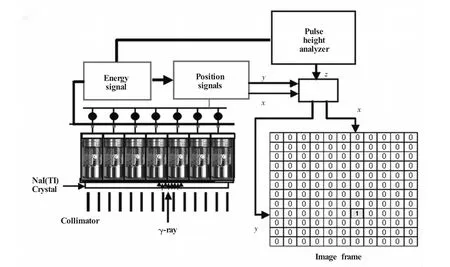
图1 SPECT工作原理图[3]在一个传统的闪烁相机中,光子从闪烁晶体出来后,经一系列的光电倍增管采集后,产生一个能量信号(即一对x,y轴坐标定位信号)。如果信号事件落在脉冲高度分析仪的能量窗内,这个图像信号矩阵元就可添加到相关的x,y轴坐标中Fig.1 Schematic diagram of SPECT[3]In a conventional scintillation camera,light from the scintillation is sampled by an array of photomultipler tubes,which generate an energy signal as well as an x,y-coordinate pair.If the event falls within the pulse-height analyzer energy window,an image matrix element is incremented at the associated x,y-location
利用SPECT进行成像时,需要对药物或材料进行放射性核素标记。常用的核素包括锝(99mTc,Technetium,T1/2:6.0 h,140.5 keV)、碘(123I,Iodine-123,T1/2:13.2 h,159 keV;131I,Iodine-131,T1/2:8.0 d,364 keV)、铟(111In,Indium-111,T1/2:2.8 d,171.3/245 keV)、镓(67Ga,Gallium-67,T1/2:78.3 h,93.3/184.6/300.2 keV)、铼(Rhenium)。可同时发射 β-射线用于放射性治疗及 γ-射线用于成像的有186Re(Rhenium-186,T1/2:90.6 h,γ:137 keV,β:1.07 Mev)和188Re(Rhenium-188,T1/2:16.9 h,β:2.12 Mev)。这些核素可使用交联剂通过配位键与药物或材料连接,其中99mTc是成像研究中最常用的放射性核素。以上放射性核素均可保证有效的成像和安全的生物照射剂量[4]。
PET/CT是将在蛋白质、DNA、RNA水平进行分子影像研究的PET,和反映人体组织、脏器高分辨率解剖结构的CT两者有机融合在一起的功能分子影像设备,主要由加速器生产正电子放射性核素、正电子放射性药物快速合成、PET显像及计算机重建技术3部分组成。SPECT/CT与PET/CT在成像原理和应用上的区别是:1)PET使用正电子发射类标记药物,核素有回旋加速器生产的18F、11C、15O、13N等。SPECT使用单光子发射类药物,核素有发生器或反应堆,以及回旋加速器生产的99mTc、131I、67Ga等。2)PET使用符合探测方式,全环或半环旋转晶体探测成对511 keV光子;SPECT使用准直器定位探测,可探测各种不同能量的单光子。3)PET和SPECT主要应用于肿瘤、心脏和神经学,而SPECT还具有其他功能,例如肾、胆、甲状腺、胃、骨头病、内出血等的显像。目前PET在全身肿瘤检查中用得多,而SPECT在局部病变检查中用得多。
2 SPECT/CT成像系统在纳米材料和药物研究中的应用
SPECT/CT成像系统具有功能图像和解剖图像同机融合的特点,利用新型动物模型和成像方法可获得活体动物更为准确的生理学和病理学信息,是纳米材料和药物临床前研究的重要手段之一。利用该系统可评价核素标记的药物、材料等在活体动物体内的代谢动力学和生物分布,研究药物或材料的分子靶向和作用机制,监测和追踪药物或材料的靶向效果,评价药物的治疗效果等,以及评价药物或材料的毒性和安全性。
2.1 SPECT/CT成像系统在脂质体研究中的应用
脂质体是由双亲性的磷脂组成的双分子层膜状球体,内部的亲水相可用于包载亲水性药物,中间的磷脂双分子层中的疏水相可用于包载疏水性药物,整个外部呈亲水性,在水溶液中呈混悬状态[5]。常用一些小分子物质,例如去铁胺(deferoxamine,DF)和次氮基三乙酸(nitrilotriacetic acid,NTA),与核素连接后被包裹在脂质体的内水相,或者包裹到脂膜双分子层中。在临床上,利用SPECT成像技术可评价111In标记的二乙烯三胺五乙酸(diethylenetriaminepentaacetic acid,DTPA)脂质体在肿瘤患者体内的血浆动力学和组织分布[6]。
99mTc标记的六甲基丙二基胺肟(hexamethyl-propylene-amineoxime,HMPAO)常用来标记脂质体。Mirahmadi等[7]考察了谷胱甘肽(glutathione,GSH)、脂材浓度,以及脂材不同组成成分对99mTc-HMPAO脂质体标记效率和稳定性的影响。研究结果表明,GSH的浓度从5 mmol/L增加到200 mmol/L,标记效率从4.16%增加到69.81%;而脂材浓度的变化对标记效率影响不大。
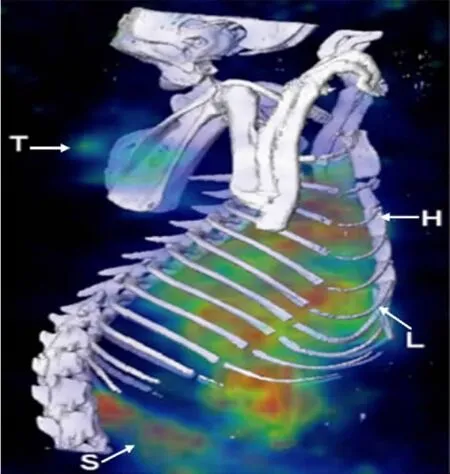
图2 注射[186Re]Doxil 20 h后的SPECT/CT图像[8]三维SPECT图像和在骨窗显示的CT等值面的共定位表明,186Re-Doxil聚集在肿瘤(T)、肝脏(L)和脾脏(S),并且循环经过心脏(H)Fig.2 Micro-SPECT/CT images acquired at 20 h post-administration of[186Re]Doxilusing a MPH collimator[8]A three-dimensional SPECT image of186Re-Doxil overlaid with CT isosurface displayed in the bone window shows accumulation in the tumor(T),liver(L),spleen (S) and circulation through the heart(H)
Doxil®是已用于临床包载抗肿瘤药物阿霉素的脂质体。Soundararajan等[8]将放射性核素186Re标记的Doxil脂质体和PEG化的阿霉素脂质体,分别静脉注射至移植头颈癌的裸鼠体内,进行SPECT/CT扫描。图2显示了注射186Re标记的Doxil(555 MBq/kg)20 h后的SPECT/CT图像,从图中可以看出,肿瘤、肝脏、脾脏等均有放射性聚集。186Re标记的Doxil在肿瘤部位的聚集量是PEG脂质体的20倍,并且186Re标记的Doxil显示较慢的血液清除速率。Chen等[9~11]利用188Re标记的阿霉素脂质体研究其血液动力学及对小鼠C26结肠癌的抑制效果。脂质体的188Re标记率为82.3%±4.5%,并显示较好的标记稳定性。因此,SPECT/CT系统可有效地评估188Re标记阿霉素脂质体在C26小鼠肿瘤的靶向性、组织分布、小鼠存活率等。
Wang等[12]建立了裸鼠移植性头颈部鳞状细胞癌模型,然后通过手术切除部分肿瘤,保留肿瘤边缘。向瘤内注射大小约100 nm的186Re标记的中性或阳离子脂质体,使用SPECT/CT成像系统检测了脂质体在肿瘤内的分布。与未进行放射性标记的脂质体相比,186Re标记的中性和阳离子脂质体均显著抑制了肿瘤生长,具有较好的放疗效果[13]。该研究小组又使用99mTc标记的不同大小(100 nm,1 μm,2 μm)和电荷(中性和阳离子)的脂质体来评估手术后的边缘头颈部鳞状细胞癌。SPECT扫描结果显示,阳离子脂质体在肿瘤内具有较高的滞留率,而中性脂质体主要滞留在瘤旁。Bao等[14]利用SPECT/CT成像系统考察了99mTc标记的脂质体在裸鼠的头颈鳞片细胞癌瘤内的代谢动力学和生物分布,结果显示,刚注射后,约47.4%的脂质体聚集在肿瘤部位;20 h后,仍有约39.2%的脂质体滞留在肿瘤。Dagar等[15]将99mTc-HMPAO标记连接血管活性肠肽(vasoactive intestinal peptide,VIP)的PEG脂质体,大鼠SPECT扫描结果表明,连有多肽的脂质体可显著聚集在乳腺癌肿瘤中,且具有靶向性。Zavaleta等[16]用99mTc-HMPAO对载生物素的脂质体进行标记,然后经腹腔注射到荷卵巢癌大鼠体内。SPECT成像表明,脂质体主要聚集在腹腔和淋巴系统,这两个部位对脂质体有显著的吞噬现象。
结肠靶向给药系统可提高蛋白多肽经口服的生物利用度。Xing等[17]设计了一种藻酸钙微球包载多肽脂质体(99mTc标记),运用SPECT评价了该微球在胃肠道的精确定位和药物的释放。
2.2 SPECT/CT成像系统在聚合物研究方面的应用
Merkel等[18]利用SPECT成像系统成功地评价了采用双放射性核素(111In和99mTc)标记siRNA在Balb/c小鼠体内的动力学和分布情况。首先通过2-(4-Isothiocyanatobenzyl)diethylenetriaminepentaacetic acid(p-SCN-Bn-DTPA)将111In标记到 siRNA上,然后此siRNA与高分子聚合物聚乙烯亚胺(polyethylenimine,PEI,25 kDa)通过静电相互作用形成纳米粒。运用SPECT考察了游离siRNA和siRNA纳米粒的组织分布情况。小鼠在做SPECT扫描前4 h注射99mTc标记的二碳磷酸盐(4 mol/LBq),以同时显示骨骼的解剖学位置。该研究小组又使用SPECT/CT系统检测了标记的纳米粒子在活体动物体内的动力学和组织分布,用111In-DTPA标记siRNA,此siRNA与高分子聚合物PEI25kDa-PEG2kDa复合形成纳米粒。用99mTc标记大聚结白蛋白(macroagglomerated albumin,MAA)以显示活体动物的气管。研究结果表明:该纳米粒主要聚集在肺部,且通过肾脏消除[19];siRNA与PEI形成的纳米粒并没有显示从肺部到肝脏的二次分布;纳米粒的稳定性对其动力学和组织分布有很大影响,SPECT可动态观察到在血液循环中稳定的纳米粒可在肝脏中解离[20]。
Boswell等[21]成功合成了一种99mTc-DTPA标记的含叶酸的树状分子聚酰胺-胺(dendrimer poly(amido)-amine,PAMAM-G5)共聚物,此共聚物具有较好的体外和体内稳定性。SPECT扫描显示,该共聚物可靶向至小鼠的KB肿瘤细胞。将111In标记至RGD环肽(arginine-glycine-aspartate,RGD)-PAMAM,SPECT扫描结果表明,111In-RGD-PAMAM主要被肾脏、肝脏、脾脏摄取。Parrott等[22]将Tc和Re标记到树状分子(G5、G6、G7)的核心部位。在健康大鼠体内的组织分布研究表明,树状分子(G5、G6、G7)注射15 min后即迅速从血液中经过肾脏清除,在肾脏、心脏、肺的清除半衰期小于150 s,基本上无非特异性的滞留。从SPECT/CT图像得到的组织分布定量结果,与取出器官后测定的放射性而得到的组织分布结果一致。
2.3 SPECT/CT成像系统在纳米粒研究方面的应用
Harivardhan Reddy等[23]利用小鼠Dalton淋巴癌模型研究了给药途径对依托泊苷(etoposide)固态脂质纳米粒分布的影响。将99mTc标记到药物或纳米粒的棕榈酸甘油酯上,均具有较高的标记效率和体外稳定性。SPECT扫描结果表明,皮下注射可降低纳米粒在所有组织的分布,纳米粒在注射部位会滞留较长时间,纳米粒在肿瘤部位的浓度要比静脉注射途径高59倍,比腹腔注射高8倍。腹腔注射该纳米粒后,纳米粒在脑部的分布显著增高。静脉注射后,纳米粒在网状内皮系统(reticuloendothelial system,RES)的分布降低。
Hoang等[24]将111In通过p-SCN-Bn-DTPA连接到聚乙二醇-聚己内酯(polyethylen glycol-polycaprolactone,PEG-PCL)嵌段共聚物上,形成111In-DTPA-PEG-b-PCL胶束。运用SPECT/CT成像系统考察了胶束和单纯的聚合物在正常小鼠体内的药物代谢动力学和组织分布情况,及胶束在荷MDA-MB-231肿瘤Balb/c小鼠体内的聚集情况。研究结果表明,胶束具有长循环性质,主要聚集在脾脏 〔(22±5%)ID/g〕、肝脏 〔(13±3%)ID/g〕及肿瘤部位 〔(9%±2%)ID/g〕。
Yuan等[25]研究了载雷帕霉素(rapamycin)的壳聚糖-聚乳酸纳米粒(chitosan-PLA)治疗角膜移植引起的免疫抑制反应,运用SPECT/CT成像系统观察纳米粒在兔角膜的分布。给纳米粒后,移植角膜的平均存活时间为(27.2±1.03)d,在实验结束时,仍有50%的移植角膜存活。Chen等[26]通过简单的离子交联法制备了壳聚糖和肝素(heparin)纳米粒。因为壳聚糖显著过量,肝素的包载率近100%。口服该纳米粒后,其绝对生物利用度为20.5%。图3显示了口服99mTc标记的壳聚糖纳米粒在大鼠体内实时动态分布的SPECT/CT影像,图像表明,随着时间的延长,纳米粒依次从食道、胃、小肠到大肠,纳米粒的胃排空时间约为8 h,24 h后,大部分纳米粒分布在结肠。在其它各个内脏中没有发现显著的放射性信号,表明壳聚糖很少进入血液循环。
超顺磁性氧化铁纳米粒是一种核磁共振(MRI)造影剂。Gorantla等[27]将骨髓巨噬细胞作为超顺磁性氧化铁纳米粒(Feridex)的载体,并用MRI来评价细胞的定位,另外,将111In-羟基喹啉标记骨髓巨噬细胞,以用SPECT图像来追踪细胞的分布。研究结果表明,7 h后,86%的细胞主要聚集在肺部。1、3、5、7 d后,少于10%的细胞聚集在肺部,74%~81%在肝脏,13%~18%在脾脏。Cheon等[28]制备了一种具有MRI和SPECT双成像功能的纳米粒用于肿瘤显像。以氧化铁为基础的纳米粒(magnetism engineering iron oxide,MEIO)主要用于MRI成像,111In标记于纳米粒表面以用于SPECT成像。SPECT/CT成像系统还可考察99mTc标记的超顺磁性氧化铁纳米粒在健康大鼠体内的组织分布。该纳米粒具有核-壳结构,核是氧化铁纳米粒,壳是疏水性的PLGA和阳性的壳聚糖。静脉注射后,氧化铁纳米粒迅速聚集在肝脏,肺脏、脾脏和膀胱也显示相对较高的信号强度[29]。DeNardo等[30,31]将111In-DOTA标记的嵌合单克隆抗体(ChL6)连接至纳米粒(20 nm)表面的PEG,一个纳米粒表面可以连接1~2个抗体。图4显示了该功能化氧化铁纳米粒的结构示意图。运用SPECT评价了此纳米粒在荷人乳腺癌(HBT 3477)裸鼠体内的血液动力学、肿瘤摄取,以及在外加磁场下的抗肿瘤效果。研究结果表明,该纳米粒具有较长的循环时间,SPECT定量结果表明,14%的给药纳米粒在注射48 h后被肿瘤摄取,外加磁场24 h后可导致肿瘤坏死。
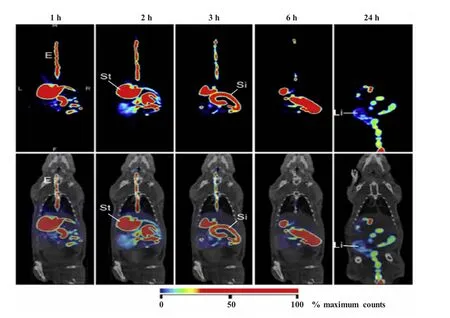
图3 口服99mTc标记的壳聚糖纳米粒在大鼠体内的生物分布图像[26]上:单纯SPECT图像;下:SPECT/CT叠加图像。E:食道; St:胃;Si:小肠;Li:大肠Fig.3 Biodistribution of99mTc-labeled chitosan nanoparticle observed in a rat model after oral intake of test nanoparticles[26]Upper panels:The SPECT images only;Lower panels:The SPECT/CT superimposed images.E:Esophagus;St:Stomach;Si:Small intestine;Li:Large intestine
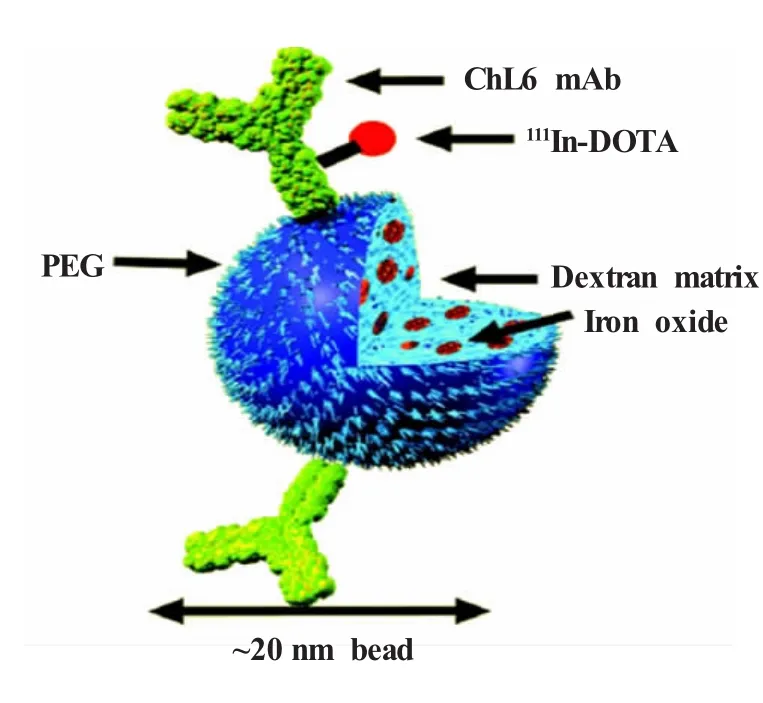
图4111In标记的ChL6抗体连接至由右旋糖酐组成的纳米粒(20 nm)[31]该纳米粒表面有聚乙二醇(PEG)修饰,内部包裹有氧化铁纳米粒Fig.4111In-labeled ChL6 antibody was conjugated to a 20 nm dextran bead[31]It was coated with polyethylene glycol and impregnated with iron oxide nanoparticle
125mTe的半衰期和衰变性质与125I非常类似。Kennel等[32]以125mTe标记CdTe-ZnS纳米粒,并将单克隆抗体MAb 201B(可结合肺血管上表达的血栓调节蛋白)连接至该纳米粒。图5显示了静脉注射连有抗体的靶向纳米粒和非靶向纳米粒的SPECT/CT影像图,图像表明,注射1 h后,该MAb-Cd125mTe-ZnS纳米粒主要聚集在肺部,少量分布在肝脏和脾脏。而没有连接抗体的纳米粒不会聚集在肺部。Bhushan等[33]合成了一种新型的多功能诊断试剂Pam-Tc/Re-800,此试剂不仅可利用近红外光(near-infra red,NIR)光学成像进行检测,还可同时使用SPECT进行成像。以乳腺癌微粒钙化的大鼠作为肿瘤模型,评价了Pam-Tc-800静脉注射后的体内动力学。注射4 h后,同时利用SPECT和NIR对肿瘤进行成像。SPECT研究结果表明,99mTc-二磷酸盐与合成的Pam-Tc-800具有相似的血液清除率,Pam-Tc-800在骨骼和肿瘤中的蓄积量较高。
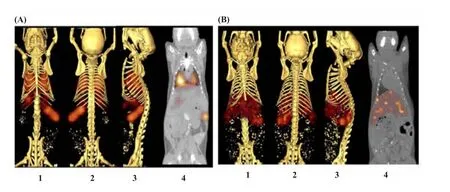
图5 静脉注射Cd125mTe纳米粒 (NP)一天后的小鼠三维SPECT/CT成像扫描图[32](A)MAb 201B靶向纳米粒;(B)对照MAb 33纳米粒。1,2,3图显示从不同方位采集的SPECT数据,4图是在腹侧方位SPECT和CT图像的叠加图Fig.5 Three-dimensionaltomographicimagesofSPECT/CT scansfrom mice injected with Cd125mTe nanoparticle(NP)one day after injection[32](A)MAb 201B targeted NP;(B)Control MAb 33 NP.Three views with different orientations are shown with color representing the SPECT data.The fourth image in each panel is superimposed SPECT and CT data ventral view
Hu等[34]运用SPECT成像研究了整合素αvβ3在新生血管的高表达,结果表明,肿瘤部位对125I标记的环RGD多肽具有高吞噬率。整合素靶向的111In标记的全氟化碳(perfluorocarbon)纳米粒可用来检测新西兰大白兔移植肿瘤的肿瘤血管新生。注射18 h后,接受111In标记的整合素纳米粒的平均肿瘤放射性比非靶向的对照高出约4倍。组织分布结果表明,脾脏是清除该纳米粒的主要器官。
2.4 SPECT/CT成像系统在碳纳米管研究方面的应用
Wu等[35]将多壁碳纳米管(multiwall carbon nanotube,MWNT)通过共价键与喜树碱衍生物(10-hydroxycamptothecin)连接,99mTc通过DTPA与碳纳米管的一部分氨基共价相连。荷肝癌(H22)肿瘤的小鼠体内SPECT扫描结果表明,静脉注射给药后,碳纳米管迅速分布在肝脏、脾脏等多个组织器官中;注射2~4 h后,肿瘤部位的信号强度增加;4~22 h之间,信号强度基本保持不变。Singh等[36]将111In通过DTPA连接到碳纳米管上,体内SPECT影像研究表明,碳纳米管进入血液循环5 min后通过肾小球过滤系统进入膀胱。水溶性单壁碳纳米管(SWNT)静脉注射后,不会被网状内皮系统(如肝脏或脾脏)吞噬,而是通过肾脏代谢迅速从血液系统中清除。
3 总结与展望
本文就活体小动物SPECT/CT影像系统在药物载体,包括脂质体、纳米粒、胶束、聚合物、量子点、碳纳米管的应用,较为详细地综述了国际上该领域的最新研究进展。从中可以看出,SPECT在检测药物和纳米材料方面应用的最大优势在于:SPECT所用的放射性元素与药物或纳米材料标记较容易,可供选择的标记元素也较多;在活体动物体内(同一动物)可动态地监测药物或纳米材料的代谢行为和组织分布(靶向研究);SPECT可定量分析(准确性高)药物或纳米材料在体内的代谢与生物分布;实时动态监测药物或纳米材料在比较复杂的动物模型(例如转基因或原发性动物模型)中的治疗效果和安全性。尽管SPECT的应用会越来越广泛,但是还有些问题有待解决。其一,SPECT/CT成像系统在硬件上还需要进一步提高,即需要提高SPECT探测器的灵敏度和空间分辨率,提高信噪比,完善影像的重建和定量分析功能。其二,使用SPECT时必须对追踪的药物和材料进行放射性核素标记,如何提高核素的标记效率和其在体内的稳定性是一个关键问题。综上所述,SPECT/CT成像系统自身的特点决定了其在纳米材料和药物方面的应用会越来越广泛,SPECT/CT成像系统还可与其他成像系统(MRI,NIR)联合起来使用,例如放射性核素标记氧化铁纳米粒或碳纳米管可实现双功能成像,可更为准确地提供疾病发生和发展过程中的生物效应信息。另外,对药物或者材料标记具有放射性治疗的同位素,不仅可利用成像追踪监测其体内过程,同时还可起到放疗与药物协同治疗疾病的作用。进行的放射性标记,不仅可以进行SPECT/CT成像,同时可进行放疗,以提高药物的抗肿瘤效果。
致谢 感谢北京工业大学生命科学与生物工程学院王存新教授对本文的修改和建议,同时也对国家纳米科学中心中国科学院纳米材料的生物效应和安全性重点实验室王东亮博士对文章撰写过程中给予的帮助表示感谢。
1.Danthi SN,Pandit SD,Li KC.A primer on molecular biology for imagers:VII.Molecular imaging probes.Acad Radiol,2004,11(9):1047~1054
2.Franc BL,Acton PD,Mari C,Hasegawa BH.Small-animal SPECT andSPECT/CT:Importanttoolsforpreclinical investigation.J Nucl Med,2008,49(10):1651~1663
3.Madsen MT.Recent advances in SPECT imaging.J Nucl Med,2007,48(4):661~673
4.Hamoudeh M,Kamleh MA,Diab R,Fessi H.Radionuclides delivery systems for nuclear imaging and radiotherapy of cancer.Adv Drug Deliv Rev,2008,60(12):1329~1346
5.Papahadjopoulos D,Allen TM,Gabizon A,Mayhew E,Matthay K,Huang SK,Lee KD,Woodle MC,Lasic DD,Redemann C.Sterically stabilized liposomes:Improvements in pharmacokinetics and antitumor therapeutic efficacy.Proc Natl Acad Sci USA,1991,88(24):11460~11464
6.Harrington KJ,Mohammadtaghi S,Uster PS,Glass D,Peters AM,Vile RG,Stewart JS.Effective targeting of solid tumors in patients with locally advanced cancers by radiolabeled pegylated liposomes.Clin Cancer Res,2001,7(2):243~254
7.Mirahmadi N,Babaei MH,Vali AM,Daha FJ,Kobarfard F,Dadashzadeh S.99mTc-HMPAO-labeled liposomes: An investigation into the effects of some formulation factors on labeling efficiency and in vitro stability. Nucl Med Biol,2008,35(3):387~392
8.Soundararajan A,Bao A,Phillips WT,Perez R 3rd,Goins BA.[(186)Re]Liposomal doxorubicin(Doxil):In vitrostability,pharmacokinetics,imaging and biodistribution in a head and neck squamous cell carcinoma xenograft model.Nucl Med Biol,2009,36(5):515~524
9. Chen LC,Chang CH,Yu CY,Chang YJ,Wu YH,Lee WC,YehCH,LeeTW,TingG.Pharmacokinetics,micro-SPECT/CT imaging and therapeutic efficacy of(188)Re-DXR-liposomeinC26coloncarcinomaascitesmice model.Nucl Med Biol,2008,35(8):883~893
10.Chen LC,Chang CH,Yu CY,Chang YJ,Hsu WC,Ho CL,Yeh CH,Luo TY,Lee TW,Ting G. Biodistribution,pharmacokinetics and imaging of(188)Re-BMEDA-labeled pegylated liposomes after intraperitoneal injection in a C26 colon carcinoma ascites mouse model.Nucl Med Biol,2007,34(4):415~423
11.Chang CH,Stabin MG,Chang YJ,Chen LC,Chen MH,ChangTJ,LeeTW,TingG.Comparativedosimetric evaluation ofnanotargeted (188)Re-(DXR)-liposome for internal radiotherapy.Cancer Biother Radiopharm,2008,23(6):749~758
12.Wang SX,Bao A,Phillips WT,Goins B,Herrera SJ,Santoyo C,Miller FR,Otto RA.Intraoperative therapy with liposomal drug delivery:Retention and distribution in human head and neck squamous cell carcinoma xenograft model.Int J Pharm,2009,373(1-2):156~164
13.Wang SX,Bao A,Herrera SJ,Phillips WT,Goins B,Santoyo C,MillerFR,Otto RA. Intraoperative186Reliposome radionuclide therapy in a head and neck squamous cell carcinoma xenograft positive surgical margin model.Clin Cancer Res,2008,14(12):3975~3983
14.Bao A,Phillips WT,Goins B,Zheng X,Sabour S,Natarajan M,Ross Woolley F,Zavaleta C,Otto RA.Potential use of drug carried-liposomes for cancer therapy via directintratumoralinjection. IntJ Pharm,2006,316(1-2):162~169
15.Dagar S,Krishnadas A,Rubinstein I,Blend MJ,Onyuksel H.VIP grafted sterically stabilized liposomes for targeted imaging ofbreastcancer:In vivo studies. J Control Release,2003,91(1-2):123~133
16.Zavaleta CL,Phillips WT,Soundararajan A,Goins BA.Use ofavidin/biotin-liposome system forenhanced peritoneal drug delivery in an ovarian cancer model.Int J Pharm,2007,337(1-2):316~328
17.Xing L,Dawei C,Liping X,Rongqing Z.Oral colon-specific drug delivery for bee venom peptide:Development of a coated calcium alginate gel beads-entrapped liposome.J Control Release,2003,93(3):293~300
18.Merkel OM,Librizzi D,Pfestroff A,Schurrat T,Behe M,Kissel T.In vivoSPECT and real-time gamma camera imaging of biodistribution and pharmacokinetics of siRNA delivery using an optimized radiolabeling and purification procedure.Bioconjug Chem,2009,20(1):174~182
19.Merkel OM,Beyerle A,Librizzi D,Pfestroff A,Behr TM,Sproat B,Barth PJ,Kissel T.Nonviral siRNA delivery to the lung:Investigation of PEG-PEI polyplexes and theirin vivoperformance.Mol Pharm,2009,6(4):1246~1260
20.Merkel OM,Librizzi D,Pfestroff A,Schurrat T,Buyens K,Sanders NN,De Smedt SC,Behe M,Kissel T.Stability ofsiRNA polyplexes from poly(ethylenimine) andpoly(ethylenimine)-g-poly(ethylene glycol)underin vivoconditions:Effects on pharmacokinetics and biodistribution measured by Fluorescence Fluctuation Spectroscopy and Single Photon Emission Computed Tomography(SPECT)imaging.J Control Release,2009,138(2):148~159
21.Boswell CA,Eck PK,Regino CA,Bernardo M,Wong KJ,Milenic DE,Choyke PL,BrechbielMW. Synthesis,characterization,and biological evaluation of integrin alphavbeta3-targeted PAMAM dendrimers. MolPharm,2008,5(4):527~539
22.Parrott MC,Benhabbour SR,Saab C,Lemon JA,Parker S,Valliant JF,Adronov A.Synthesis,radiolabeling,and bio-imaging of high-generation polyester dendrimers.J Am Chem Soc,2009,131(8):2906~2916
23.Harivardhan Reddy L,Sharma RK,Chuttani K,Mishra AK,Murthy RS. Influence ofadministration route ontumor uptake and biodistribution of etoposide loaded solid lipid nanoparticles in Dalton's lymphoma tumor bearing mice.J Control Release,2005,105(3):185~198
24. HoangB,LeeH,Reilly RM,AllenC. Noninvasive monitoring ofthe fate of111In-labeled block copolymer micelles by high resolution and high sensitivity microSPECT/CT imaging.Mol Pharm,2009,6(2):581~592
25.Yuan XB,Yuan YB,Jiang W,Liu J,Tian EJ,Shun HM,Huang DH,Yuan XY,Li H,Sheng J.Preparation of rapamycin-loaded chitosan/PLA nanoparticles for immunosuppression in corneal transplantation.Int J Pharm,2008,349(1-2):241~248
26.Chen MC,Wong HS,Lin KJ,Chen HL,Wey SP,Sonaje K,Lin YH,Chu CY,Sung HW.The characteristics,biodistribution and bioavailability of a chitosan-based nanoparticulate system for the oral delivery ofheparin.Biomaterials,2009,30(34):6629~6637
27.Gorantla S,Dou H,Boska M,Destache CJ,Nelson J,Poluektova L,Rabinow BE,Gendelman HE,Mosley R.Quantitative magnetic resonance and SPECT imaging for macrophage tissue migration and nanoformulated drug delivery.J Leukoc Biol,2006,80(5):1165~1174
28.Cheon J,Lee JH.Synergistically integrated nanoparticles as multimodal probes for nanobiotechnology.Acc Chem Res,2008,41(12):1630~1640
29.Lee PW,Hsu SH,Wang JJ,Tsai JS,Lin KJ,Wey SP,Chen FR,Lai CH,Yen TC,Sung HW.The characteristics,biodistribution,magnetic resonance imaging and biodegradability of superparamagnetic core-shell nanoparticles.Biomaterials,2010,31(6):1316~1324
30.DeNardo SJ,DeNardo GL,MiersLA,NatarajanA,ForemanAR,GruettnerC,AdamsonGN,IvkovR.Development of tumor targeting bioprobes((111)In-chimeric L6 monoclonalantibody nanoparticles) for alternating magnetic field cancer therapy.Clin Cancer Res,2005,11(19 Pt 2):7087s~7092s
31.DeNardo SJ,DeNardo GL,NatarajanA,MiersLA,Foreman AR,Gruettner C,Adamson GN,Ivkov R.Thermal dosimetry predictive of efficacy of111In-ChL6 nanoparticle AMF--induced thermoablative therapy forhuman breast cancer in mice.J Nucl Med,2007,48(3):437~444
32.Kennel SJ,Woodward JD,Rondinone AJ,Wall J,Huang Y,Mirzadeh S.The fate of MAb-targeted Cd(125m)Te/ZnS nanoparticlesin vivo.Nucl Med Biol,2008,35(4):501~514
33.Bhushan KR,Misra P,Liu F,Mathur S,Lenkinski RE,Frangioni JV.Detection of breast cancer microcalcifications using a dual-modality SPECT/NIR fluorescent probe.J Am Chem Soc,2008,130(52):17648~17649
34.Hu G,Lijowski M,Zhang H,Partlow KC,Caruthers SD,Kiefer G,Gulyas G,Athey P,Scott MJ,Wickline SA,Lanza GM.Imaging of Vx-2 rabbit tumors with alpha(nu)beta3-integrin-targeted111In nanoparticles. IntJ Cancer,2007,120(9):1951~1957
35.Wu W,Li R,Bian X,Zhu Z,Ding D,Li X,Jia Z,Jiang X,Hu Y. Covalently combining carbon nanotubes with anticancer agent:Preparation and antitumor activity.ACS Nano,2009,3(9):2740~2750
36.Singh R,Pantarotto D,Lacerda L,Pastorin G,Klumpp C,Prato M,Bianco A,Kostarelos K.Tissue biodistribution and blood clearance rates of intravenously administered carbon nanotube radiotracers.Proc Natl Acad Sci USA,2006,103(9):3357~3362
This work was supported by grants from The National Natural Science Foundation of China(30970784,30870265),National Key Basic Research Program of China(2009CB930200),Chinese Academy of Sciences(CAS) “Hundred Talents Program”(07165111ZX),and China-Finland Bilateral Nanotechnology Collaboration(2008DFA01510)for financial supports
Biological Effects of Nanomaterials and Drugs Measured by The Small-Animal SPECT/CT Imaging Systemin Vivo
MA Huili1,WANG Paul C2,QIAN Feng3,LIANG Xingjie1
1.Key Laboratory for Biomedical Effects of Nanomaterials and Nanosafety,National Center for Nanoscience and Technology,The Chinese Academy of Sciences,Beijing 100190,China;
2.Laboratory of Molecular Imaging,Department of Radiology,Howard University,Washington,DC 20060,USA;
3.Deparment of molecule imaging,Healthcare Sector,Siemens Limited China,Shanghai 201318,China
Mar 10,2010 Accepted:May 14,2010
Liang Xingjie,Tel:+86(10)82545569,E-mail:liangxj@nanoctr.cn
Study on dynamic biologic process in intact and living small animal models of diseases has stimulated the rapid progress of high-resolution imaging methods.These methods can be used to clarify molecular interactions in the onset and progress of diseases or tumors,evaluate the biologic effects of drug and imaging agents,and measure the therapeutic efficacy of drugs for a single-model system.Single photon emissioncomputedtomography(SPECT) canprovidethreedimensionaldistributionsofγ-rayemitting radionuclide imaging agents.Moreover,combining SPECT with CT(computed tomography)in a SPECT/CT system can assist in defining the anatomic context of biological process and improve the quantitative accuracy of data.The paper reviewed the characteristics and recent progress of the SPECT/CT imaging system in the studies of nanomaterials,such as liposome,nanoparticles and carbon nanotube.
SPECT/CT;Small animal imaging;Drug delivery system;Nanomaterials
2010-03-10;接受日期:2010-05-14
自然科学基金委项目(30970784),国家重点基础研究发展计划(2009CB930200),中国科学院“百人计划”项目(07165111ZX)和中芬纳米科技合作项目(2008DFA01510)资助
梁兴杰,电话:(010)82545569,E-mail:liangxj@nanoctr.cn
R743,R739

