红藻氨酸致颞叶癫痫大鼠海马内 Semaphorin3C、Se maphorin3F基因表达的研究
邓晓清, 郑金瓯, 余 璐, 陈子蓉
红藻氨酸(kainic acid,KA)致动物癫痫持续状态(state epilepsy,SE)后,海马神经轴索环路异常生长可引起海马兴奋性增高,促进痫性发作及传播,是导致颞叶癫痫(temporal lobe epilepsy,TLE)发病的机制之一[1]。神经轴索导向分子(axon guidance molecules)是一类调控脊椎动物胚胎期神经轴索定位生长、发育及进化的家族性导向分子,在神经损伤后有调控神经轴突重建及轴索环路生长的作用。Semaphorin(Sema)为神经轴索导向分子之一,其中SemaⅢ(6个亚型:Sema3A-3F)对脊椎动物胚胎期神经轴索的生长路径、神经纤维束以及突触的形成起到化学性排斥作用,对损伤后神经系统突触的重建及轴突外向性生长亦有化学排斥性调控作用[2]。研究表明 Sema3A及 Sema 3D及其他神经生长因子如 EphA5受体及其配体 ephrinA3在基因水平可促进 KA致 TLE大鼠海马神经轴索环路重建[3],而 Sema3C、Sema3F是否同样能调控 TLE大鼠海马神经轴索环路重建报道少见。本研究通过检测 KA致大鼠 TLE后,大鼠海马内 Sema3C、Sema3F mRNA表达的时空变化,探讨它们在 TLE模型中对海马神经轴索环路重建的调控作用。
1 材料和方法
1.1 实验动物与模型构建 实验动物由广西医科大学实验动物中心提供,为 4~6w体重 160~250克的健康雄性 SD大鼠。(1)实验组大鼠麻醉后,右侧侧脑室内注射 KA(Sigma,USA,溶于生理盐水,2μg/μl,0.2μ),制备癫痫模型。观察大鼠行为学变化,按 Racine分级标准,达到 3~5级的归入致痫成功组。成功模型大鼠(n=33)于 SE后不同的时间点分为 1d、1w、2w、3w、4w等 5个亚组,每个亚组大鼠 6~7只。(2)对照组(n=7)大鼠以等量生理盐水代替 KA右侧侧脑室内微量注射。
1.2 取材及切片制备 在各时间点,将成功模型大鼠麻醉后,迅速断头取脑,将大脑标本放入液氮,(后移入 -80℃恒温冰箱保存,以备原位杂交切片用。用恒温冰冻切片机在背侧海马层面行连续冠状冰冻切片,片厚 20μm,隔 6取 1。
1.3 Nissl染色 取 20μm凉干切片,0.1%焦油紫染色 30~60s,镜下观察背景呈白色或无色,脱水,中性树胶封片。镜下观察并半定量细胞记数评价 DG、CA1区及 CA3区神经细胞丢失程度。
1.4 Semap3C/Sema3F原位杂交 采用武汉博士德公司提供的针对大鼠 Sema3C、Sema3F的地高辛标记的寡核苷酸探针原位杂交试剂盒。20μm切片经含有1/1000 DEPC的 4%多聚甲醛/0.1mol PBS室温固定,1.5%过氧化氢甲醇室温处理以消除内源性过氧化物酶,蒸馏水洗涤,滴加新鲜稀释的胃蛋白酶室温消化以暴露 mRNA。PBS及蒸馏水洗涤。含有 1/1000 DEPC的 1%多聚甲醛/0.1mol PBS室温后固定,蒸馏水洗涤。20μl预杂交液 39℃恒温箱预杂交 4h,20μl探针杂交液于恒温箱 39℃杂交过夜,余按操作指南进行。阴性对照采用 PBS分别替代Sema3C及 Sema3F探针。
1.5 图像分析及统计学处理 采用 Leica病理图像分析系统对切片进行图像分析。每只大鼠 4张切片,每张切片在海马的 DG、CA1、CA3区分别取 2个 400倍视野,测定每个视野的阳性细胞个数,计算平均阳性细胞数。所有数据均以均数 ±标准差表示,统计分析采用 SPSS15.0软件进行微机处理,实验组不同时间点与对照组进行方差分析,检验水准α=0.05。
2 结 果
2.1 KA致痫后大鼠行为学改变 实验组大鼠侧脑室内注射 KA后平均 10~30min出现刻板行为:凝视不动,咀嚼,狗湿样震颤,反复头颈上仰,面肌痉挛,点头,最后出现反复双侧前肢阵挛,伴直立,跌倒或翻转。静止期(1~2w)行为正常;慢性期(2~4w)每只动物均观察到 1~3次癫痫自发发作。对照组大鼠未见癫痫发作。
2.2 神经元丢失 Nissal染色显示,对照组大鼠 DG、CA1区、CA3区分别见大量致密的形态完整的颗粒细胞及锥体细胞,胞浆内尼氏小体丰富。KA致 SE后 1d开始出现神经元丢失;在 1w组 7只大鼠中,见局部神经元丢失。2w组至 4w中,神经元丢失明显增多。
2.3 Sema3C mRNA在正常以及 KA致 SE后大鼠脑内表达 Sema3C mRNA在正常大鼠海马内分布广泛,表达丰富,主要在 DG颗粒细胞、门区以及海马各亚区锥体神经元胞浆中表达。与对照组相比较,KA致 SE后 1d,Sema3C mRNA在海马内表达无明显改变(P>0.05),KA致 SE后 1w组大鼠 Sema3CmRNA在 CA1区表达明显下降,持续至 3w(P<0.01),4w时恢复至正常(P>0.05)。Sema3C mRNA在 DG、CA3区的表达,对照组与实验组均无明显差别(P>0.05)。阴性对照组无 Sema3C mRNA表达(见表1)。
2.4 Sema3F mRNA在正常以及 KA致 SE后大鼠海马内的表达 Sema3F mRNA在正常大鼠海马内分布广泛,表达丰富,主要在颗粒细胞以及锥体细胞胞浆中表达。KA致 SE后 1d,Sema3F mRNA表达无明显改变;KA致 SE后 1w组大鼠 Sema3F mRNA在 CA1区、CA3区表达明显下降,持续至 3w(P<0.01),4w时 Sema3F mRNA恢复至正常(P>0.05)。Sema3F mRNA在 DG的表达,实验组与对照组均无明显差异,阴性对照组无 Sema3FmRNA表达(见表2)。
表1 对照组及 KA致 SE大鼠海马内 Sema3C mRNA表达±s,2个 400倍视野平均阳性细胞数)
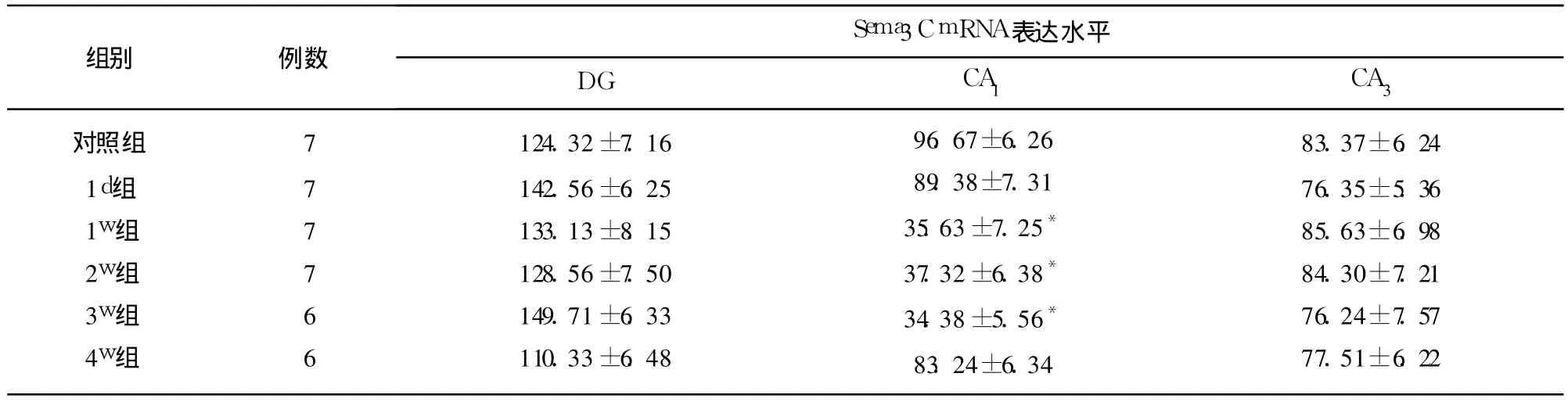
表1 对照组及 KA致 SE大鼠海马内 Sema3C mRNA表达±s,2个 400倍视野平均阳性细胞数)
与对照组相比*P<0.01
对照组1d组1w组2w组3w组4w组777766124.32±7.16142.56±6.25133.13±8.15128.56±7.50149.71±6.33110.33±6.4896.67±6.2689.38±7.3135.63±7.25*37.32±6.38*34.38±5.56*83.24±6.3483.37±6.2476.35±5.3685.63±6.9884.30±7.2176.24±7.5777.51±6.22
表2 对照组及KA致SE大鼠海马内Sema3F mRNA表达±s,2个 400倍视野平均阳性细胞数)
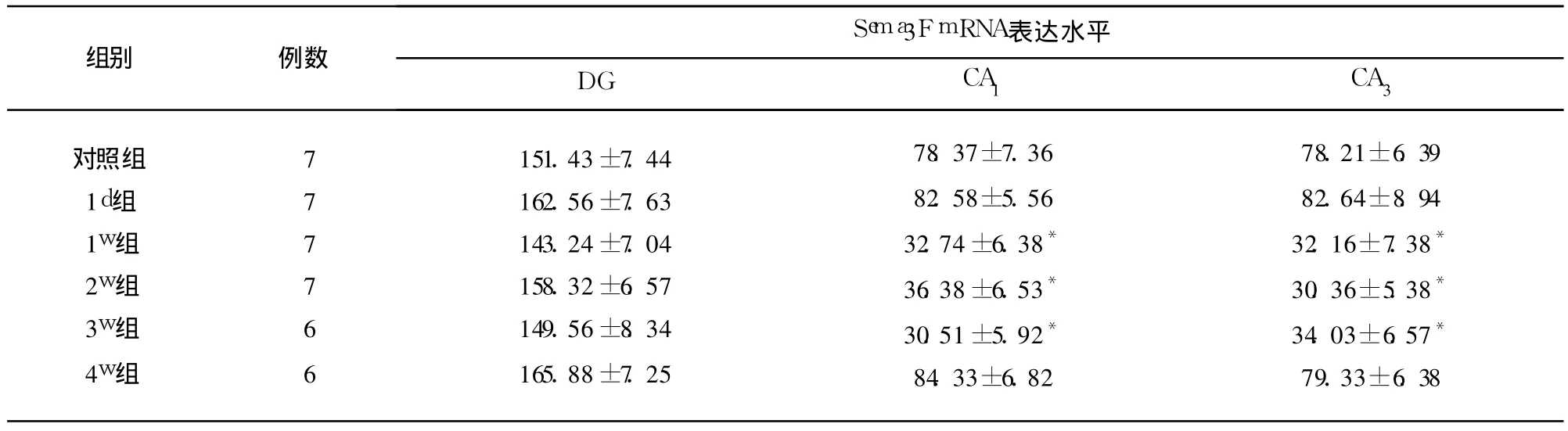
表2 对照组及KA致SE大鼠海马内Sema3F mRNA表达±s,2个 400倍视野平均阳性细胞数)
与对照组相比*P<0.01
对照组1d组1w组2w组3w组4w组777766151.43±7.44162.56±7.63143.24±7.04158.32±6.57149.56±8.34165.88±7.2578.37±7.3682.58±5.5632.74±6.38*36.38±6.53*30.51±5.92*84.33±6.8278.21±6.3982.64±8.9432.16±7.38*30.36±5.38*34.03±6.57*79.33±6.38
3 讨 论
3.1 Sema3C、Sema3F mRNA在 KA致 SE后CA1区表达减少 本研究显示,KA致 SE后 1d,大鼠 CA1区 Sema3C、Sema3F mRNA表达较对照组无明显差别(P>0.05);KA致 SE后 1w,大鼠 CA1区Sema3C、Sema3F mRNA表达明显下降(P<0.01),持续至 3w;至 4w时表达正常(P>0.05)。KA致 SE后,DG颗粒细胞以及 CA1区锥体神经元之间存在异常的兴奋性突触环路,SE后数天内该环路轴索即开始生长,多在 30d内完成[1]。因此,Sema3C、Sema3F mRNA表达在 CA1区减少的时间(1w)与该区轴索生长以及新突触形成的时间一致;而 Sema3C、Sema3FmRNA恢复至正常的时间(4w)与该区异常轴突环路完成的时间一致,表明 Sema3C、Sema3F mRNA能调节 KA致 SE后 CA1区轴突的外向性生长以及新突触的形成,与 Barnes[4]等报道结果一致。Giger[5]等将大鼠 DG颗粒细胞、海马 CA1区锥体细胞以及内嗅皮层的神经元移植到 293T细胞分泌液中,293T细胞分泌的 Sema3F对 CA1区锥体细胞轴索的外向性生长产生化学排斥作用,Steup[6]等用同样的方法发现 Sema3C对 CA1区锥体神经元轴索的外向性生长产生化学排斥作用,提示离体条件下,Sema3C、Sema3F能够抑制 CA1区锥体神经元轴索外向性生长以及新突触形成。Sahay[7]等证实了 Sema家族通过调节成年大鼠海马分子层轴突的生长和定位而调节神经网络的形成和功能,Sema3F对 CA1区锥体神经元轴突有调节作用,Sema3F分泌少的大鼠易患癫痫,与本实验的结果一致。KA干预大鼠后导致 SE的机制可能为:(1)出现多个神经元同时的过度点燃;(2)海马神经元丢失。本研究中,实验组大鼠均出现 SE,表明均有神经元过度点燃。研究表明,损伤啮齿动物的面神经及红核脊髓神经后,Sema3C mRNA表达暂时升高[8],KA干预小鼠后,Sema3F通过信号传导机制调节海马神经网络的重建[9],与本实验的结果一致。Barnes[10]等用 KA同时干预 FVB属以及 C57/B6属小鼠,小鼠出现 SE表现后检测小鼠 CA1区锥体细胞的 Sema3C、Sema3F的配体和受体 mRNA表达,发现在 SE后 CA3区及门区锥体细胞丢失的 FVB属小鼠 CA1区锥体细胞 Sema3C、Sema3F的配体和受体 mRNA表达减少,而不伴 CA3区细胞丢失的 C57/B6属小鼠 CA1区锥体细胞 Sema3C、Sema3F的配体和受体 mRNA表达无改变,表明神经元损伤后启动下调 Sema3C、Sema3F mRNA表达机制为失神经支配、传入神经阻滞。本研究中,KA致 SE后由于 CA1区锥体神经元丢失及轴索损伤,CA1区出现失神经支配,CA3区的兴奋性传入 CA1区受阻,促使存活的 CA1区锥体细胞启动Sema3C、Sema3F mRN下调表达机制,而促进该区轴索的外向性生长和新突触形成。
3.2 Sema3F mRNA在 KA致 SE后 CA3区表达减少 本研究表明:KA致 SE后 1d,Sema3F mRNA在 CA3区锥体细胞的表达与对照组相比无差别(P>0.05);KA致 SE后 1w大鼠中 Sema3F mRNA在该区锥体细胞表达明显减少(P<0.01),持续至3w;4w时 Sema3F mRNA表达与对照组相比无差别(P>0.05)。KA致 SE后,DG颗粒细胞至海马 CA3区锥体神经元之间的苔藓纤维异常发芽,SE后数天开始生长,多在 30d左右完成[1]。Sema3F mRNA表达在 CA3区锥体神经元减少的时间(1w)与该区锥体神经元周围轴突生长以及新突触形成时间相符合,其表达恢复至正常时间(4w)与苔藓纤维异常发芽完成的时间一致,表明 Sema3F mRNA能调节 KA致 SE后 CA3区轴突的外向性生长以及新突触的形成,与 Barnes[4]等报道一致。Giger[5]等将大鼠 DG以及海马 CA3区移植到 293T细胞分泌液中,293 T细胞分泌的 Sema3F对 DG以及 CA3区的轴索外向性生长产生化学排斥作用,提示在离体条件下,Sema3F能抑制 DG颗粒细胞以及 CA3区锥体细胞轴索的外向性生长。Neuropilin-2是海马神经元 Sema3F受体,敲除小鼠 neuropilin-2基因后,小鼠表现出对 Sema3F的化学排斥作用不敏感,出现自发的痫性发作,CA3区苔藓纤维轴索的生长偏离轨道[11],亦证实了成年小鼠海马 CA3区锥体细胞分泌的 Sema3F可抑制该区轴索的外向性生长和新突触的形成,与本实验结果一致。其机制可能为 KA致 SE后CA3区大部分锥体神经元丢失,兴奋性在该区传入受阻,该区存活的锥体神经元启动 Sema3F mRNA下调机制,Sema3FmRNA表达减少促使 CA3区轴突的外向性生长以及新突触的形成。
本研究表明,KA致 SE后,海马 CA1区锥体神经元下调 Sema3C、Sema3F mRNA的表达,CA3区锥体神经元下调 Sema3F mRNA的表达,从而调节该区轴突外向性生长以及新突触形成,调节海马轴索环路的重建。Sema3C、Sema3F mRNA在 DG颗粒细胞表达未见改变,表明 Sema3C、Sema3F mRNA对 KA致SE后 DG颗粒细胞轴突的外向性生长和新突触的形成可能无调控作用。
[1] Sutula T,He XX,Cavazos J,et al.Synaptic reorganization in the hippocampus induced by abnormal functional activity[J].Science,1988,239(4844):1147-1150.
[2] Pasterkamp RJ,Giger RJ.Semaphorin function in neural plasticity and disease[J].Curr Opin Neurobiol,2009,19(3):263-274.
[3] 余 璐,郑金瓯,梁志坚,等.红藻氨酸诱导癫痫发作大鼠海马 E-phA5受体及其配体 ephrinA3基因表达变化的研究[J].中风与神经疾病杂志,2007,24(6):653-656.
[4] Barnes G,Puranam RS,Luo Y,et al.Temporal specific patterns of semaphorin gene expression in rat brain after kainic acid-induced status epilepticus[J].Hippocampus,2003,13(1):1-20.
[5] Giger RJ,Cloutier JF,Sahay A,et al.Neuropilin-2 is required in vivo for selective axon guidance responses to secreted semaphorins[J].Neuron,2000,25(1):29-41.
[6] Steup A,Lohrum M,Hamscho N,et al.Sema3Cand netrin-1 differentially affect axon growth in the hippocampal formation[J].Mol Cell Neurosci,2000,15(2):141-155.
[7] Sahay A,Kim CH,Sepkuty JP,et al.Secreted semaphorins modulate synaptic transmission in the adult hippocampus[J].J Neurosci,2005,25(14):3613-3620.
[8] Oschipok LW,Teh J,McPhail LT,et al.Expression of Semaphorin3C in axotomized rodent facial and rubrospinal neurons[J].Neurosci Lett,2008,434(1):113-118.
[9] Yang J,Houk B,Shah J,et al.Genetic background regulates semaphorin geneexpression and epileptogenesis in mouse brain after kainic acid status epilepticus[J].Neuroscience,2005,131(1):853-856.
[10] Barnes GN,Luo YL,Mc Namara JO.Status epilepticus is necessary but not sufficient to regulate neuropilin gene expression in mouse hippocampus after kainic acid status epilepticus[J].Epilepsia,2000,41(suppl 7):41.
[11] Chen H,Bagri A,Zupicich JA,et al.Neuropilin-2 regulates the development of selective cranial and sensory nerves and hippocampal mossy fiber projections[J].Neuron,2000,25(1):43-56.

