青藤碱防护脂多糖所致 PD大鼠黑质多巴胺能神经元损伤实验研究
陈 鑫, 牛 平, 王聪杰, 刘宝茹, 辛志强
炎症在帕金森病(Parkinson's disease,PD)病因和发病机制中的作用已日益被人们所认识,一些具有抗炎作用的植物提取物被筛选-出来,经动物实验及临床应用证实对多巴胺(Dopamine,DA)能神经元有保护作用,且因其天然性,无毒副作用,在治疗 PD方面显示出优势。青藤碱(Sinomenine,SN)是从中药青风藤根茎中提取的生物碱单体,现代医学已经证实有抗炎、免疫调节、镇痛、降压、抗心律失常等药理作用,药理机制与选择性环氧化酶-2(Cyclooxygen-ase-2,COX-2)抑制剂相似,具有预防和治疗 PD的双重作用。但目前相关研究尚处于起步阶段,国内外报道较少。
本研究通过黑质内注射脂多糖(LPS)制作 PD动物模型,应用 SN对实验动物进行预处理。采用免疫组织化学方法及免疫印迹技术等观察其对黑质DA能神经元的保护作用,并通过对 COX-2表达等的影响,对其神经保护机制进行探讨,为开发新的PD治疗药物奠定实验基础。
1 资料与方法
1.1 PD炎症模型的制作 选择经行为学测试无旋转行为的健康雄性清洁级 SD大鼠,体重 200~250g。10%的水合氯醛(400mg/kg)腹腔注射麻醉后,腹卧位固定于大鼠脑立体定位仪上,无菌条件下正中切口,切开头皮、皮下,剥离骨膜,暴露前囟。根据大鼠图谱[1],选择黑质致密部(SNpc:前囟后4.8 mm,中缝旁开 1.7mm,硬膜下 7.8mm)。牙科钻钻开颅骨后,用微量注射器将 5μl LPS(LPS 1.0μg/μl,美国 Sigma公司)缓慢注射致右侧黑质(针尖斜面向尾、外侧),给药速度为 1μl/min,对照组黑质注射 5μl磷酸盐缓冲液(PBS),注射完毕停留 10min后缓慢退针,退针速度为 1.0mm/min。手术完毕,明胶海绵填塞颅骨孔,消毒后缝合切口,腹腔注射青霉素l00000IU。
1.2 实验分组及药物干预 青藤碱盐酸盐粉剂(湖南正清生物有限公司)用生理盐水配成 1%的混悬液。在黑质立体定向注射 LPS前 3h开始灌胃,剂量为 30mg/kg/d[2],持续至注射后 14d。36只 SD大鼠随机分成 3组:(1)对照组:黑质内注射 PBS,生理盐水灌胃;(2)PD组:黑质内注射 LPS,生理盐水灌胃;(3)SN组:黑质内注射 LPS,青藤碱灌胃。
1.3 行为学观察 实验终点用阿朴吗啡(Apomorphine,APO,美国 Sigma公司)0.5mg/kg腹腔注射诱发动物旋转,观察各组大鼠行为学变化,并记录大鼠开始出现旋转至 30min内的旋转圈数及旋转方向。
1.4 免疫组织化学检测 对照组及实验组于实验终点灌注固定,取冠状中脑组织块(以视交叉前缘和乳头体后缘为标志),经梯度脱水、透明、浸蜡、包埋后,制成合适蜡块。然后作连续冠状切片,厚度为 5μm。切片置于涂有多聚赖氨酸的载玻片上。进行免疫组织化学检测(二步法,北京中杉金桥生物有限公司),检测酪氨酸羟化酶(Tyrosine hydroxylase,TH,北京博奥森生物有限公司)、COX-2(美国 Santa Cruz公司)及 OX-42(美国 Chemicon公司)阳性细胞。光镜下观察,细胞质或胞核上有棕色颗粒者为阳性细胞,每张切片随机取 3个视野,在装有目镜网格测微尺的光学显微镜下计数注射侧黑质阳性细胞数,取平均值,计算每组均值及标准差。
1.5 免疫印迹(Western blot)检测 各组大鼠麻醉后,迅速断头取脑,分离腹侧中脑,约 100mg左右。将脑组织置于 1~2ml匀浆器中球状部位,剪碎,置于裂解液中,低温匀浆,4℃,13000rpm离心15min,取上清。采用考马斯亮蓝法测定样品蛋白浓度,以 Eppendorf管分装,于 -80℃冰箱中保存备用。进行 Western blot分析:样品(50μg)加十二烷基硫酸钠(SDS)缓冲液煮沸 5min,4℃冷却,经 12%分离胶行十二烷基硫酸钠聚丙烯酰胺凝胶电泳,电压200V,电流 100mA,至溴酚蓝到达分离胶底部时停止电泳。4℃循环水浴内以电压 60V,电流100mA将样品转至醋酸纤维素滤膜(NC膜)上,时间为 2h。将转移后的 NC膜于含 5%脱脂奶粉的封闭液室温下封闭 1h。TBST洗 NC膜 3次。分别加入 TH抗体(工作效价 1∶200)、COX-2抗体(工作效价 1∶200)及 β-actin单抗(工作效价 1∶400),4℃孵育过夜。TBST洗涤 3次后加入二抗,以封闭液 1∶1000稀释 HRP标记的 IgG,室温孵育 2h。TBST洗涤 3次,DAB(北京中杉金桥生物有限公司)显色,将特异性蛋白条带用扫描仪进行扫描,在同一条件下以同一样品 β-actin(北京中杉金桥生物有限公司)为内参照,应用 UVP凝胶成像系统分析,结果以吸光度(A)表示。
1.6 统计学处理 各组数据以均数 ±标准差表示,采用 SPSS 13.0 for windows统计学软件包进行数据分析。各组间数据的显著性检验采用单因素方差分析。检验结果判定,以 P<0.05为差异显著,P<0.01为差异非常显著。
2 结 果
2.1 行为学观察 对照组大鼠无任何行为变化。PD组及 SN组大鼠在 APO注射 5min后均可诱发向右侧(LPS注射侧)的旋转行为,旋转时大鼠身体向右侧曲成环状,头尾衔接,以右侧后肢为支点向右侧旋转,并伴有觅食样动作,部分大鼠出现弓背、竖毛、颤抖等症状。PD组大鼠 30min平均旋转圈数为196.90±9.52,SN组为 98.79±8.81,旋转明显减少,与 PD组比较差异非常显著(P<0.01)(见表1)。
2.2 免疫组织化学分析 TH免疫组化分析表明各组黑质均检测到 TH阳性神经元,TH阳性表达定位于细胞浆,呈棕褐色。对照组 TH阳性神经元数量较多,胞体较大,神经元呈梭形或多角形,突起明显。PD组与对照组相比 TH阳性神经元数量明显减少,甚至消失,神经元胞体萎缩,轮廓及突起亦不清晰,差异非常显著(P<0.01)。SN组黑质 TH阳性神经元数量与 PD组相比明显增加(P<0.01),神经元形态变化亦不明显(见表2、见图1~图3)。
COX-2免疫组化分析表明对照组及实验组黑质均检测到 COX-2阳性细胞,COX-2阳性表达定位于细胞浆,呈棕黄色,强阳性者细胞核内也有表达。对照组偶见 COX-2阳性细胞。PD组黑质致密部可见大量散在分布的 COX-2阳性细胞。SN组 COX-2阳性细胞数与 PD组相比明显减少(P<0.01)(见表2)。
采用小胶质细胞特异性抗体 OX-42进行免疫组化分析,结果显示对照组大鼠黑质大部分小胶质细胞形态呈静止的“分枝样”,胞体小,有 2~3个细长突触。PD组大部分小胶质细胞呈圆形或椭圆形,少部分有短粗突触,胞质深染,类似于巨噬细胞,呈典型的“阿米巴样”,提示其处于激活状态。SN组激活状态的小胶质细胞明显减少,其细胞体较对照组增大,突起伸长、增多,成为高度分枝状态的小胶质细胞,介于静止状态和激活状态之间(见图4~图6)。
Western blotting分析显示在预染蛋白标准约60kDa和 72k Da处,分别可见 TH和 COX-2特异性蛋白条带。灰度分析发现,对照组大鼠黑质 TH蛋白大量表达,仅有微量 COX-2蛋白表达。PD组与对照组比较 TH蛋白表达减少,COX-2蛋白表达明显增高,差异非常显著(P<0.01)。SN组与 PD组相比,TH蛋白表达增加,COX-2蛋白表达显著下降(P<0.01)(见表3、见图1、图2)。
表1 各组大鼠行为学变化±s)

表1 各组大鼠行为学变化±s)
与对照组比较△P<0.01;与 PD组比较#P<0.01
对照组PD组SN组1212120196.90±9.52△98.79±8.81△#
表2 各组大鼠黑质TH和COX-2阳性细胞数比较±s)(个 /每视野)

表2 各组大鼠黑质TH和COX-2阳性细胞数比较±s)(个 /每视野)
与对照组比较△P<0.01;与 PD组相比#P<0.01
对照组PD组SN组666135.22±12.1121.54±4.89△88.05±9.34△#0.96±0.3851.37±4.36△15.62±4.58△#
表3 各组大鼠黑质TH和COX-2蛋白表达量比较±s)

表3 各组大鼠黑质TH和COX-2蛋白表达量比较±s)
与对照组比较△P<0.01;与 PD组相比#P<0.01
组别 例数 TH蛋白表达 COX-2蛋白表达对照组PD组SN组66687.14±10.7314.23±3.51△69.87±7.03△#38.65±5.84205.25±11.36△85.38±10.58△#
3 讨 论
本实验中我们通过黑质内注射 LPS,制作了 PD动物模型。通过动物行为学观察到 PD组大鼠特征性的旋转行为。免疫组织化学检测表明 PD组 TH阳性神经元数量明显减少,甚至消失,神经元胞体萎缩,轮廓及突起亦不清晰。黑质致密部可见大量散在分布的 COX-2阳性细胞。且 PD组大部分小胶质细胞呈圆形或椭圆形,少部分有短粗突触,胞质深染,类似于巨噬细胞,呈典型的“阿米巴样”,提示其处于激活状态。免疫印迹技术进一步表明PD组 TH蛋白表达明显减少,COX-2蛋白表达明显增高。证实 LPS主要通过激活小胶质细胞,产生炎性介质,间接损伤 DA能神经元。
LPS是一种以氨基甙为组成单位的磷脂,是革兰氏阴性杆菌细胞壁的主要组成成分,是一种强效的炎症反应诱导剂。与其它神经毒素不同,LPS主要通过激活小胶质细胞,产生超氧化物、炎性介质及大量自由基等[3]间接造成 DA能神经元损伤,其本身对 DA能神经元并无损伤作用。近年研究表明以小胶质细胞激活为特征的神经炎症在 PD的发病机制中起重要作用。小胶质细胞是一种广泛分布于中枢神经系统的具有免疫和炎症双重功能的胶质细胞,生理情况下小胶质细胞占脑细胞总数的 10%左右,其主要生理功能是维持脑内环境的稳定、免疫监测、防御及参与组织修复过程等[4]。在中枢神经系统中,小胶质细胞分布不均匀,主要集中于中脑黑质部位[5],这为其激活在 PD发病过程中发挥重要作用奠定了解剖学基础。有研究表明,来自 PD患者的 IgG和 DA能神经元细胞系 MES 23.5的膜提取物可激活小胶质细胞,而正常人的 IgG、胆碱能神经元的膜提取物却不能激活小胶质细胞,这种激活作用与小胶质细胞膜 Fcγ受体的结合有关[6],这也表明了小胶质细胞的激活介导的炎症反应与 DA能神经元之间可能存在着某种关系。激活的小胶质细胞形态上表现为从“分枝状”的静息状态转化为细胞体积增大,突起伸长、增多,胞体变圆并具有变形和吞噬功能的激活状态[7,8]。功能上大量表达一些与抗原识别和提呈有关的特异性膜表面分子,如主要组织相容性复合物和补体受体 CR3。伴随着这些变化,被激活的小胶质细胞除了吞噬、清除变性的神经元外,还会上调一系列引起炎症和吞噬作用的受体及分子,并且本身也会分泌大量的促炎性因子、神经营养因子及其他神经毒素等。除 NO、超氧阴离子外,还包括 TNF-α、IL-1α、IL-1β、干扰素-γ(IFN-γ)、IL-6和表皮生长因子、类花生酸物质及兴奋性氨基酸等诸多细胞因子,并且能上调一些酶如 iNOS和 COX2的表达。这些细胞因子一方面可以刺激其它未激活的小胶质细胞,级联放大小胶质细胞反应和随后的胶质相关损伤[9];另一方面还可以与它们位于 DA能神经元上的特定的细胞表面受体结合,激活转导途径,直接作用于DA能神经元引起毒性效应。
本实验中我们用小胶质细胞特异性抗体 OX-42进行免疫组化分析,结果显示对照组大鼠黑质大部分小胶质细胞呈静息的“分枝状”形态。而 PD组大部分小胶质细胞活化,形态呈圆形或椭圆形,少部分有短粗突触,胞质深染,为典型的“阿米巴样”,提示其处于激活状态。TH及 COX-2免疫组化分析结果显示对照组黑质可见大量 TH阳性神经元,偶见COX-2阳性细胞;PD组黑质 TH阳性神经元显著减少,可见大量散在分布的 COX-2阳性细胞。Western blot分析也得出了类似结论,提示 LPS对黑质 DA能神经元的毒性过程中存在 COX-2的表达上调,COX-2参与 LPS诱导的神经变性过程。
鉴于神经炎症在 PD发病机制中的重要作用,减轻炎症及异常的免疫反应、防护 DA能神经元损伤,最大程度地延缓、阻止 PD进展成为 PD治疗的新思路。糖皮质激素具有抑制小胶质细胞激活,减少炎性细胞因子释放及减轻神经毒素对 DA能神经元损伤的作用。但激素诸多的副作用限制了其临床应用。目前趋向于非甾体抗炎药(NSAIDs),其主要作用机制是通过抑制 COX,影响花生四烯酸代谢,使PG合成减少,从而抑制炎症反应。流行病学研究发现,与阿司匹林相似,长期服用其他 NSAIDs可以降低患 PD的危险度达 45%。动物模型研究也证实阿司匹林和水杨酸盐能对抗 MPTP对纹状体 DA能神经元损伤。其主要通过抑制 COX-1、COX-2阻止小胶质细胞激活,并通过下调谷氨酸受体来阻止 NF-κB激活,从而保护 DA能神经元免受炎性损伤[10]。COX有两种异构体,即 COX-1和 COX-2。Vane[11]提出 NSAIDs对炎症的有效治疗作用源于其对 COX-2的抑制,而不良反应归于其对 COX-1的抑制。因此选择性 COX-2抑制剂在能有效治疗炎症的同时,又可避免或减轻由于抑制人体正常生理功能所必需的 COX-1而导致的不良反应。青藤碱(Sinomenine,SN)是从中药青风藤根茎中提取的生物碱单体,分子式为 C19H23NO4,分子量为 329.38。从化学结构看,它由氢菲核及乙胺桥组成,结构类似于吗啡,药用多为其盐酸盐。SN具有抗炎、免疫抑制、镇痛、降压、抗心律失常等药理作用,类似于选择性 COX-2抑制剂,目前临床上已广泛应用于类风湿性关节炎和风湿性疾病以及心律失常等,其具有抗炎作用而副作用小的主要特点。目前利用中草药的作用多靶点、毒副作用小等特点,来探索 PD治疗的中草药已成当今的研究热点。
本实验中我们观察到 SN对 LPS诱导的 DA能神经元的变性坏死具有保护作用,与 PD组相比,SN组 COX-2阳性细胞数及其蛋白表达明显减少,差异非常显著。TH免疫组化及 Western blot分析结果表明,SN组 TH阳性细胞数及 TH蛋白表达均低于对照组,高于 PD组,差异非常显著。SN组激活状态的小胶质细胞亦明显减少,其细胞体较对照组增大,突起伸长、增多,成为高度分枝状态的小胶质细胞,介于静止状态和激活状态之间。表明中药青藤碱能抑制小胶质细胞激活以及炎性物质的释放,明显降低黑质 COX-2蛋白的表达,减少 LPS诱导的 DA能神经元变性和死亡。
Wang等[12]发现 SN无论在体内和体外均具有抗炎及神经保护作用,其可抑制促炎性因子如 TNF-α、IL-1及 PGE2的释放。MPTP诱导的 PD动物模型显示,SN能显著性地抑制小胶质细胞的激活,抑制细胞内 NADPH氧化酶 p47(PHOX)亚基的活化,从而保护 DA能神经元。应用体外酶反应实验体系,观察 SN对离体 COX-1和 COX-2纯酶活性的影响,结果提示 SN可选择性地抑制 COX-2活性及其代谢产物 PGE2的表达,这是其抗炎、免疫抑制等作用较强而胃肠道副作用小的主要机制之一。体外细胞培养也观察到 SN对 LPS诱导的 PC12细胞的COX-2 mRNA蛋白表达具有不同程度的抑制作用,且这种抑制作用与 SN的浓度呈明显正相关性,并可抑制 IL-2膜受体表达,提示其可调节小胶质细胞产生细胞因子[13]。并且 SN能够通过血脑屏障,在脑组织内有较好的滞留度,能特异性抑制小胶质细胞的激活及 COX-2表达上调,缓解炎性介导的 DA能神经元变性,具有神经保护作用。但 PD与神经炎症之间的关系相当复杂,如何选择合适的抗炎药物,达到保护 DA能神经元,延缓 PD进展,最终根治 PD的目的,仍有待进一步研究。

图1 对照组大鼠黑质 TH阳性神经元呈梭形或多角形,数量较多(TH免疫组化染色,×200)

;图2 PD组大鼠黑质 TH阳性神经元胞体萎缩,轮廓不清晰,数量明显减少(TH免疫组化染色,×200)

;图3 SN组大鼠黑质 TH阳性神经元数量增加更显著,形态无明显变化(TH免疫组化染色,×200)

图4 对照组大鼠黑质 OX-42阳性小胶质细胞形态呈“分枝状”(OX-42免疫组化染色,×400);
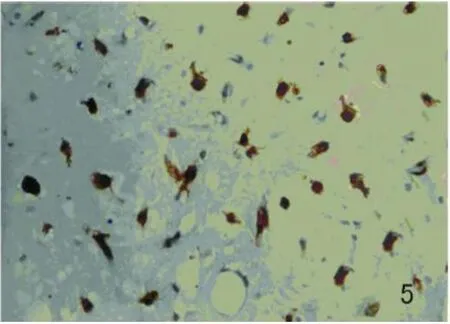
图5 PD组大鼠黑质 OX-42阳性小胶质细胞形态呈“阿米巴样”,细胞体积较大(OX-42免疫组化染色,×400);

图6 SN组大鼠黑质激活的 OX-42阳性小胶质细胞胞体略小,数量减少,部分呈分枝状(OX-42免疫组化染色,×400)
[1] Paxinos G,Watson C.The Rat Brain Atlas[M].Fourth Edition:USA.Academic Press,1998.38-45.
[2] Qian L,Xu ZL,Zhang W,et al.Sinomenine,a natural dextrorotatory morphinan analog,is anti-inflammatory and neuroprotective through inhibition of microglial NADPH oxidase[J].J Neuroinflammation,2007,4:23.
[3] Faulkner JR,Herrmann JE,Woo MJ,et al.Reactive astrocytes protect tissue and preserve function after spinal cord injury[J].J Neurosci,2004,24(9):2143-2155.
[4] Nakajima K,Kohsaka S.Functional roles of microglia in the central nervoussystem[J].Hum Cell,1998,11(3):141-155.
[5] Kim WC,Mohney RP,Wilson B,et al.Regional differenced in susceptibility to Lipopolysacchaide-induced neurotoxicity in the rat brain:role of microglia[J].Neurosci,2000,20(16):6309-6316.
[6] Le W,Rowe D,Xie W,et al.Microglia activation and dopaminergic cell injury:an in virto model relevant to Parkinson disease[J].J Neurosci,2001,21:8447-8455.
[7] Sawada M,Imamura K,Nagatsu T.Role of cytokines in inflammatory process in Parkinson'sdisease[J].JNeural Transm Suppl,2006,70:373-381.
[8] Hunot S,Dugas N,Faucheux B,et al.FcepsilonRIL/CD23 is expressed in Parkinson disease,in vitro,producing of nitric oxide and tumor necrosis factor-alpha in glia cells[J].J Neurosci,1999,19(7):3440-3447.
[9] Liu B.Modulation of microglial pro-inflammatoryand neurotoxic activity for the treatment of Parkinson's disease[J].AAPS J,2006,8(3):606-621.
[10] Wang T,Pei Z,Zhang W,et al.MPP+-induced COX-2 activation and subsequent dopaminergic neurodegeneration[J].FASEB J,2005,19(9):1134-1136.
[11] Vane J.Towards a better aspirin[J].Nature,1994,367(6460):215-216.
[12] Wang Y,Fang Y,Huang W,et al.Effect of sinomenine on cytokine expression of macrophages and synoviocytes in adjuvant arthritis rats[J].J Ethnopharmacol,2005,98(1~2):37-43.
[13] Liu B,Du L,Hong JS.Naloxone protects rat dopaminergic neurons against inflammatory damagethrough inhibition of microglia activation and superoxide generation[J].J Pharmacol Exp Ther,2000,293(2):607-617.

