缺血后处理对大鼠脑缺血 /再灌注后海马 CA1区神经元凋亡及 β淀粉样蛋白 1-40表达的影响
张 迎, 王 晔, 刘佳丽, 高丹丹, 席自中
缺血性脑血管病是我国中老年人致死、致残的主要原因之一,在治疗时间窗内及时再通阻塞的血管,恢复血流是减轻神经功能缺失有效的治疗方法,然而再灌注本身产生过量活性氧簇(ROS)或氧自由基,导致再灌注损伤。迄今,无论是基础研究还是临床试验,神经保护治疗尚无突破。2003年 Zhao等[1]在心肌缺血实验中首次提出“缺血后处理(ischemic postconditioning,IP)”的概念,指在永久性再灌注前对缺血组织进行反复间断性再灌注,对缺血组织起保护作用。研究显示[2]后处理可显著降低心肌梗死体积,抑制炎性介质释放及细胞凋亡。然而缺血后处理是否通过抑制细胞凋亡发挥神经保护作用国内外报道均不多。本实验采用线栓法制备大脑中动脉脑缺血模型,缺血 60min后对 IP各亚组进行不同时间点的后处理,再灌注 24h后进行神经行为学评分(NDS),检测神经元凋亡及 β淀粉样蛋白1-40(Aβ1-40)的表达,探讨脑缺血后处理在脑缺血/再灌注中的作用及其相关机制,为临床应用提供有价值的参考。
1 资料与方法
1.1 动物及分组 健康雄性 SD大鼠 40只,体重 240~280g,由辽宁医学院动物实验中心提供。随机分为假手术(SH)组(8只)、缺血再灌注(I/R)组(8只)、缺血后处理(IP)组(24只),后者又根据缺血后处理的时间不同分为 IP-15s、IP-30s、IP-1min 3个亚组,每个亚组 8只。
1.2 主要试剂及仪器 原位细胞凋亡检测(TUNEL)试剂盒、兔抗大鼠 Aβ1-40免疫组化试剂盒,购自武汉博士德生物工程有限公司;202型电热恒温干燥箱(北京中兴伟业仪器有限公司);数显恒温水浴锅 HH-2(国华电器有限公司);石蜡切片机LEICA-RM2135(德国莱卡);显微图像分析系统 Meta Morph/spot color Mosaic/Bx51(UIC/OLMPUS,美国 /日本)。
1.3 脑缺血再灌注模型建立 参照 Longa线栓法[3]制备大鼠左侧大脑中动脉局灶性脑缺血(MCAO)模型。10%水合氯醛(3ml/kg)腹腔注射麻醉大鼠,颈部正中切口,暴露左颈总动脉(CAA)、颈外动脉(ECA)、颈内动脉(ICA)。结扎 CAA近心端、ECA起始端,将 CAA剪一“V”形小口(约为动脉直径的 1/2),沿 CAA插入直径为 0.23mm、一端烧成圆头(头端直径约 0.26~0.3mm)的鱼线,直至大脑中动脉起始部,插入深度约为 18.0±0.5mm。缺血 60min后再灌注。SH组除不插线外,余操作同前。术中用电热毯和电烤灯保持大鼠肛温在 36℃~37℃。
1.4 脑缺血后处理方法 IP-15s组:MCAO 60min后,将鱼线拔出 5~8mm恢复再灌注 15s,再插入原来位置缺血 15s,反复循环 3次;IP-30s组:操作方法同 IP-15s组,再灌注/缺血时间为 30s;IP-1min:操作方法同 IP-15s组,再灌注/缺血时间为1min。
1.5 神经行为学评分 再灌注 24h后对各组大鼠进行神经行为学评分[3](NDS):0级:无功能障碍;1级:不能伸展右侧前肢;2级:向右侧旋转;3级:向右侧倾倒;4级:无自主活动伴有意识障碍。
1.6 苏木精-伊红(H-E)染色、缺血侧海马CA1区神经元凋亡及 Aβ1-40表达检测 完成 NDS后将各组大鼠快速打开胸腔,经左心室灌流内固定后,断头取脑,在视交叉后 1mm及 5mm处冠状切面切开,取中间脑组织放入相同固定液中继续外固定,4℃过夜,常规梯度乙醇脱水、二甲苯透明、浸蜡、包埋,在海马齿状回连续冠状切片(厚 5μm),每隔 5片取 1片,分别用于 H-E染色、细胞凋亡检测和免疫组化染色。细胞凋亡检测严格按 TUNEL试剂盒说明书进行操作,采用显微图像分析系统,在 400倍视野下选取海马 CA1区 5个不重复视野,计算凋亡指数(AI),AI=凋亡细胞核数/总细胞核数 ×100%(凋亡细胞核为棕黄色,非凋亡细胞核呈蓝色)。Aβ1-40的表达用 SABC免疫组化染色法,操作严格按试剂说明书进行,阴性对照以 PBS代替 Aβ1-40抗体。Aβ1-40阳性细胞胞浆呈棕褐色。显微图像分析系统检测平均光密度值(Optical Density Average,A值)。
1.7 统计学方法 采用 SPSS 11.5统计软件,NDS数据采用秩和检验;余检测数据以均数 ±标准差表示,用单因素方差分析,LSD法进行组间比较;Pearson直线关分析细胞凋亡与 Aβ1-40表达的相关性;P<0.05为差异显著,具有统计学意义。
2 结 果
2.1 NDS缺血/再灌注后除假手术组外,各组大鼠均表现不同程度的神经功能障碍。与 I/R组比较 IP各亚组 NDS明显降低(P<0.01)。IP各亚组比较无显著性差异(P>0.05)(见表1)。
2.2 H-E染色 假手术组大鼠显示正常脑组织结构。I/R组及 IP各亚组大鼠缺血/再灌注 24h后海马 CA1区神经元可见不同程度的组织水肿,细胞数目减少,胞核固缩,浓染,表现为坏死及囊腔形成。
2.3 神经元凋亡检测 SH组偶见凋亡细胞,AI为 1.51±0.89,与 SH组比较 I/R组和 IP各亚组海马 CA1区神经元 AI明显增加(均 P<0.01)。I/R组可见大量凋亡细胞,AI为 40.38±2.15,与 I/R组比较 IP各亚组海马 CA1区神经细胞 AI显著减小(均 P<0.01),IP各亚组 AI分别为:20.49±5.28、26.76 ±6.35、29.66±4.19。 IP-15s较 IP-30s、IP-1min组神经元凋亡减少更为显著(P<0.05),而 IP-30s、IP-1min组比较无统计学显著性(P>0.05)(见表2、见图1~图5)。
2.4 Aβ1-40表达 SH组极少表达,A值为0.09±0.01,与 SH组比较 I/R组及 IP各亚组 Aβ1-40表达明显增加(均 P<0.01)。 I/R组 Aβ1-40表达明显增加,A值为 0.38±0.05,与 I/R组比较 IP各亚组 Aβ1-40表达明显减少(均 P<0.01),IP各亚组 A值分别为 0.27±0.02、0.31±0.04、0.32±0.06。IP各亚组之间比较无显著性(P>0.05)(见表2、见图6~图10)。
2.5 Aβ1-40表达与神经元凋亡相关性 对 I/R组及 IP各亚组 Aβ1-40表达 A值和神经元 AI两组数据绘制散点图显示二者呈同向变化,进行 Pearson直线相关分析,结果显示:Aβ1-40表达 A值与神经元 AI呈正相关(r=0.895,P<0.01)。
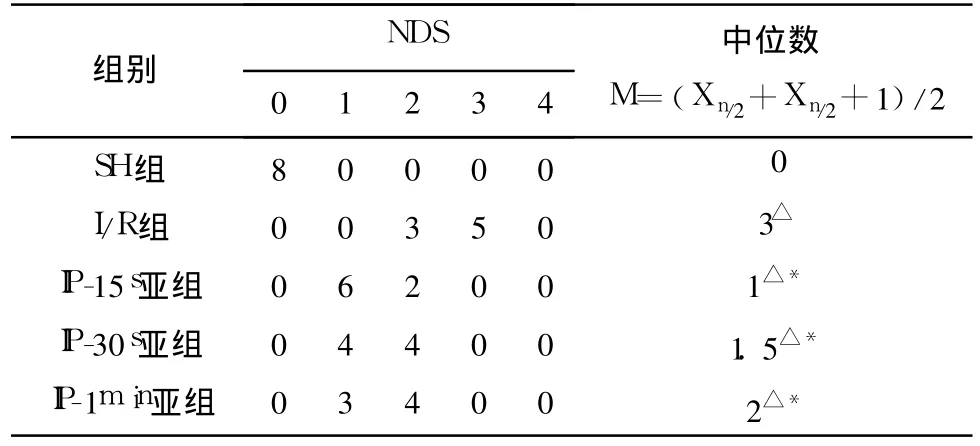
表1 大鼠脑缺血/再灌注 24h后 NDS
表2 缺血侧海马 CA1区神经元 AI及Aβ1-40表达 A值±s)

表2 缺血侧海马 CA1区神经元 AI及Aβ1-40表达 A值±s)
与 SH组比较△P<0.01;与I/R比较*P<0.01;与 IP-15s亚组比较﹟P<0.05
SH组I/R组IP-15s亚组IP-30s亚组IP-1min亚组888881.51±0.8940.38±2.15△20.49±5.28△*26.76±6.35△*﹟29.66±4.19△*﹟0.09±0.010.38±0.05△0.27±0.02△*0.31±0.04△*0.32±0.06△*
3 讨 论
早期研究已证实[4],脑缺血/再灌注后大脑抗氧化酶活性降低,ROS表达过量,导致大脑脂质、蛋白质及 DNA损伤,最终产生脑功能障碍和神经细胞死亡。本实验研究显示各时间点缺血后处理均能改善脑缺血/再灌注后神经行为学评分,后处理可通过抑制细胞凋亡减轻再灌注损伤,发挥神经保护作用,这与Xing等[5]的研究结果一致。Xing等研究显示,一方面,后处理通过降低再灌注损伤后 MDA水平,增加 SOD活性,减少脂质过氧化及超氧负离子抑制神经细胞凋亡发挥脑保护作用。另一方面,缺血后处理通过增加线粒体抗凋亡蛋白 Bcl-2的表达抑制Bax向线粒体内转移,抑制细胞色素 C释放,发挥抗凋亡作用。也有学者提出缺血后处理神经保护机制可能与蛋白激酶 B(Akt)、促分裂原活化蛋白激酶(MAPK)、蛋白激酶 C(PKC)及 ATP敏感性钾通道(KATP)等细胞信号途径有关[6]。本实验采用MCAO模型,观察不同缺血后处理时间点海马 CA1区神经元的变化,显示在 MCAO 60min后分别给予15s、30s、1min缺血 /再灌注 ,循环 3次,恢复再灌注24h后,海马 CA1区神经元凋亡明显减少,且 IP-15s亚组较其他后处理各亚组抑制神经元凋亡的作用更加显著。缺血后处理在脑缺血/再灌注损伤中的保护机制复杂,目前的研究处于探讨阶段,可能是多种途径共同参与的结果。
Aβ是阿尔茨海默病(Alzheimer's disease,AD)特征性病理改变老年斑的关键组成部分,主要有Aβ1-40、Aβ1-42两种形式存在于脑组织及血液和脑脊液中,参与细胞代谢[7,8]。研究发现 Aβ1-40在急性脑卒中患者血液中表达水平比对照组患者明显增高[9],大鼠急性缺血 60min再灌 24h后 Aβ表达显著上调[10]。动物实验研究显示 Aβ在 MCAO后脑组织中沉积,具有神经毒性,可诱导细胞凋亡[11]。Aβ对神经元的毒性损伤可能与以下机制有关[12]:(1)诱导炎性反应、氧化应激、自由基损伤、脂质过氧化、钙稳态失调等;(2)诱导神经元对各种伤害性刺激如缺血缺氧、自由基损伤、氧化应激、炎性反应等的敏感性增强;(3)Aβ通过核因子 κB信号通路促使诱导型一氧化氮合酶表达,最终导致神经元坏死和凋亡。本实验显示,脑缺血/再灌注后 Aβ1-40较假手术组明显增加,说明 Aβ1-40可能参与缺血/再灌注损伤的过程,加重缺血/再灌注损伤。缺血后处理各亚组 Aβ1-40的表达较缺血/再灌注组明显减少,神经功能评分显著改善,提示 Aβ1-40的降低可能参与缺血后处理的脑保护机制。
Aβ1-40诱导细胞凋亡的机制与再灌注损伤诱导凋亡的机制在某种程度上相似,都涉及炎性反应、氧化应激、自由基损伤、脂质过氧化、钙稳态失调等途径,推测再灌注损伤与 Aβ神经毒性机制存在一定的内在联系。部分实验已证实缺血后处理抗凋亡的神经保护作用机制可能与调节上述途径有关[6],AD与缺血性脑血管病是否有共同的发病机制,是再灌注损伤诱导了 Aβ1-40的表达参与了凋亡过程,还是凋亡途径中的某种因子诱导了 Aβ1-40的表达,以及缺血后处理如何干预细胞凋亡等都是未解决的问题,还需大量实验进一步证实缺血后处理神经保护作用、脑缺血/再灌注损伤、Aβ的促凋亡作用三者之间的关系。

图1 SH组:海马 CA1区未见凋亡细胞(×400);图2 I/R组:海马 CA1区大量凋亡细胞(×400);图3 IP-15s亚组:海马 CA1区凋亡细胞显著减少(×400);图4 IP-30s亚组:海马 CA1区凋亡细胞显著减少(×400);图5 IP-1min亚组:海马 CA1区凋亡细胞显著减少(×400);图6 SH组:海马 CA1区偶见 Aβ1-40表达(×400);图7 I/R组:海马 CA 1区大量 Aβ1-40表达(×400);图8 IP-15s亚组:海马 CA 1区 Aβ1-40表达显著减少(×400);图9 IP-30s亚组:Aβ1-40表达显著减少(×400);图10 IP-1min亚组:Aβ1-40表达显著减少(×400)
总之,脑缺血后处理可通过抑制细胞凋亡减轻再灌注损伤,改善神经行为学评分,发挥神经保护作用,Aβ1-40参与了缺血后处理神经保护机制的过程,本实验显示神经细胞凋亡水平与 Aβ1-40表达呈正相关,但由于实验存在很多局限性,其内在联系还需进一步探讨,以便为将来的临床应用提供依据。
[1] Zhao ZQ,Corvera JS,Halkos ME,et al.Inhibition of myocardial injury by ischemic postconditioning during reperfusion:comparison with ischemic preconditioning[J].Am JPhysiol Heart Circ Physiol,2003,285:579-588.
[2] Vinten-Johansen J,Yellon DM,Opie LH,et al.Postconditioning:a simple,clinically applicable procedure to improve revascularization in acute myocardial infarction[J].Circulation,2005,112:2085-2088.
[3] Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20:84-91.
[4] Chan PH.Role of oxidants in ischemic brain damage[J].Stroke,1996,27:1124-1129.
[5] Xing BZ,Chen H,Zhang M,et al.Ischemic postconditioning inhibits apoptosis after focal cerebral ischemia/reperfusion injury in the rat[J].Stroke,2008,39:2362-2369.
[6] Zhao H.Ischemic postconditioning as a novel avenue to protect against brain injury after stroke[J].JCereb Blood Flow Metab,2009,29:873-885.
[7] Schubert D,Soucek T,Blouw B.The induction of HIF-1 reduces astrocyte activation by amyloid beta peptide[J].Eur JNeurosci,2009,29:1323-1334.
[8] Hoglund K,Wiklund O,Vanderstichele H,et al.Plasma levels of β-Amyloid(1-40),β-Amyloid(1-42),and totalβ-Amyloid remain unaffected in adult patients with hypercholesterolemia after treatment with statins[J].Arch Neurol,2004,61:333-337.
[9] Lee PH,Bang OY,Hwang EM,et al.Circulating beta amyloid protein is elevated in patients with acute ischemic stroke[J].J Neural Transm,2005,112:1371-1379.
[10] 李泰东,陆国辉,崔云燕.缺血再灌注对大鼠海马神经元淀粉样蛋白及其蛋白前体表达的影响及人参皂甙Rg2的干预[J].中风与神经疾病杂志,2008,25(3):417-420.
[11] Van Groen T,Puurunen K,Maki HM,et al.Transformation of diffuse beta-amyloid precursor protein and beta-amyloid deposites to plaques in the thalamus after transient occlusion of the middle cerebral artery in rats[J].Stroke,2005,36:1551-1556.
[12] Lacor PN,Buniel MC,Furlow PW,et al.Abetaoligomer-induced aberrationsin synapse composition,shape,and density provide a molecular basis for loss of connectivity in Alzheimer's disease[J].J Neurosci,2007,27:796-807.

