SPIO、EGFP双标 GDNF基因修饰中脑神经干细胞移植治疗帕金森病
邓兴力, 王应莉, 杨智勇, 李向新, 龙 江, 雷德强, 刘如恩, 冯忠堂
帕金森病(Parkinson's disease,PD)是常见于中老年的神经退行性变性疾病,其主要病理改变为中脑黑质致密部多巴胺(dopamine,DA)神经元的变性、缺失其导致纹状体内神经递质 DA的耗竭,目前尚无根治疗法[1~3]。由于 PD病变区域较为局限,被认为是神经细胞移植治疗最有希望治愈的中枢神经系统疾患之一[4]。本研究拟探讨超顺磁氧化铁(superparamagnetic iron oxide,SPIO)、增强型绿色荧光蛋白(enhanced green fluorescent protein,EGFP)双标胶质细胞源性神经营养因子(glial cell line derived neurotrophic factor,GDNF)基因修饰大鼠胚胎中脑神经干细胞(mesencephalic neural stem cells,mNSCs)移植对 PD大鼠的治疗作用,为临床应用细胞移植治疗 PD奠定研究基础。
1 材料与方法
1.1 SPIO、EGFP双标大鼠胚胎 mNSCs的建立[5]
1.2 SPIO、EGFP双标 GDNF基因修饰大鼠胚胎 mNSCs的建立[6]
1.3 PD模型大鼠的建立 2%戊巴比妥钠(40mg/kg)麻醉 SD大鼠,于右侧前脑内侧束(A/P:-3.6mm;L:+2.0mm;V:-9.0mm)及腹侧被盖区(A/P:-6.0mm;L:+0.5mm;V:-8.0mm)分别立体定向注入 12μg 6-OHDA(3μg/μl),注射速度为1μl/min,注射完毕后原位留针 5min,之后缓慢退针(约 2min)。术后 1w开始,腹腔注射阿朴吗啡(Apomorphine,APO;0.25mg/kg)诱发大鼠旋转行为,每周 1次,连续测试 6w。注射 10min后计数其在30min内的旋转次数。选取平均向健侧(左侧)旋转速度 >7rpm的大鼠为建立成功的 PD模型大鼠。
1.4 细胞移植 选取 36只 PD大鼠进行细胞移植实验,随机分为 3组,每组 12只:(1)对照组;(2)SPIO、EGFP双标 mNSCs移植组 (GFP-NSCs组);(3)SPIO、EGFP双标 GDNF基因修饰 mNSCs移植组(GDNF-NSCs组)。细胞移植前离心收集细胞,以 PBS重悬,调整细胞密度至 106/ml。2%戊巴比妥钠麻醉 PD大鼠,将 5×105个细胞(5μl)注射于右侧纹状体(A/P:+0.5mm;L:+3.0 mm;V:-5.0 mm)。细胞移植后 2w、4w、6w和 8w,腹腔注射 APO诱发大鼠旋转行为,注射 10min后计数其在 30min内的旋转次数。
1.5 移植细胞的存活、迁移和分化
1.5.1 MRI动态观察 细胞移植后 1w、2w、4w和 8w分别进行 MRI扫描。2%戊巴比妥钠麻醉大鼠,固定于多功能实验动物操作台[7],用 Philips Intera 1.5TMRI扫描机进行扫描。采用 5英寸表面线圈,先行三平面定位扫描,然后进行梯度回波 T2加权 (T2W/FFE)成像,参数为 :TR 388ms,TE 23ms,翻转角 18°,FOV 120mm,矩阵 205×256,层厚 2.0mm,扫描时间 2min 8s。
1.5.2 普鲁士蓝染色鉴定 细胞移植 8w动脉灌注固定取大脑标本,经 4%多聚甲醛后固定、梯度蔗糖处理,于细胞移植点附近作连续冠状冰冻切片(片厚 10μm)。组织切片经普鲁士蓝染色后,显微镜观察并照相。
1.5.3 荧光显微镜观察 组织切片以抗荧光衰减封片剂直接封片,激光共聚焦显微镜观察并照相。
1.5.4 免疫荧光组织化学 组织切片经 10%山羊血清封闭,分别与 nestin抗体(1∶1000)、TH抗体(1∶1000)、GFAP抗体(1∶750)孵育过夜,PBS漂洗后再与 TRITC标记 IgG(1∶100)孵育,抗荧光衰减封片剂封片后激光共聚焦显微镜观察并照相。
1.5.5 细胞计数 计算每只动物连续 5张切片以细胞移植点为中心100倍视野下GFP阳性细胞数、nestin阳性细胞数、nestin与 GFP双染阳性细胞数、TH阳性细胞数、TH与 GFP双染阳性细胞数、GFAP阳性细胞数和 GFAP与 GFP双染阳性细胞数。
1.6 数据分析和处理 所有数据用 SPSS 12.0软件进行统计处理,以均数 ±标准差±s)表示,采用单因素方差分析(one-way AVONA)检验,P<0.05表示有统计学差异。
2 结 果
2.1 PD模型大鼠的建立 所有动物均成功接受脑立体定向手术,无动物死亡。部分大鼠于术后7~10d开始出现头偏斜、行动迟缓、少动、尾僵直等异常行为。术后 2w开始,部分大鼠经 APO诱导可出现向健侧(左侧)旋转行为。随着时间推移,经APO诱导出现旋转的大鼠数量明显增加,且旋转速度较前增快。至术后 6w,经APO诱导出现旋转的大鼠数量及旋转速度相对稳定,其中 39只大鼠恒定向健侧(左侧)旋转且旋转速度大于 7rpm,视为成功的PD大鼠(见表1)。

表1 术后APO诱导大鼠旋转行为评分
2.2 细胞移植后的行为学评估 为方便比较,细胞移植动物的旋转次数用相对值表示:细胞移植后测得的旋转次数/细胞移植前测得的旋转次数。与对照组相比,各细胞移植组 PD大鼠行为学均有明显改善,旋转次数减少(P<0.01),以 GDNF-NSCs组最为显著(见表2)。
2.3 MRI动态观察 细胞移植 1w T2W/FFE扫描可见细胞移植区呈类圆形低信号影。随着时间推移,T2W/FFE成像上低信号区域呈逐渐变大的趋势,但仍局限于细胞移植区附近(见图1)。
2.4 普鲁士蓝染色鉴定 普鲁士蓝铁染色示大多数 SPIO标记的 mNSCs停留于移植原位,仅少量细胞向周围脑组织迁移(见图2)。
2.5 荧光显微镜观察 荧光显微镜观察移植细胞在脑内的存活、迁移,结果显示大多数移植细胞停留于移植原位,仅少数细胞向周围脑组织迁移。GDNF-NSCs组存活细胞数明显多于其它各组(见图3)。
2.6 免疫荧光组织化学 免疫荧光组织化学染色结果显示,大多数移植细胞停留于移植原位并保持其未分化状态,部分细胞分化为胶质细胞,仅极少数细胞分化为 DA神经元。
2.7 细胞计数 细胞计数结果显示,GDNF基因修饰 mNSCs移植组 GFP阳性细胞数、nestin免疫阳性细胞数和 TH免疫阳性细胞数均明显多于其它各组;而 GFAP染色阳性细胞数则明显低于其它各组 (P<0.01)(见表3、表4)。

表2 细胞移植后APO诱导PD大鼠旋转行为评分

表3 纹状体区脑组织切片细胞计数结果

表4 移植细胞在纹状体内的分化情况
3 讨 论
PD是常见于中老年的神经退行性疾病,其主要病理改变为中脑黑质致密部 DA神经元的变性、缺失其导致纹状体内神经递质 DA的耗竭,目前尚无根治疗法[1~3]。随着近年细胞生物学研究的不断深入,神经细胞胞移植技术已日益引起人们的关注。由于 PD病变区域较为局限,被认为是神经细胞移植治疗最有希望治愈的中枢神经系统疾患之一[4]。
由于 6-OHDA对 DA神经元具有选择性损毁作用,故可应用其建立 PD动物模型[8]。6-OHDA立体定向注射损毁黑质-纹状体 DA通路后,引起大鼠两侧大脑半球功能不对称。机体通过自我调节机制使损毁侧纹状体内 DA受体数量代偿性增加、敏感性增高;而健侧纹状体内神经递质 DA含量、受体的状态和运动调节能力均正常。此时若给予 DA受体激动剂,动物由于神经损毁侧的反应强于健侧而无法保持平衡并向健侧旋转。APO是突触后膜多巴胺D2受体激动剂,由于旋转运动主要依赖于纹状体背侧中部的 D2受体作用,故其可诱发大鼠向健侧的旋转行为。研究表明,APO诱发的旋转行为的出现和频率的大小可作为鉴定模型成功和衡量治疗效果的一个重要指标[9]。故本研究采用 6-OHDA建立 PD大鼠模型,进而研究细胞移植对 PD的治疗作用。
GDNF对 DA神经元具有特异性的营养作用,是目前发现的最强的 DA神经营养因子[10]。GDNF的发现为 PD的治疗带来突破性进展,然而由于血脑屏障和脑组织的解剖特点,限制了其应用[11~13]。随着分子细胞生物学技术的发展,基因治疗为解决 GDNF给药途径问题带来新的希望[14]。作为神经组织特异性的前体细胞,NSCs具有来源丰富,增殖、分化能力强,能整合于宿主细胞,易于基因修饰,极低或无免疫源性,无致瘤性等特点,被认为是中枢神经系统基因治疗的理想载体[15]。最近研究表明,NSCs具有区域特异性,NSCs的来源对其分化神经元的最终表型有重要影响[16],源于胚胎中枢神经系统各区域的NSCs具有不同的分化潜能,其中 mNSCs更易于分化为 DA神经元,是细胞移植治疗 PD的理想细胞源[17]。本研究显示,GDNF基因修饰 mNSCs移植可取得较 GFP基因修饰 mNSCs移植更为显著的疗效,说明移植入体内 GDNF基因修饰 mNSCs分泌的 GDNF发挥了其 DA神经营养活性,阻止了黑质-纹状体局部残存 DA神经元的进一步死亡。
为研究 mNSCs在 PD大鼠体内的存活和迁徙情况,本研究采用 SPIO和 EGFP基因对 mNSCs进行双标记。SPIO是一种新型 MR对比剂,具有超顺磁性,可影响局部磁场的均匀性,同时产生磁化率效应,加速共振质子的失相位,使 T2弛豫时间显著缩短[18]。由于 FFE(GRE)序列对超顺磁性物质最为敏感[19],故本研究采用 T2FFE观察移植的 SPIO标记 mNSCs在 PD模型大鼠脑内的存活和分布情况。在本研究中,SPIO标记 mNSCs移植后,T2FFE显示移植部位呈低信号影。GFP基因标记技术是近年迅速发展起来的一种新型细胞示踪技术,无需反应底物即可产生绿色荧光,敏感性强且性质稳定,不干扰细胞功能,易于检测,已成为细胞生物学研究中广泛使用的标志分子,EGFP是野生型 GFP的突变型,荧光强度增加了 35倍,大大提高了检测灵敏度[20]。本研究结果显示,EGFP基因标记 mNSCs移植 2月后仍然可发出较强的绿色荧光。
尽管体外研究表明 NSCs具有无限增殖能力和多向分化潜能,然而其在体内的增殖、迁移和分化则受诸多因素的影响[21]。这既包括 NSCs自身的内源性因素,还包括生长因子和细胞因子的诱导、局部微环境的调控等外源性因素[22]。由于 mNSCs含有中脑源性转录因子和相关发育信号,能对区域性的相关信号分子做出快速反应,故更易于分化为 DA神经元[17]。在必需因素的干预下,仅有 2%~8%体外培养的 mNSCs能够分化为 DA神经元[23~26],然而超过 10%移植入 PD动物体内的 mNSCs分化为 DA神经元[27,28]。因此,局部微环境的调控在 mNSCs向DA神经元的分化中发挥着重要作用。本研究结果显示,移植入 PD大鼠体内的 mNSCs均能够存活并分化为包括 DA神经元的多种神经细胞。与 GFP基因修饰 mNSCs移植组相比,GDNF基因修饰 mNSCs移植组中有更多的 mNSCs存活并分化为 DA神经元。故 GDNF可改善 PD大鼠纹状体局部微环境,使其更有利于移植 mNSCs的存活、生长并向 DA神经元分化。与 Yamasaki等应用 NSCs移植治疗阿尔茨海默病的研究结果相似[29],本研究结果显示:大多数移植入 PD大鼠纹状体内的 mNSCs均停留于移植原位,而并未向周围脑组织迁移。我们推测,这可能由于 PD大鼠纹状体局部分泌的细胞因子致使移植的 mNSCs驻留于移植原位。此外,本研究还发现:PD大鼠纹状体细胞移植区及其周围可见大量 nestin免疫反应阳性的 GFP阴性细胞,我们推测其可能为由纹状体局部以及移植细胞分泌的细胞因子诱导作用下自纹状体或室管膜下区迁移而来的内源性NSCs[30]。
综上所述,本研究结果表明:(1)mNSCs移植可显著改善PD大鼠的运动障碍;(2)大多数移植入 PD大鼠纹状体内的 mNSCs均停留于移植原位;(3)与对照组相比,GDNF基因修饰 mNSCs移植组中有更多的 mNSCs存活并分化为 DA神经元;(4)移植的mNSCs可能通过分泌细胞因子诱导内源性 NSCs向细胞移植区及其周围迁移,其机制有待进一步研究。
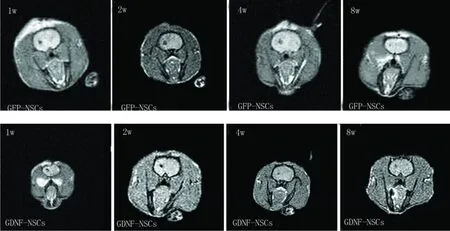
图1 细胞移植后的 MRI动态观察

图2 纹状体移植部位的 SPIO标记 mNSCs(普鲁士蓝染色)A:GFP-NSCs组(×200);B:GDNF-NSCs组(×200)

图3 荧光显微镜观察移植细胞在纹状体内的存活及迁移
[1] Zhang ZX,Roman GC,Hong Z,et al.Parkinson's disease in China:prevalence in Beijing,Xian,and Shanghai[J].Lancet,2005,365:595-597.
[2] Eriksen JL,Wszolek Z,Petrucelli L.Molecular pathogenesis of Parkinson disease[J].Arch Neurol,2005,62:353-357.
[3] Fahn S.Levodopain the treatment of Parkinson's disease[J].J Neural Transm Suppl,2006,71:1-15.
[4] Paul G,Ahn YH,Li JY,et al.Transplantation in Parkinson's disease:The future looksbright[J].Adv Exp Med Biol,2006,557:221-248.
[5] 刘如恩,邓兴力,郭 京,等.荧光蛋白、超顺磁氧化铁双标胎鼠神经干细胞建立[J].中华神经外科杂志,2008,24:787-790.
[6] 邓兴力,刘如恩,郭 京,等.超顺磁氧化铁、绿色荧光蛋白双标胶质细胞源性神经营养因子基因修饰中脑神经前体细胞的建立[J].中华实验外科杂志,2008,25:964-966.
[7] 雷德强,刘如恩,邓兴力,等.多功能实验操作平台[J].中国比较医学杂志,2009,19:53-55.
[8] Simola N,Morelli M,Carta AR.The 6-hydroxydopamine model of Parkinson's disease[J].Neurotox Res,2007,11:151-167.
[9] Rodríguez Díaz M,Abdala P,Barroso-Chinea P,et al.Motor behavioural changes after intracerebroventricular injection of 6-hydroxydopamine in the rat:an animal model of Parkinson'sdisease[J].Behav Brain Res,2001,122:79-92.
[10] Grondin R,Gash DM.Glial cell line-derived neurotrophic factor(GDNF):a drug candidate for the treatment of Parkinson's disease[J].J Neurol,1998,245:35-42.
[11] Tomac A,Lindqvist E,Lin LF,et al.Protection and repair of the nigrostriatal dopaminergic system by GDNFin vivo[J].Nature,1995,373:335-339.
[12] Nutt JG,Burchiel KJ,Comella CL,et al.Randomized,double-blind trial of glial cell line-derived neurotrophic factor(GDNF)in PD[J].Neurology,2003,60:69-73.
[13] Kirik D,Georgievska B,Bjorklund A.Localized striatal delivery of GDNF asa treatment for Parkinson disease[J].Nat Neurosci,2004,7:105-110.
[14] Kordower JH.In vivo gene delivery of glial cell line-derived neurotrophic factor for Parkinson's disease[J].Ann Neurol,2003,53:120-134.
[15] Martino G,Pluchino S.The therapeutic potential of neural stem cells[J].Nat Rev Neurosci,2006,7:395-406.
[16] Kim H,T Kim IS,Lee IS,et al.Human neurospheres derived from the fetal central nervous system are regionally and temporally specified but are not committed[J].Exp Neurol,2006,199:222-235.
[17] Storch A,Sabolek M,Milosevic J,et al.Midbrain-derived neural stem cells:from basic science to therapeutic approaches[J].Cell Tissue Res,2004,318:15-22.
[18] Thorek DL,Chen AK,Czupryna J,et al.Superparamagnetic iron oxide nanoparticle probes for molecular imaging[J].Ann Biomed Eng,2006,34:23-38.
[19] 刘新权,景 猛,栾 彧,等.不同 MR扫描序列对脑内移植SPIO标记神经干细胞大鼠的成像对比研究[J].中国微侵袭神经外科杂志,2004,9:560-562.
[20] Ward TH,Lippincott-Schwartz J.The uses of green fluorescent protein in mammalian cells[J].MethodsBiochem Anal,2006,47:305-337.
[21] Bazán E,Alonso FJ,Redondo C,et al.In vitro and in vivo characterization of neural stem cells[J].Histol Histopathol,2004,19:1261-1275.
[22] Hagg T.Endogenous regulators of adult CNS neurogenesis[J].Curr Pharm Des,2007,13:1829-1840.
[23] Jin G,Tan X,Tian M,et al.The controlled differentiation of human neural stem cells into TH-immunoreactive(ir)neurons in vitro[J].Neurosci Lett,2005,386:105-110.
[24] Roussa E,Krieglstein K.GDNF promotes neuronal differentiation and dopaminergic development of mouse mesencephalic neurospheres[J].Neurosci Lett,2004,361:52-55.
[25] Wang X,Li X,Wang K,et al.Forskolin cooperating with growth factor on generation of dopaminergic neurons from human fetal mesencephalic neural progenitor cells[J].Neurosci Lett,2004,362:117-121.
[26] 田美玲,金国华,谭雪峰,等.IL-1α及与 IL-11、LIF和 GDNF联合诱导胚鼠皮质、中脑神经干细胞向多巴胺神经元分化的比较[J].神经解剖学杂志,2005,21:656-660.
[27] Haas SJ,Beckmann S,Petrov S,et al.Transplantation of immortalized mesencephalic progenitors(CSM14.1 cells)into the neonatal parkinsonian rat caudate putamen[J].J Neurosci Res,2007,85:778-786.
[28] Trzaska KA,Rameshwar P.Current advances in the treatment of Parkinson's disease with stem cells[J].Curr Neurovasc Res,2007,4:99-109.
[29] Yamasaki TR,Blurton-Jones M,Morrissette DA,et al.Neural stem cells improve memory in an inducible mouse model of neuronal loss[J].J Neurosci,2007,27:11925-11933.
[30] Arias-Carrión O,Freundlieb N,Oertel WH,et al.Adult neurogenesis and Parkinson's disease[J].CNSNeurol Disord Drug Targets,2007,6(5):326-335.

