利用两种方法筛选拟南芥uro突变体的回复子
张 亮, 杨 扬, 孙 越, 徐艳飞, 俞 琛,周 薇, 唐洪波, 李小方
(华东师范大学生命科学学院,上海 200062)
利用两种方法筛选拟南芥uro突变体的回复子
张 亮, 杨 扬, 孙 越, 徐艳飞, 俞 琛,周 薇, 唐洪波, 李小方
(华东师范大学生命科学学院,上海 200062)
拟南芥URO基因与生长素的代谢密切相关,为了深入了解URO基因的作用机制及其所参与的遗传途径,以拟南芥叶发育异常的半显性突变体 uro(upright rosette)为材料,利用 EMS诱变和Ac/Ds转座子系统这两种方法筛选uro突变体的回复子.通过这两种方法获得了一些回复子,并对这些回复子进行了验证和初步分析,为今后的研究工作奠定了良好的基础.
拟南芥; URO; EMS诱变; Ac/Ds转座子系统
Abstract:It was suggested that URO function might be associated w ith auxin-mediated p lant development.In o rder to know the role and the genetic net work of URO gene,supp resso rs(double mutants w ith supp ressed phenotype of uro mutant)were screened through EM Smutagenesis and Ac/Ds transposon system.Several supp ressors have been selected,validated and further analyzed.These supp ressors w ill p rovide important clew s fo r the function netwo rk of URO gene.
Key words:A rabidopsis; URO; EMSmutagenesis; Ac/Ds transposon system
0 引 言
拟南芥是十字花科拟南芥属植物.近年来,拟南芥以其个体小、生长周期短以及基因组小等特点而成为分子遗传学研究的模式植物.拟南芥的另一优点是很容易被诱变,目前已从拟南芥中分离得到了几千种突变体,这些突变体的获得为揭示植物生长发育规律起了非常重要的作用[1].
uro(upright rosette意为垂直向上生长的莲座叶),是本实验室利用 T-DNA插入的方法得到的一个叶发育异常的半显性突变体[2].由于在幼苗时期,它的莲座叶生长方式表现为垂直向上(偏下性)生长,因此而得名.uro突变体表型有如下特点:顶端优势丧失、束间纤维发育异常、茎软、侧枝较野生型多等特征[3,4].对 uro突变体的前期研究表明:URO基因可能参与拟南芥的生长素信号系统对植物发育的调控过程;此外,uro突变体还具有一些乙烯相关表型,比如生长早期较短的下胚轴[5].以上这些研究结果充分表明了URO基因在植物生长发育方面的重要性,为了深入了解URO基因的作用机制及其所参与的遗传途径,弄清楚URO基因可能对生长素信号系统的调控作用,有必要通过筛选 uro突变体的回复子来寻找URO基因的互作基因,从而确定URO基因在整个基因网络中的位置.
EM S诱变是实验室比较常用的方法,EMS即甲基磺酸乙酯,是一类DNA烷化剂类诱变剂.这类烷化剂都带有一个或多个活泼的烷基,这些烷基能够加入碱基的许多位置,形成烷基化碱基,改变氢键的结合能力,从而造成基因突变;EM S化学诱变产生点突变的频率较高,可以对作物的某一种特殊性状进行改良,易于突变体的筛选,价格便宜,操作简单,不需要特殊设备,目前已成为应用最广泛、应用效果最好的一种化学诱变剂.因此,首选 EM S诱变的方法筛选uro突变体的回复子.
Ac/Ds转座子系统也被用来筛选突变体.Ds(dissociation)——转座元件,它的存在可使染色体在近旁断裂的机会大大增加,并因此改变邻近基因的作用.Ds的改变又受另一控制因子Ac(activator)——编码转座酶基因的影响,Ac可位于基因组中的任何其他地方,它的存在可以使 Ds跳离原来的位置,插入到别的位置,从而影响植株的表型[6].首先,Ds元件是构建在含有抗性基因和标记基因(GUS)的T-DNA上[6],利用T-DNA插入创建突变体群体[7],此时,获得的突变体再与Ac基因纯合的野生型杂交,杂交植株的基因组内就含有 Ac基因,而Ac基因的引入会使构建到 T-DNA上的 Ds元件从 T-DNA上跳离,插入到基因组内其他的位置,使植株的表型发生改变,因此可以利用Ac/Ds转座子系统筛选回复子.因为uro突变体是 T-DNA插入突变体,而该 T-DNA上又具有 Ds元件,所以,可以利用 Ac/Ds转座子系统来筛选uro突变体的回复子.
1 材料和方法
1.1 材料
拟南芥 uro(upright rosette,L er背景)突变体.
1.2 方法
1.2.1 拟南芥的培养
植物材料种植在含有蛭石、黑土和珍珠岩 (比例为7∶2∶1)的混合机质中,或者种植在1/2 MS(Murashige and Skoog不含糖)培养基上.植物种子消毒采用70%乙醇浸泡8 min,随后用蒸馏水冲洗3次.种子经过4℃低温处理3 d后,置于24 h 23℃光照条件下培养.
1.2.2 EM S诱变
称种子0.2 g(约10 000颗)封于透水袋中,浸于0.15%吐温中15 min,间或轻轻摇动使种子被充分浸润.取装有种子的小袋,置于15 mL重蒸水中,加15~45μL的 EM S原液至终浓度0.1%~0.3%(v/v)混匀.室温下,于脱色摇床上避光8~12 h,取出装有种子的小袋,以重蒸水洗涤种子一次,再将种子浸在10 mL重蒸水中2~4 h,或以清水缓缓冲洗2~4 h,将处理好的种子播种于土壤中.
1.2.3 Ac/uro纯合植株的获得
将含有纯合 Ac基因的野生型L er(由 Prof M a Hong提供)与 uro杂交,获得 F1代,F1代中URO基因和Ac基因都是杂合的,种植 F1代,单收 F2代,继续种植 F2代,要单收 F2代中 uro表型植株的种子,继续种植F3代,每个株系至少种植20棵,提取 F3代中全是 uro突变体表型株系的、至少16棵单株的DNA,用PCR的方法检测是否有 Ac基因存在,如果所有单株中都有Ac存在,就说明该株系植株的 Ac基因是纯合的,那么该株系的种子就是Ac/uro纯合的植株.
1.2.4 PCR
聚合酶链式反应(Polymerase Chain Reaction),简称 PCR.PCR程序:①94℃3 min,②94℃30 s,③56℃30 s(55℃30 s),④72℃30 s(72℃45 s),⑤30个循环从②到④,⑥72℃10 min.
2 结果和分析
2.1 回复子的筛选
uro突变体带有顶端优势丧失,叶形较圆,茎、花序、花和果实等都有发育缺陷,幼苗时期子叶上竖等特征.针对 uro突变体的这些形态特征,确定以下筛选标准,包括:顶端优势(较为)明显,各器官发育正常,幼苗时期子叶发育正常等.
种子经EM S处理后,其基因突变大部分只发生于同源染色体的一条上,对于隐性基因来说,在这一代(M 1)植物上观察不到表型的变化,再加之 uro突变体是半显性突变体,所以,必须将此代单收的种子(M 2)再播种下去,这样才能获得纯合双突变的植株.诱变 uro突变体的种子,单收得到1 000株M 1代,继续种植M 1代,观察M 2代表型分离情况.
利用Ac/Ds转座子系统筛选回复子,首先要保证筛选库的群体是Ac/uro纯合的植株.在获得这个筛选库的过程中,选用PCR的方法来验证uro表型植株的Ac基因是否纯合,提取F3代中全是 uro表型株系中的,16棵单株的DNA,用PCR的方法验证 Ac基因是否存在,如果所有单株中都有 Ac基因存在,就都有条带扩增出来,说明该株系植株的 Ac基因是纯合的;而没有Ac基因的野生型则没有条带扩增出来.这样就可以保证该株系是 Ac/uro纯合植株.如图1.
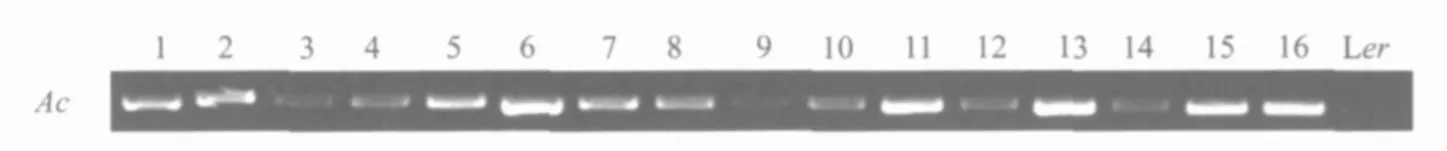
图1 Ac基因纯合验证Fig.1 Identification of Ac homozygous gene
种植 Ac/uro纯合植株,单收F1代的种子,F1代有可能是 uro突变体背景,而另外的不明突变位点杂合的植株,之后要再继续种植单收的F1代,在F2代看到有表型的双突变,从而获得双突变植株.
2.2 回复子的形态特征
利用以上两种筛选策略,获得了一些回复子.其中部分回复程度比较明显,被重点研究.回复子1是通过 EM S诱变筛选得到的,它最典型的回复表型是侧枝明显减少,部分回复顶端优势.与 uro突变体相比,回复子1具有以下形态特征:(1)具有比较明显的顶端优势,但还没有回复到野生型的状态;(2)侧枝显著减少,uro突变体的侧枝非常多;(3)叶片稍长且不平整,而 uro的叶片则呈圆形,且有叶裂;(4)果荚发育正常,较 uro大;(5)花瓣和野生型大小差不多,比 uro突变体大;(6)花发育正常,与 uro的花大小一样;(7)种子发育正常,饱满且颜色较 uro突变体淡,而 uro突变体的种子颜色较深,还有一些种子发育不饱满.
引理3[12] 令是的一组基,如果存在{w1,w2,…,wnk}⊆使得〈vi,wj〉n=δij,i,j=1,2,…,nk,Gk=span{w1,w2,…,wnk} 也是Rk在中的一个补空间.
回复子2是通过Ac/Ds转座子系统筛选得到的,其最典型的回复表型是具有野生型表型.与 uro突变体相比,回复子2具有以下形态特征:(1)具有明显的顶端优势,几乎回复到野生型的状态;(2)无侧枝出现,与野生型相同;(3)叶片比 uro突变体略大,较平整,呈圆形,uro突变体有叶裂;(4)果荚发育正常,比 uro突变体的长;(5)花瓣比 uro突变体和野生型的都大;(6)花比 uro突变体和野生型的都大;(7)种子发育正常,饱满且颜色较 uro突变体深,而uro突变体的种子颜色较浅,有些种子发育也不饱满.
回复子1和2的表型具体见图2,表1.2.3 回复子uro突变体背景验证
在筛选过程中,有时会遇到偶然飘落到种植盆中的其他来源的种子,其表型大部分近似于野生型,很可能会被当成回复子收获.为避免这种情况发生,结合 uro突变体的特点,用PCR的方法来鉴定,确保该回复子是从 uro突变体的背景下获得的.
uro突变体是由 T-DNA插入URO基因的启动子区造成的,通过设计两套引物进行PCR反应来验证回复子的 uro突变体背景.首先,在位于URO基因的启动子区,靠近 TDNA右臂,远离URO基因的编码区设计引物P1;在 T-DNA左臂上,邻近URO基因的编码区的位置设计引物P2,在位于URO基因的编码区终止部位设计引物P3.如图3.
首先,以回复子基因组DNA为模版,用P2与 P3为引物进行PCR,若有阳性条带则说明该植物中含有插在URO基因上游的T-DNA,若没有阳性条带则说明该植物就是野生型背景;其次,以回复子基因组DNA为模版,用引物 P1与 P3进行 PCR,如果有阳性条带,则证明该植物至少有一条染色体具有野生型背景,没有阳性条带则说明P1与P3之间有 TDNA插入;只有当用P2与P3得到阳性条带,而P1与P3没有阳性条带时,该植物才是 uro突变体背景的.
分别提取回复子1和2的DNA,作为模板,用引物P1,P2分别和 P3配对进行 PCR扩增,结果显示,P1和P3配对扩增不出条带,而 P2和 P3配对扩增出条带,回复子1和2的PCR结果和阳性对照uro的PCR结果一致,如图4,证明回复子1和2都是uro突变体背景的.
3 讨 论
本实验用拟南芥 uro突变体为材料,用EM S诱变和 Ac/Ds转座子系统这两种方法筛选uro突变体的回复子.结果表明,这两种方法都是有效可行的,但各有优缺点.
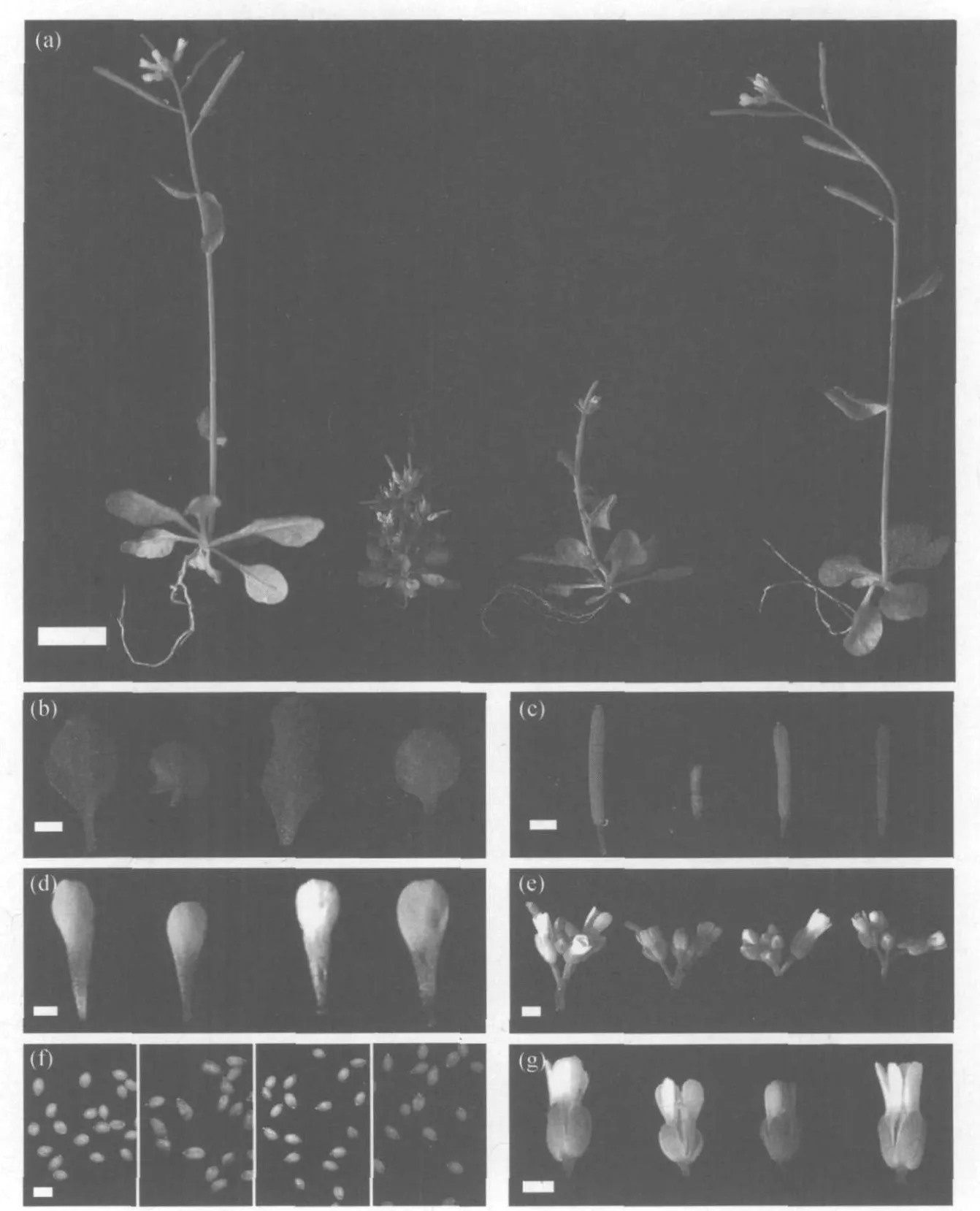
图2 回复子的形态特征Fig.2 The pheno type of supp resso rs
注: (a)L er(左1),uro(左2),回复子1(右2)和回复子2(右1)的整体形态特征,Bar=1 cm;
(b)L er(左1),uro(左2),回复子1(右2)和回复子2(右1)的叶子,Bar=2.5 mm;
(c)L er(左1),uro(左2),回复子1(右2)和回复子2(右1)的果荚,Bar=2 mm;
(d)L er(左1),uro(左2),回复子1(右2)和回复子2(右1)的花瓣,Bar=0.5 mm;
(e)L er(左1),uro(左2),回复子1(右2)和回复子2(右1)的花序,Bar=1 mm;
(f)L er(左1),uro(左2),回复子1(右2)和回复子2(右1)的种子,Bar=0.5 mm;
(g)L er(左1),uro(左2),回复子1(右2)和回复子2(右1)花,Bar=0.75 mm

表1 回复子的形态特征Tab.1 The pheno type of supp resso rs
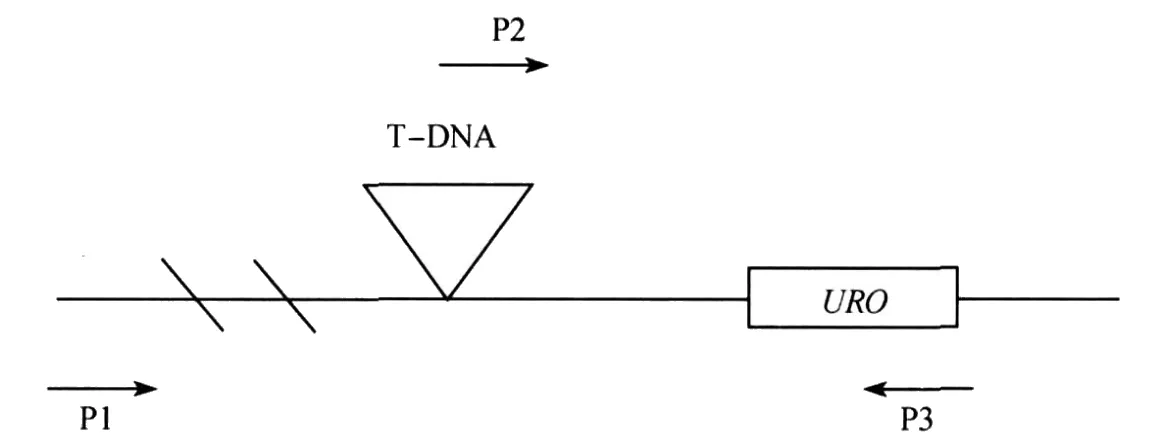
图3 引物位置Fig.3 The location of the p rimers

图4 uro突变体背景鉴定Fig.4 Identification of uro background
Ac/Ds转座子系统:前期准备工作时间长,在获得 Ac/uro纯合的植株后,也要种植两代才能获得有表型的双突变.双突变植株与其相应背景的野生生态型杂交,后代表型分离获得单突变.利用TA IL-PCR和图位克隆这两种方法都可以克隆相关的突变基因.获得 Ac/uro纯合植株的筛选库之后,在种植的过程中,除了找有表型的双突变以外,还要单收每一代uro表型植株的种子,作为后续的筛选库.这样,就会有更多的后备筛选植株.
针对本实验,利用Ac/Ds转座子系统的方法筛选uro突变体的回复子要更好一些.因为 uro就是 T-DNA插入获得的突变体,而且该 T-DNA上还具有Ds元件,完全符合筛选条件,而且利用TA IL-PCR的方法可以在短时间内克隆到相关突变基因.如果是单纯的诱变野生型获得突变体的话,EM S诱变是最佳之选.
在实验过程中,利用PCR的方法验证Ac基因是否纯合和回复子是否是uro突变体背景,从分子角度证明筛选得到的回复子的真实可靠性,不用通过费时的遗传分析来证明,大大节省了实验时间和人力资源.
现在获得突变体的方法有很多,但是应用最多的就是 T-DNA插入.T-DNA具备以下优点:可装载大到50 kb的外源DNA;可随机地整合且在表达活跃区域的整合几率较高[8];其整合不引起植物基因组大的重排[9];对特定的基因类别没有明显的插入偏向性[10],因此,在植物基因工程和基因克隆中被广泛应用.如果在构建 T-DNA的同时,在 T-DNA上插入Ds元件的话,对今后利用 Ac/Ds转座子系统筛选回复子是很有利的,而且只要发现某个突变性状与插入的 T-DNA共分离,就很容易分离出 T-DNA侧翼的基因组序列,为今后的基因克隆节省了大量时间.
利用以上两种方法,筛选到一些uro突变体的回复子,这些回复子可育并稳定遗传.值得注意的是,这些回复子的表型不尽相同,表型回复的程度也不一样,暗示URO基因的下游包括了比较复杂、多元的信号因素,不同的回复子可能代表了该调控网络的不同分支.为今后研究URO基因的作用机制及其所参与的遗传途径,弄清楚URO基因可能对生长素信号系统的调控作用,确定URO基因在整个基因网络中的位置奠定了良好的基础.
[1]M EINKED W,CHERRY J M,DEAN C,et al.A rabidopsis thaliana:a model plant for genome analysis[J].Science,1998,282(5389):662,679-682.
[2]SUN Y,ZHANGW,L IFL,et al.Identification and geneticmapping of four novel genes that regulate leaf development in A rabidopsis[J].Cell Res,2000,10(4):325-335.
[3]GUO Y,YUAN Z,SUN Y,et al.Characterizations of the uro mutant suggest that the URO gene is involved in the auxin action in A rabidopsis[J].Acta Bot Sin,2004,46:846-853.
[4]ZHENG Y,XUAN Y,ZHANGD B,et al.Genome-w ide exp ression p rofiling in seedlingsof the A rabidopsis M utant uro that is defective in the secondary cell wall formation[J].J Integr Plant Biol,2007,49(12):1754-1762.
[5]周薇,唐洪波,孙越.拟南芥生长素相关突变体uro的光依赖性乙烯信号异常[J].植物生理与分子生物学学报,2007,33(4):277-284.ZHOU W,TANG H B,SUN Y.Light-dependent ethylene signal abnormality of the A rabidopsis auxin-related uro mutant[J].Journal of Plant Physiology and Molecular Biology,2007,33(4):277-284.
[6]刘祖洞.遗传学[M].北京:高等教育出版社,1991.L IU ZD.Genetics[M].Beijing:Higher Education Press,1991.
[7]ZHANG S,RA INA S,L IH,et al.Resources for targeted insertional and deletionalmutagenesis in A rabidopsis[J].Plant Mol Biol,2003,53(1-2):133-150.
[8]KONCA C,MARTIN IN,MA YERHOFER R,et al.High frequency T-DNA mediated gene tagging in plants[J].Proc Natl Acad Sci USA,1989,86(21):8467-8471.
[9]GHEYSEN G,V ILLARROEL R,VAN MONTAGU M.Illegitimat recombinationin plants:amodel for T-DNA integration[J].Genes Dev,1991,5(2):287-297.
[10]ALONSO J M,STEPANOVA A N,LEISSE T J,et al.Genome-w ide insertional mutagenesis of A rabidopsis thaliana[J].Science,2003,301:653-657.
Screen ing the suppressors of uro by EMSmutagenesis and Ac/Ds transposon system
ZHANG Liang, YANG Yang, SUN Yue, XU Yan-fei, YU Chen,ZHOU Wei, TANG Hong-bo, L IXiao-fang
(School of L ife Science,East China N ormal University,Shanghai 200062,China)
Q948
A
1000-5641(2010)04-0085-07
2009-04
863项目(2006AA10Z109);国家自然科学基金面上项目(30570159)
张亮,女,硕士研究生.E-mail:zhangliang@shsm u.edu.cn.
孙越,女,副教授,研究方向为植物发育与分子生物学.E-mail:ysun@bio.ecnu.edu.cn.

