Hrad17在头颈肿瘤中表达下降的研究
赵 明,陈 鸥,金春顺,程鹤香,徐艳霞
(吉林大学第二医院耳鼻咽喉科,吉林长春 130041)
Hrad17在头颈肿瘤中表达下降的研究
赵 明,陈 鸥,金春顺*,程鹤香,徐艳霞
(吉林大学第二医院耳鼻咽喉科,吉林长春 130041)
目的DNA损伤修复基因在维持细胞稳定性的作用及头颈肿瘤表现染色体不稳定性研究。方法应用基因表达芯片在7例头颈肿瘤和6例正常口腔粘膜中筛查表达下调的基因,用实时定量RT-PCR证实基因芯片的结果,蛋白印迹检测蛋白表达,定量PCR检测其DNA拷贝数。结果Hrad17是发现下调的基因之一,Z-score和倍数变化分别为-2.5和0.39,定量RT-PCR显示肿瘤组织中Hrad17 mRNA表达下降,均值为0.2166,而正常粘膜为0.3957(P<0.05)。Western印迹显示Hrad17蛋白在肿瘤组织中检测不到(0/12),而在正常口腔粘膜组织中表达很强(6/7)。定量PCR显示Hrad17DNA在大多数头颈肿瘤组织中下降。结论Hrad17表达的缺失经常出现在头颈鳞癌中,由于基因的缺失并可能导致头颈鳞癌基因组的不稳定性,导致肿瘤发生。
头颈肿瘤;Hrad17;染色体不稳定性
(Chin J Lab Diagn,2010,14:1380)
细胞通过激活高度协调的DNA损伤反应系统以应答DNA损伤,DNA损伤和检查点基因通过激活DNA修复途径,使细胞周期停止和细胞凋亡帮助维持基因组的稳定性并防止肿瘤发生。大部分头颈鳞状细胞癌(HNSSC)的发生与长期接触烟酒有关,这些外部DNA损伤剂可加速基因组改变,特别是在DNA修复功能受损的情况下。
近年研究发现哺乳动物细胞中,蛋白激酶ATM/ATR是DNA损伤应答通路关键成分,最早参与应答双链DNA断裂(DSBs),作为检查点激酶级联信号的起始激酶激活下游目标,而Hrad17正是这些关键激酶的底物。Hrad17与其他蛋白形成复合物在损伤的DNA部位形成夹子结构使ATM/ATR识别它们以全面激活DNA损伤反应。
Hrad17作为DNA损伤检查点基因可能是一个潜在的肿瘤抑制基因,其功能的缺失或异常的表达可能参与肿瘤的发展。本实验发现Hrad17表达下降和缺失,并且其DNA拷贝数下降或纯和性缺失。因此,Hrad17在HNSSC中是失活的,在引起基因组不稳定性方面起重要作用从而导致HNSSC发生[1-6]。
1 材料与方法
1.1 基因鉴定 Affmetrix基因表达芯片(Affymetrix,Santa Clara,美国)被用于进行基因筛查。6个正常口腔黏膜和7个侵袭性头颈肿瘤组织的cDNA与包含12000个基因的芯片杂交。用SNOMAD和SAM软件进行分析,每个样品的最终值Z-score表示,发现Hrad17是数据中的下调基因之一。
1.2 定量RT—PCR 用来自相同病人的mRNA样品做实时定量RT-PCR以检测Hrad17的表达水平。肿瘤位置包括咽(2/7),口腔(4/7),和喉(1/7)。肿瘤组织均在液氮速冻后在-80℃保存。引物和探针由Probe Express软件(Applied Biosystems,美国)设计。The Hrad17正向引物是 5'-AGCGAGAAAAAGAGGAAATC-3',反向引物是 5'-TGCCTTTCTAAAACTTGAGC-3',由 Invitrogen公司合成。Taqman探针序列是5'-6FAM TCAGCATGAACTTGCTGTGCA TAMRA-3',由 Applied Biosystems(Foster City,美国)合成。β-actin正向引物序列是5'-TCACCCACACTGTGCCCATCTACGA-3',反向引物是5'-TCGGTGAGGATCTTCATGAGGTA-3',探针是 5'-6FAM ATGCCCTCCCCCATGCCATCCTGCGT TAMRA-3',应用一步反应法:50℃35分钟合成cDNA,95℃变性5分钟,PCR扩增95℃15秒,55℃1分钟,共45个循环。RT-PCR是用ABI PRISM 7900HT序列检测系统。每个样品重复3次。
1.3 Western blot分析 从12个冰冻的头颈肿瘤组织和7个正常上皮组织中提取蛋白,检测Hrad17的蛋白表达。肿瘤部位包括咽(3/12),喉(3/12)和口腔(6/12)。肿瘤组织保存方法同上。从上述样本中用TRIzol分离沉淀了DNA和RNA后,从苯酚-酒精上清液中提取蛋白。每个蛋白样品取50 mg置于10%SDS-PAGE胶中,并在120v下电泳90 min,蛋白条带在50v被转到PROTRAN膜上1 h,该膜在5%的脱脂奶中室温下摇晃阻滞1 h,在膜上覆盖1∶500稀释的鼠抗人Hrad17单克隆抗体(Santa Cruz Biotechnology,美国)4℃过夜,然后与辣根过氧化物标记的马抗鼠IgG(Amersham Biosciences,英国)室温下孵育1 h,抗体结合物室温下结合化学发光物(Amersham Biosciences,英国),然后在X线片上曝光可见。然后PBS洗掉印记,加鼠抗人β-actin抗体1∶3 000稀释,检测方法同前。
1.4 定量PCR 随机选取Hrad17内含子序列并设计正向和反向引物(5'-CCAAATTGGGTAGAAGGTACA-3',和 5'-AACGGGAGAAGGCTATGC-3')和Taqman 探针(5'-6FAM TACCTCATATCCCCTGCCCCAACACA TAMRA-3')用实时定量PCR检测DNA的拷贝数。同时设计了一套GAPDH的引物和探针以标准化Hrad17的拷贝数。(正向引物5'-GGCCGCCATGTTGCAA-3',反向引物 5'-CAGGAGCGCAGGGTT AGTCA-3',Taqman探针(5'-6FAMATGAATGGGCAGCCGTT AGGAAAGCC TAMRA-3')。DNA样品均来自经显微切除的肿瘤组织和配对的正常的外周血淋巴细胞DNA。PCR扩增95℃2分钟,然后95℃15 s,60℃1 min,共50个循环。所有的定量 PCR均用ABI PRISM 7900HT序列检测系统(Applied Biosystems,美国)完成。每个样品重复3次。
2 结果
2.1 基因表达芯片 用HU95A.V2基因芯片,在7个原发头颈肿瘤组织,6个正常组织的cDNA中筛查了超过12000个基因,SNOMAD和SAM软件用来做统计分析。结果显示与正常的上皮组织相比很多基因在头颈肿瘤组织中表达下降,包括DNA损伤检查点基因和修复基因,其中下降明显的有Hrad17,在头颈肿瘤组织中,它的 Z-score和倍数变化分别是-2.5和0.39。图1中正常粘膜除一例外均大于1,而肿瘤组织除2例均小于1,而其中P2291的值仅为0.04,可以考虑为0,数据显示肿瘤组织的表达大部分为下降。
2.2 定量RT-PCR检测Hrad17mRNA表达 采用相同的标本行RT-PCR以验证基因芯片的结果,Hrad17的 mRNA表达结果用β-actin来标准化。Hrad17与β-actin的表达比率作为相对定量Hrad17的mRNA表达。这个结果与基因芯片的结果一致,正常上皮组织中的Hrad17的表达高于头颈肿瘤组织,中位数分别为0.396和0.2166,图2肿瘤组中的表达结果明显低于正常组,大约是正常组的一半。
2.3 Western blot印迹检测Hrad17蛋白表达 为了进一步检测蛋白表达水平,选择了12个头颈肿瘤和7个正常咽喉粘膜标本。图3蛋白印迹的结果显示所有肿瘤组织检测不到或只能检测到非常弱的条带。而所有正常组织(除了N2805)均检测到很强的条带,值得注意的是,这个没有检测到Hrad17的样本的β-actin表达也非常弱。
2.4 定量PCR检测Hrad17拷贝数 为了进一步探讨头颈肿瘤hrad17表达下降的原因,选择 9个Hrad17蛋白低表达的肿瘤标本,随机选取一段内含子行定量PCR扩增,检测9个肿瘤样本和配对的正常DNA拷贝数,所有样本均用GAPDH标准化。Hrad17与GAPDH扩增量的比率被认为是Hrad17的相对定量DNA拷贝数。图4所示为在经正常配对的外周血DNA标准化之后的Hrad17DNA拷贝数,比率是1,说明正常和肿瘤有相同的Hrad17拷贝数,9例中有7个(78%)显示Hrad17拷贝数小于1,只有2例显示比率高于1(1.46和1.27)提示可能获得的Hrad17的拷贝数。肿瘤样本DNA拷贝数的中位值是0.55,说明大部分肿瘤组织丢失了近一半的Hrad17 DNA拷贝数。4例样本Hrad17的比率低于0.5,其中一例是0.15,因此,说明Hrad17的杂合性缺失与其表达降低相关,至少1例显示Hrad17拷贝数与纯合性缺失有关。
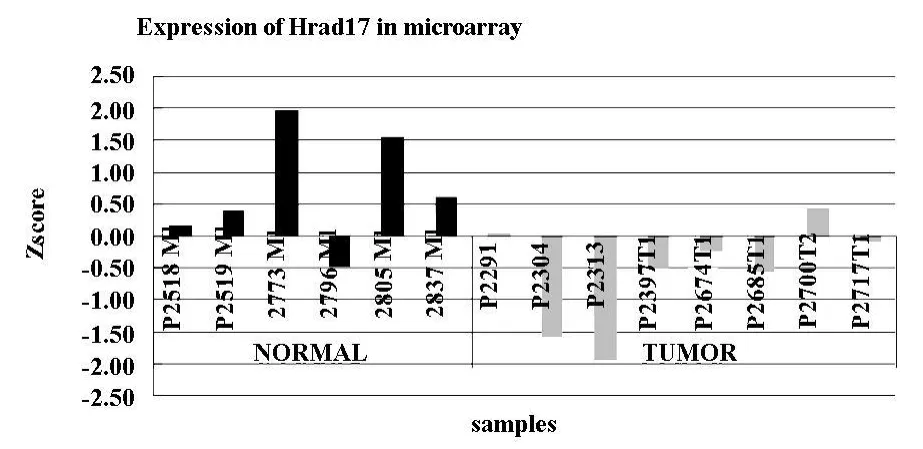
图1 头颈肿瘤和正常上皮粘膜Hrad17基因表达芯片的结果

图2 定量RT-PCR二者的Hrad17mRNA表达结果比较

图3 Western blot两组的Hrad17蛋白表达结果的比较

图4 定量PCR头颈肿瘤的DNA拷贝数
3 讨论
机体通过诱导细胞周期停止以应答DNA损伤从而保持基因组的稳定。有缺陷的细胞周期检查点和受损的DNA修复途径可以导致基因组不稳定性,并导致正常细胞的恶性转化到癌细胞。癌细胞具有的明显的基因组不稳定性反映了细胞周期检查点或DNA修复能力的缺陷并导致基因突变积累是重要的致癌因素。细胞周期检查点应答DNA损伤的活性是维持基因组稳定性和肿瘤抑制的要素。
人Hrad17作为S.pombe rad17检查点基因的同源物被鉴定出来。虽然Hrad17的作用还不完全清楚,它在酵母检查点蛋白的同源物提示它在细胞周期调控中起作用。ATM/ATR作为应答DNA双链损伤(DSBs)的感受器被激活,启动一系列磷酸化级联反应,使Hrad17被ATM/ATR磷酸化并结合于染色体,募集检查点蛋白复合物在DNA受损部位以修复损伤,Hrad17磷酸化对于DNA损伤诱导的G2期停止是必需的,从而使细胞进入有丝分裂之前有充足的时间来修复系统纠正错误,避免它们被传到下一代[1-5,11]。
本研究应用定量RT-PCR显示与正常上皮组织相比Hrad17在原发头颈肿瘤组织中下调,而且头颈肿瘤的mRNA表达水平几乎是正常上皮细胞的一半。值得注意的是,用于分析的样本虽然经过显微切除,肿瘤组织仍可包含多达30%的正常间质细胞。可以推断肿瘤组织中的实际mRNA水平低于实际所观察到的。进一步的头颈肿瘤组织的蛋白表达分析显示Hrad17蛋白水平是观察不到或缺失的,而正常组织显示了强表达。
Hrad17是位于染色体5q12-13.1,在头颈肿瘤和其他类型肿瘤这个位点经常表现为缺失,提示有肿瘤抑制基因存在于这个染色体臂上。
应用定量PCR检测Hrad17随机的内含子序列相对于看家基因的扩增量以判断Hrad17拷贝数。Hrad17DNA拷贝数的大部分低于1,中位数是0.55,拷贝数是低于0.2的肿瘤样本可能是Hrad17纯合性缺失。
综上所述,这些数据表明Hrad17在原发头颈鳞状细胞癌是失活的,虽然本研究的数据说明在小部分肿瘤中显示纯合性缺失,这些机制尚不足以解释所观察到的肿瘤组织的蛋白表达缺失,可能同时还有其他的失活机制,包括翻译后机制和导致蛋白降解的机制等,还有启动子甲基化可能导致转录沉默。
Hrad17序列的改变也在其他肿瘤细胞系中发现,比如:结肠癌,视网膜母细胞瘤细胞系和肺癌细胞系。突变也可能导致Hrad17表达缺失。
虽然本文显示在头颈肿瘤中Hrad17表达缺失或下降,在睾丸肿瘤中也有同样报道。有些报道显示Hrad17在肺,结肠和乳腺癌中过表达,可能是由于诱导产生Hrad17以应答在实体瘤中经常发生的DNA损伤。头颈肿瘤是已知显示了严重的染色体不稳定性的表型,并且Hrad17表达的缺乏将直接的导致这个表型的发展[6-11]。
作为DNA损伤检查点基因,Hrad17被磷酸化对于启动DNA损伤的检查点反应是必需的[1-3,11]。因此,Hrad17可能参与DNA修复合成和介导细胞周期调节。Hrad17缺乏会危害对损伤的DNA起相应反应的检查点途径。细胞缺乏Hrad17基因不但导致积累DSBs,也使细胞染色体以高速率复制,因此我们强调Hrad17在阻止癌细胞中经常出现的染色体畸变的重要性。这个途径的障碍可能构成癌症发生的一个关键的转折点,检查点基因的突变或缺失将产生更多突变,导致基因组不稳定性。结合上述数据,Hrad17基因表达缺失可能是导致头颈肿瘤基因组不稳定性的因素。
[1]Sancar A,Lindsey-Boltz LA,Unsal-Kaccmaz K,et al.Molecular mechanisms of mammalian DNA repair and the DNA damage checkpoints[J].Annu Rev Biochem,2004,73:39.
[2]PryorWA.Cigarette smoke radicals and the role of free radicals in chemical carcinogenicity[J].Environ Health Perspect,1997,105(Suppl 4):875.
[3]Masayesva BG,Ha P,Garrett-Mayer E,et al.Gene expression alterations over large chromosomal regions in cancers include multiple genes unrelated to malignant progression[J].Proc Natl Acad Sci U S A,2004,101:8715.
[4]Griffiths DJ,Barbet NC,McCready S,et al.Fission yeast Hrad17:a homologue of budding yeast RAD24 that shares regions of sequence similarity with DNA polymerase accessory proteins[J].EMBO J,1995,14:5812.
[5]von Deimling F,Scharf JM,Liehr T,et al.Human and mouse HRAD17 genes:identification,localization,genomic structure and histological expression pattern in normal testis and seminoma[J].Hum Genet,1999,105:17.
[6]Minhas KM,Singh B,Jiang WW,et al.Spindle assembly checkpoint defects and chromosomal instability in head and neck squamous cell carcinoma[J].Int J Cancer,2003,107:46.
[7]Abraham RT.Cell cycle checkpoint signaling through the ATM and ATR kinases.[J].Genes Dev,2001,15:2177.
[8]Wang X,Zou L,Zheng H,et al.Genomic instability and endoreduplication triggered by HRAD17 deletion[J].Genes Dev,2003,17:965.
[9]Bric A,Miething C,Bialucha CU,et al.Functional identification of tumorsuppressor genes through an in vivo RNA interference screen in a mouse lymphoma model[J].Cancer Cell,2009,16(4):324.
[10]Beretta GL,Gatti L,Cesare MD,et al.The human homolog of fission yeast Hrad17 is implicated in tumor growth[J].Cancer Lett,2008,266(2):194.
[11]Yang XH,Zou L.Recruitment of ATR-ATRIP,Hrad17,and 9-1-1 complexes to DNA damage[J].MethodsEnzymol,2006,409:118.
Study on Decrease in Hrad17 Expression in Head and Neck Squamous Carcinoma
ZHAO Ming,CHEN Ou,JIN Chun-shun,et al.(The Second Hospital of JilinUniversity,Dept.of Otolaryngology,Jilin Changchun130041,China)
ObjectiveDNA repair genes play a critical role in maintaining gene stability.Significance of head and neck squamous cell carcinoma(HNSCC)shows chromosomal instability.MethodsMicroarrays was applied to 7 samples of primary HNSCC and 6 samples of normal control oral epithelial tissue.Additional confirmationwas performed by quantitative RT-PCR in these samples and followed by western blot,quantitative PCR at the Hrad17 locus.ResultsHrad17wasone of the downregulated checkpoint genes in primary head and neck tumor tissue.Its Z-score and fold changewere-2.5 and 0.39,respectively.The resultsof normalized,quantitative RT-PCR showed decreasedexpression of Hrad17mR NA in tumor tissue(mean value 0.2166)when comparedwith normal tissue(mean value 0.3957,p<0.05).Western blot demonstrated undetectable expression of Hrad17 protein in primary tumor tissue(0/12),while there was strong expression of Hrad17 protein in normal oral mucosal tissue(6/7).Quantitative PCR showed that Hrad17 DNA copy number was decreased in the majority of head andneck tumor tissue samples.ConclusionLoss of Hrad17 expression occurs frequently in HNSCC,is often due to genomic deletion,andmay facilitate genomic instability in HNSCC and carcinogenesis.
head and neck cancer;Hrad17;chromosomal instability
R739.91
A
1007-4287(2010)09-1380-04
本课题为长春市科技局资助项目(2008117)
*通讯作者
2010-04-29)

