AKT1基因PH结构域在亚洲胃肠道肿瘤中的变异研究
李玉琴,孙泯丹,李丽娜,田中康雄,小俣政男
(1.吉林大学白求恩第一医院,吉林长春 130021;2.日本东京大学医学研究系消化内科)
AKT1基因PH结构域在亚洲胃肠道肿瘤中的变异研究
李玉琴1,孙泯丹1,李丽娜1,田中康雄2,小俣政男2
(1.吉林大学白求恩第一医院,吉林长春 130021;2.日本东京大学医学研究系消化内科)
目的 分析AKT1基因PH(the p leckstrin homology,PH)结构域第4外显子的碱基序列,探讨中国人和日本人AKT1基因突变与胃肠道肿瘤的关系。方法采用激光显微切割技术捕获胃癌组织和大肠癌组织的肿瘤细胞,以这些标本的基因组DNA为模板,用聚合酶链反应PCR方法扩增AKT1基因PH结构域,PCR产物经纯化后直接测序。结果
分析测序图发现AKT1基因PH结构域第4外显子第49核苷酸没有出现点突变。结论中国人和日本人的胃肠道肿瘤的AKT1基因PH结构域没有出现点突变,与胃肠道肿瘤发生发展关系不大。
AKT1基因;激光捕获显微切割;胃癌;大肠癌;突变
(Chin J Lab Diagn,2010,14:1173)
AKR小鼠T细胞淋巴瘤癌蛋白(AKRmouse T-cell lymphoma oncoprotem,AKT)属于丝氨酸/苏氨酸蛋白激酶类,是PI3K/AKT细胞信号通路中的重要成员之一,在调控细胞生存和凋亡的平衡中发挥重要作用。该蛋白激酶催化不同的底物,发挥促进细胞生长、增殖、存活、代谢等作用,与肿瘤的发生发展密切相关[1]。最近人类肿瘤基因组学研究表明,在多数人类肿瘤中PI3K通路的许多成员都发生了种系突变或体细胞突变。最近在黑色素瘤、乳腺癌、结肠直肠癌及卵巢癌中发现有AKT1的PH(the pleckstrin homology,PH)结构域活化突变E17K,导致细胞膜病理性的异常活化,促进细胞生长、增殖[2]。为了进一步确定AKT1基因PH结构域的突变在亚洲消化道肿瘤患者中的突变情况。本研究选取了部分中国和日本的消化道肿瘤患者进行研究,探讨亚洲人消化道肿瘤的发病机制是否与AKT1基因pH结构域突变相关。
1 材料和方法
1.1 材料
1.1.1 胃癌、结直肠癌组织由日本东京大学及吉林大学白求恩第一医院提供。AKT1基因PH结构域E17K突变的DNA由Dr.Kerry L.Blanchard提供。
1.1.2 材料和仪器 ABIAmpliTaq Gold○RDNA 聚合酶、DNA凝胶提取试剂盒、BigDye Terminator测序试剂盒购自App lied Biosystems公司;QIAamp DNA Mini kit购自QIAGEN公司,其他分子生物学试剂购自Takara公司。
1.1.3 引物序列 引物由Takara公司合成.AKT1的PH结构域的引物如下P1:上游引物5′-ACA TCT GTC CTG GCA CAC-3′,P2:下游引物 5′-GCC AGT GCT TGT TGC TTG-3′,扩增片段为 220 bp。以GAPDH作为外参照:GAPDH的引物如下P3:上游引物5′-CCA CCA TGG CAA ATT CC-3′,P4:下游引物5′-TGGGAT TTC CAT TGA TGA CAA G-3′,扩增片段为200 bp。测序引物为 P5 5′-ATC CCG AGA GGC CAAGGGGA-3′。
1.2 方法
1.2.1 选取2007-2008年吉林大学第一医院病理科保存的60例胃癌和66例结直肠癌患者的石蜡包埋组织块和日本东京大学病理科保存的42例胃癌和64例结直肠癌患者的石蜡包埋组织块。所选病例手术前均未经化疗。每例病理标本由资深临床病理医师阅片核对后选取。患者的一般情况、病理类型见表1。

表1 胃癌和结肠癌患者的一般情况及病理类型
1.2.2 激光捕获显微切割(Laser Capture microdissection,LCM)及提取基因组DNA为了从用福尔马林固定,石蜡包埋(formalin-fixed paraffin-embedded,FFPF)的临床样本中提取基因组DNA,样本被切成厚度为10um的切片。切片用苏木素染色用于组织学检查。为了避免肿瘤和非肿瘤细胞间的混淆,我们采用LM200型LCM系统(日本Olympus/美国A rcturus EngineeringInc)对所有的FFPE样本进行了激光捕获显微切割,安置已染色的FFPF切片和收集管,在合适的放大倍数下选择目的细胞,用鼠标勾画选择的目的细胞,根据视野、放大倍数和目的细胞分布等调整激光孔径、速度及强度,切割癌细胞至收集管中。FFPE组织的基因组DNA用QIAamp DNA Mini kit提取。
1.2.3 PCR扩增及测序 取FFPE组织的基因组DNA 55 ng,加入 1 μM 的引物 P1、P2,0.25mMdNTPs,1XPCR 缓冲液,2.5UAmpliTaq Gold○RDNA聚合酶,行PCR反应,预期扩增片段为220 bp。并以GAPDH作为外参照:以 P3、P4为引物,并加入基因组DNA行PCR反应,预期扩增片段为200 bp。PCR反应条件如下:94℃5min;96℃30 s,57℃30 s,72℃30 s,30个循环;72℃10min。扩增产物用1%琼脂糖凝胶进行电泳,阴性的进行二次PCR。阳性对照为由Dr.Kerry L.Blanchard提供的有AKT1基因PH结构域E17K突变的DNA,阴性对照为双蒸水。DNA凝胶提取试剂盒回收纯化的 PCR产物。使用ABI 3730xl DNA测序仪进行正向直接测序。
2 结果
2.1 PCR方法检测结果激光捕获显微切割所收集的胃癌、结直肠癌组织共计232个样本,对所有样本进行PCR检测,结果均显示大小约220 bp的特异性条带,说明所有胃癌和结直肠癌患者的基因组中均有不同程度的AKT1基因的表达,我们展示了其中18例患者肿瘤组织的AKT1及GAPDH的PCR结果。(如图1)。
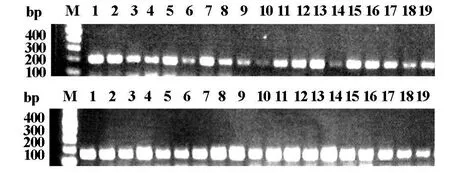
图1 AKT基因PH结构域第4外显子扩增结果
2.2 PCR产物进行测序测序结果发现待测胃癌和结直肠癌组织基因组DNA的AKT1位点均未出现如文献报道的与欧美患者相同的点突变,即AKT1基因的PH结构域第4外显子第49核苷酸均为G;而阳性对照的第49核苷酸为A/G,结果显示:共计232例中国人和日本人的胃癌和结直肠癌患者的AKT1基因的PH结构域均无点突变(图2)。
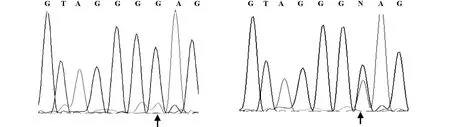
图2 AKT1基因的PH结构域测序结果
3 讨论
PI3K/AKT信号传导通路活化可以抑制多种刺激诱发的细胞凋亡,促进细胞周期进展,从而促进细胞的生长和增殖,同时参与血管新生,在肿瘤的形成中扮演重要角色,并参与肿瘤的侵袭和转移[3]。据报道PI3K/AKT信号传导通路异常活化与许多恶性肿瘤如胃癌、结肠癌,乳腺癌和卵巢癌的发生发展相关[4]。很多研究表明,PI3K通路的许多成员包括PI3KCA、PTEN、AKT在恶性肿瘤的殖及转移过程中都发生了种系突变或体细胞突变,参与了肿瘤的增殖和转移。当发生包括PIK3CA或PTEN突变表达过量等信号通路组分异常表达时,PI3K-AKT信号传导通路出现异常的调控反应[5-8]。AKT在肿瘤细胞中处于高度激活状态,也会发生突变影响细胞增殖,Parson等人研究证实AKT基因在催化领域的340丝氨酸/苏氨酸激酶有基因的突变。AKT2基因的突变在大肠癌的检出率为1.0%(2/204),不过其突变的生理意义尚不清楚[9]。除了这个AKT2的激酶结构域突变AKT1基因pH结构域,外显子4的核苷酸49发生点突变,G变成A,这导致了在赖氨酸取代谷氨酸赖氨酸17(E17K)。AKT PH结构域的E17K突变体存在于很多肿瘤中,在乳腺癌患者中AKT1的PH结构域的突变率在体细胞为8%(5/61),在大肠癌患者中则为 6%(3/51),卵巢癌为2%(1/50)[10]。该突变显著增加T308的磷酸化,而不影响S473的磷酸化。K8R/E17K突变的AKT,其泛素化修饰水平降低,同时AKT1的膜定位和T308位点的磷酸化水平也降低,AKT1的细胞膜病理性的异常活化,考虑有可能是激活PI3K-AKT通路的新机制[2]。
AKT1基因E17K突变是否是敏感的PI3K的定位抑制剂成为目前研究的热点。但有关AKT的突变的研究大多是在欧美进行的,对于亚洲人种这种突变还没有进行广泛地确认。在以前的研究中并没有发现日本人胃肠道肿瘤和肝癌患者中AKT1基因E17K突变。而在本实验中,首次同样发现102例胃癌患者和130例结直肠癌患者的临床样本没有外显子4中E17K的突变,外显子4的核苷酸49仍为G。而在阳性对照(E17K突变的DNA,Dr.Kerry L.Blanchard提供)中发现有点突变,外显子4的核苷酸49由G变成A,从而在对应的蛋白质的相应位置赖氨酸取代谷氨酸赖氨酸17(E17K),泛素化修饰受到影响,可促进肿瘤的发生及转移。
LCM技术是目前从组织中纯化细胞的最好方法之一,该技术可有效地克服组织中细胞异质性造成的偏差。成功地解决了从所需标本不同成分中获取纯净细胞的问题,具有简单、快速以及精确度高等特点,被广泛用于肿瘤学、细胞发生学和其他学科的研究。因此,本研究采取了LCM技术,避免了非肿瘤细胞的污染,保证了得到的细胞具有特异性[11-12]。在本实验中取样的中国人和日本人胃癌和结直肠癌患者中并没有出现AKT1基因PH结构域突变,可能为由于种族差异所致。由于临床分析样本数量有限,在进一步的研究我们将采取更大量的样本去验证以上结果。一旦测知这些突变与分子靶向治疗的疗效有相关性,则根据靶点进行靶向治疗成为可能。
综上所述,尽管我们的结果并未否定AKT1基因PH结构域突变的可能性,但本研究发现这种突变在中国人和日本人的胃肠道肿瘤的发生率很低,需要进行更全面的基因突变分析加以证实,为以后的研究及治疗提供了有用的信息。
[1]Franke TF,Hornik CP,Segev L,et al.PI3K/Akt and apoptosis:sizematters[J].Oncogene,2003,22:8983.
[2]Brugge J,HungMC,M illsGB.A newmutational AKT ivation in the PI3K pathway[J].CancerCell,2007,12:104.
[3]Cantley LC.The phosphoinositide 3-kinase pathway[J].Science,2002,296:1655.
[4]Vivanco I,Sawyers CL.The phosphatidylinositol 3-Kinase AKT pathway in human cancer[J].Nat Rev Cancer,2002,2:489.
[5]Shayesteh L,Lu Y,KuoWL,et al.PIK3CA is implicated asan oncogene in ovarian cancer[J].Nat Genet,1999,21:99.
[6]Li J,Yen C,Liaw D,etal.PTEN,aputative protein tyrosine phosphatase genemutated in human brain,breast,and prostate cancer[J].Science,1997,275:1943.
[7]Steck PA,Pershouse MA,Jasser SA,et al.Identification of a candidate tumour suppressor gene,MMAC1,at chromosome10q23.3 that ismutated in multiple advanced cancers[J].NatGenet,1997,15:356.
[8]Samuels Y,Wang Z,Bardelli A,et al.High frequency ofmutationsof the PIK3CA gene in human cancers[J].Science,2004,304:554.
[9]Parsons DW,Wang TL,Samuels Y,etal.Colorectal cancer:mutations in a signalling pathway[J].Nature,2005,436:792.
[10]Carpten JD,Faber AL,Horn C,et al.A transformingmutation in thepleckstrin homology domain of AKT1 in cancer[J].Nature,2007,448:439.
[11]Neubauer H,Clare SE,Kurek R,etal.Breast cancer proteom icsby laser capturemicrodissection,sample pooling,54-cm IPG IEF,and differential iodine radioisotope detection[J].Electrophoresis,2006,27(9):184052.
[12]Ai J,Tan Y,YingW,etal.Proteome analysisofhepatocellular carcinoma by lasercapturemicrodissection[J].Proteom ics,2006,6(2):53846.
The variation in PH domain of AKT1 gene in gastrointestinal cancer in Asia
LIYu-qin,SUNMin-dan,LILi-na,etal.(Departmentof Gastroenterology,First Hospital of Norman BethuneMedica l College,Jilin University,Changchun130021,China)
ObjectiveTo Analysis of AKT1 gene PH(the p leckstrin homology,PH)domain in exon 4 of the base sequence,study the relations of Chineseand Japanese AKT1genemutation and gastrointestinal tumor.MethodsThe tumor cellsweregot from Gastric cancer and colorectal cancer tissue by Lasermicrodissection.The the PH domain of AKT1 genewere Amplificated by RTPCR.PCR productswere purified and directly sequenced.ResultsPH domain of AKT1 gene in exon 4 of 49 nucleotidemutation does notappear Pointmutation.ConclusionPH domain of AKT1 gene of Chinese and Japanese gastrointestinal tumor does notappear Pointmutation,the developmentofgastrointestinal cancer has little to dowith it.
AKT1 gene;Laser Capturemicrodissection;Gastric cancer;colorectal cancer;mutation
R57
A
1007-4287(2010)08-1173-03
2009-05-18)

