抑肽酶对实验性急性肝损伤免疫组化检测的研究
王心童,王虹蛟,王 强,孟威宏,颜炜群,任立群
(1.吉林大学白求恩医学院,吉林 长春 130021;2.长春解放军第461医院;3.沈阳军区总医院;4.吉林大学再生医学科学研究所)
抑肽酶对实验性急性肝损伤免疫组化检测的研究
王心童1,王虹蛟2,王 强2,孟威宏3,颜炜群4*,任立群4
(1.吉林大学白求恩医学院,吉林 长春 130021;2.长春解放军第461医院;3.沈阳军区总医院;4.吉林大学再生医学科学研究所)
目的 探讨抑肽酶对实验性急性肝损伤小鼠肝细胞增殖能力的影响。方法利用实验鼠的四氯化碳(CCl4)急性肝损伤模型,同时给予抑肽酶观察其对急性肝损伤小鼠肝细胞增殖能力改变。结果各治疗组与模型组相比,阳性细胞数目均显著增加(P<0.05),随着抑肽酶剂量的增加,阳性细胞数目也增加。结论抑肽酶能够促进急性肝损伤肝细胞增殖,并随着剂量的增加而增加。
抑肽酶;四氯化碳;急性肝损伤;小鼠,免疫组织化学
(Chin J Lab Diagn,2010,14:1176)
本论文利用实验鼠的四氯化碳(CCl4)急性肝损伤模型,同时利用免疫组织化学染色检测方法观察抑肽酶对急性肝损伤小鼠肝细胞增殖能力的影响,并对其作用机制进行探讨。
1 材料与方法
1.1 实验动物
昆明种小鼠,雌雄兼用,由长春高新医学动物研究中心提供,合格证号:医动字第1055113。
1.2 实验方法
1.2.1 小鼠急性CCl4肝损伤模型的建立 健康昆明种小鼠6-8周龄,体重20-23 g,雌雄各半。正常对照组仅腹腔注射花生油20 ml/kg,其它各实验组小鼠按20ml/kg腹腔注射0.1%CCL4花生油。禁食,不禁水。
1.2.2 动物分组及给药 取昆明种小鼠60只(体重20-23 g,雌雄各半),随机分为 6组,每组 10只。第1组为正常对照组(空白组):腹腔注射等量生理盐水。第2组为CCl4中毒模型组(模型组):腹腔注射等量生理盐水。第3组为抑肽酶小剂量组:腹腔注射抑肽酶3万KIU/kg。第4组为抑肽酶中剂量组:腹腔注射抑肽酶6万KIU/kg。第5组为抑肽酶大剂量组:腹腔注射抑肽酶12万KIU/kg。第6组为甘利欣注射液组(阳性组):腹腔注射甘利欣10mg/kg。
第3-5组小鼠每天注射抑肽酶1次,第6组小鼠每天注射甘利欣1次,连续7天。第7天给药完毕后,第1组小鼠腹腔注射花生油20ml/kg,第2-6组小鼠按20m l/kg腹腔注射0.1%CCL4花生油。禁食,不禁水。18小时后再给药1次。
1.2.3 免疫组织化学染色 末次给药1小时后处死小鼠,取肝大叶相同部位的一小块肝组织固定于10%福尔马林,常规方法制做组织切片。
(1)脱蜡与修复:石蜡切片经常规脱蜡至水(二甲苯洗2次,每次30分钟;无水乙醇洗2次,每次10分钟;95%乙醇洗2次,每次5分钟;80%乙醇洗1次,5分钟),自来水洗2次之后,将切片置枸橼酸盐修复液(A液9ml,B液41ml,加蒸馏水至500ml)中加热至98℃进行修复;
(2)切片冷却至40℃以下,滴加3%H2O2室温处理15分钟,以灭活内源性过氧化物酶的活性,用PBS冲洗3次,每次5分钟;
(3)滴加正常兔血清封闭液,室温孵育30分钟,甩去多余的液体(勿洗);
(4)滴加兔抗人PCNA单克隆抗体(稀释度1∶100),4℃过夜,PBS冲洗3次,每次5分钟;(5)滴加二抗,室温孵育20分钟,PBS冲洗3次,每次5分钟;
(6)滴加三抗,室温孵育20分钟,PBS冲洗3次,每次5分钟;
(7)3,3-二氨基苯联胺(DAB)显色1分钟,自来水中止发色;
(8)苏木素轻度复染5分钟,弱氨水返蓝10秒钟,自来水冲洗;
(9)脱水、透明及封片:80%乙醇、95%乙醇Ⅰ、95%乙醇Ⅱ、100%乙醇Ⅰ及100%乙醇Ⅱ脱水各5分钟;二甲苯透明2次,每次5分钟;树胶封片。
结果判定:200倍显微镜下每张切片计数5个不同视野,计数每个视野中细胞总数及阳性细胞数。结果用平均数±标准差(¯x±s)表示。
1.2.4 统计学处理 实验数据以 ¯x±s表示,各组之间数据比较均采用两组资料秩和检验的方法。
2 结果
应用增殖细胞核抗原(Proliferating Cell Nuclear-Antigen简称PCNA)抗体,免疫组织化学法检测PCNA表达情况,评测各组肝细胞增殖情况。200倍显微镜下每张切片计数5个不同视野,计数每个视野中PCNA阳性细胞数。结果用平均数±标准差(¯x±s)表示。空白组中,阳性细胞数为3±1个/视野(图1);模型组阳性细胞数为5±2个/视野(图2);抑肽酶小剂量组阳性细胞个数为15±7个/视野(图3);抑肽酶中剂量组阳性细胞个数为21±10个/视野(图4);抑肽酶大剂量组为40±15个/视野(图5);甘利欣组中阳性细胞个数为27±10个/视野(图6);各剂量组与模型组相比,阳性细胞数目均显著增加(P<0.05),随着抑肽酶剂量的增加,阳性细胞数目也增加。说明抑肽酶能够促进急性肝损伤肝细胞增殖,并随着剂量的增加而增加。
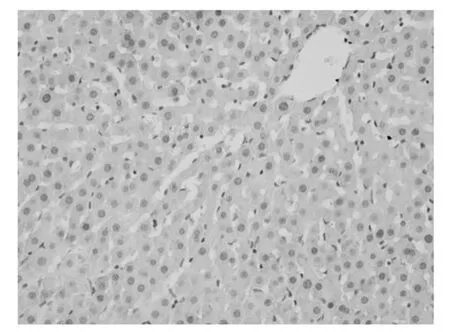
图1 空白组阳性细胞数为3±1个/视野200×

图2 模型组阳性细胞数为5±2个/视野200×
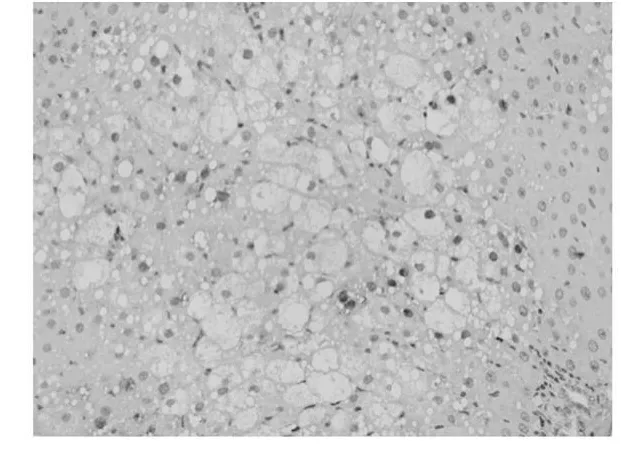
图3 抑肽酶小剂量组阳性细胞个数为15±7个/视野200×
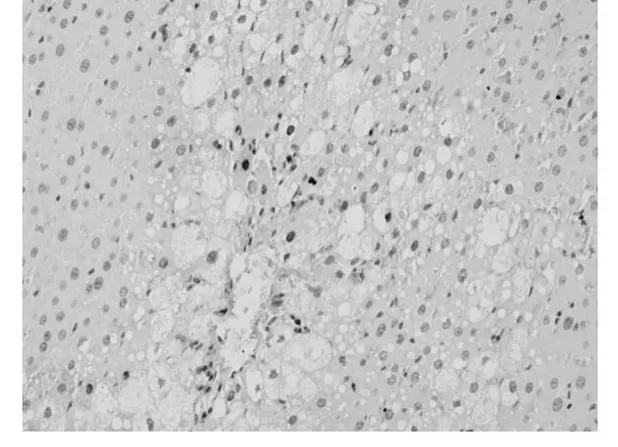
图4 抑肽酶中剂量组阳性细胞个数为21±10个/视野200×
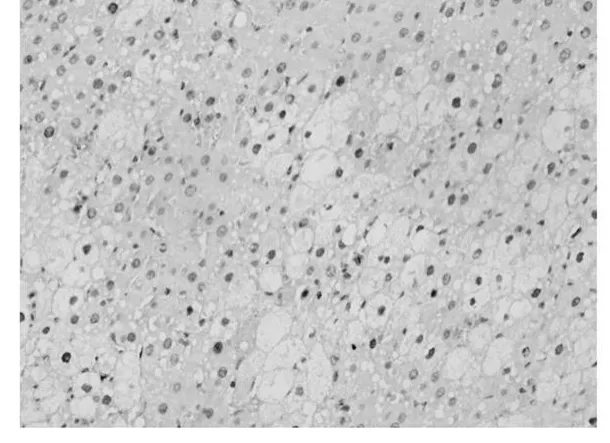
图5 抑肽酶大剂量组阳性细胞个数为40±15个/视野200×
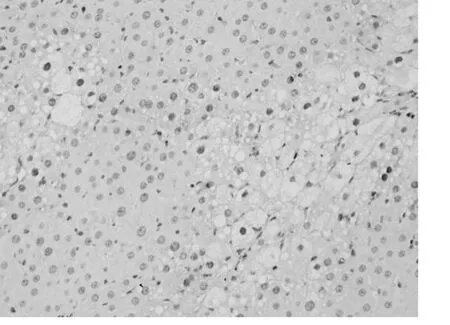
图6 甘利欣阳性组阳性细胞个数为27±10个/视野200×
3 讨论
肝脏是机体最大的代谢器官和消化腺体,从胃肠道吸收的物质几乎均要进入肝脏,在肝脏内进行合成、分解、转化、储存。肝脏同时也是机体重要的免疫器官。各种致病因子作用于肝组织后,可直接导致肝细胞不同程度的损害,还可通过自分泌和旁分泌作用引起细胞因子网络的激活,引起肝细胞的损伤、再生、肝纤维化等,晚期则发展为肝功能衰竭。关于肝损伤机制及对其保护作用的研究,是国内外生物学、医学研究的焦点之一[1-6]。
肝损伤动物模型的建立是筛选保肝药物的关键步骤之一。CCl4致肝损伤是目前普遍应用的肝损伤模型[7]。CCl4肝损伤分急、慢性两种,CCl4的肝毒性主要表现为血清中转氨酶活性增加,肝细胞脂质过氧化或坏死,其转归有肝细胞增殖,损伤恢复或肝纤维化两个方面。近年来,随着自由基和细胞因子,粘附分子研究的不断深入,对CCl4肝毒性的研究也取得了一些进展。①自由基清除剂的变化:CCl4进入机体后,经肝脏细胞色素P450激活,生成三氯甲基自由基(CCl3◦)和三氯甲基过氧自由基(OOCCl3◦),这两种自由基引起肝细胞的各种变化导致肝损伤。②GSH的作用:CCl4进入机体后,经肝脏细胞色素P450激活,生成三氯甲基自由基(CCl3◦)和三氯甲基过氧自由基(OOCCl3◦),这两种自由基引起肝细胞的各种变化导致肝损伤。③肝损伤过程中细胞因子的变化:急性肝损伤后,单核细胞趋化蛋白-1(MCP-1)的表达和单核细胞的渗透有直接的关系,MCP-1的表达先于单核细胞的募集,用维生素E预防氧化应激相关分子的产生,可使MCP-1的表达和释放减少[8]。④粘附分子的变化:上调和炎症细胞的积累可能是CCl4肝毒性产生的关键[9]。
增殖细胞核抗原(Proliferating Cell NuclearAntigen简称PCNA)由Miyachi等于1978年在SLE(系统性红斑狼疮)患者的血清中首次发现并命名,因其只存在于正常增殖细胞及肿瘤细胞内而得名,以后的研究发现PCNA与细胞DNA合成关系密切,在细胞增殖的启动上起重要作用,是反映细胞增殖状态的良好指标。本实验中,我们通过免疫组织化学技术,检测了个实验组中肝细胞PCNA表达情况,以评测各组细胞增殖状态。结果显示与模型组相比,抑肽酶各剂量组与模型组相比,阳性细胞数目均显著增加,随着抑肽酶剂量的增加,阳性细胞数目也增加。说明抑肽酶能够促进急性肝损伤肝细胞增殖,并随着剂量的增加而增加。
抑肽酶是一种广谱丝氨酸蛋白酶抑制剂。其主要作用有:①抑制胰蛋白酶、激肽释放酶、纤溶酶、白细胞水解酶,抑制血小板聚集和粘附等作用,广泛用于体外循环的心血管手术和多种疾病的治疗[10];②是血清酶和缓激肽释放酶抑制剂,在高纤溶状态下发挥抗纤溶作用,但在纤溶状态降低时能防止术后早期纤溶状态降低;③有保护血小板功能,减少术后出血,缩短创面渗血时间和稳定血液动力学等作用[11];④抑肽酶还有抑制炎性介质释放的作用[12],预防细胞因子级联反应,抑制白细胞过度激活及炎性介质的释放,阻断细胞因子炎性介质与白细胞之间的恶性循环作用,减轻再灌注对机体组织器官功能的损伤。
综上所述,通过免疫组织化学染色检测方法观察抑肽酶对急性肝损伤小鼠肝细胞增殖能力的影响,表明腹腔注射抑肽酶对实验性小鼠急性肝损伤的具有明显的保护作用。推测抑肽酶是急性肝炎和肝病治疗的一种新的、有效的方法,具有重大的科研及临床应用价值。
[1]Kaplowitz N.Mechanisms of liver cell injury[J].JHepatol,2000,32(1 Suppl):39.
[2]Patel T,GoresGJ.Apoptosis and hepatobiliary disease[J].Hepatology,1995,21(6):1725.
[3]Scaffidi C,Fulda S,Srinivasan A,et al.Two CD95(APO-1/Fas)signaling pathways[J].EMBO J,1998,17(6):1675.
[4]王虹蛟,张馨木,常淑芳,等.抑肽酶对小鼠急性肝损伤的保护作用[J].中国实验诊断学,2005,9(3):420.
[5]孟威宏,王虹蛟,张馨木,等.口服抑肽酶对大鼠急性肝损伤的保护作用[J].吉林大学学报医学版,2006,32(3):370.
[6]王虹蛟,孟威宏,王 强,等.抑肽酶对实验性慢性肝损伤的保护作用[J].中国实验诊断学,2008,12(1):4.
[7]BozkurtS,Ersoy E,Tekyn HE.The cytoprotective effect of iloprostagainst carbon tetrachloride induced hecrosis in rat liver[J].Res Common Mol Pathol Pharmacol,1997,95(3):343.
[8]Marra F,DeFranco R,Grappone C,et al.Expression ofmonocyte chemotactic protein-1 precedesmonocyte recruitmentin a ratmodel ofacute liver injury,and ismodulated by vitamin E[J].J Investig Med,1999,47(1):66.
[9]NeubauerK,EichhorstST,Wilfling T,etal.Sinusoidal intercellular adhesion molecule-1 up-regulation precedes the accumulation of leukocyte function antigen-1-positive cells and tissue necrosis in amodelof carbontetrachloride-induced acute rat liver injury[J].Lab Invest,1998,78(2):185.
[10]Turkoz A,Cigli A,ButK,et al.Theeffectsofaprotinin and surgery[J].Caudiothorac Vasc Anesth,2001,15(5):603.
[11]Oxer Z,Sudu N,Dusmez D,et al.The effect of aprotinin on schemiarepeifusion injury in the rabbit kidney[J].Pharmacol Res,2001,44(6):455.
[12]Landis RC,Asimakopoulos G,PoullisM,et al.The antithrombotic and anti-inflammatory mechanisms of action of aprotinin[J].Ann Thorac Surg,2001,72(6):2169.
Immunohistochemistrory detection of the in fluence of ap rotinin on theW istar ratswith acute liver injury
WANGXin-tong,WANGHong-jiao,WANGQiang,etal.(1.Norman Bathune College ofMedicine,Jilin University,Changchun130021,China;2.The461Hospital of PLA;3.TheGeneral Hospitalof Shenyang Military District;4.The Instituteof Frontier Medical Science,Jinlin University)
ObjectiveTo investigate the influence of ap rotinin on the hepatocyte proliferation inWistar ratswith acute liver injury.MethodsTheacutehepatic injurymodelof ratswere induced by carbon tetrachloride(CCl4)and aprotininwas administered to rats.The influence ofaprotinin on the hepatocyte proliferation inWistar ratswith acute liver injury was observed.ResultsCompare withmodel group,the numberof positive cells increased significantly in every treatmentgroup(P<0.05).With the increase of the dose of aprotinin,the numberof positive cells also increased.ConclusionThe aprotinin could promote the p roliferation of liver cells in acute damage livermodel.
Aprotinin;Carbon tetrachloride;Acute hepatic injury;Rats;Electronmicroscope
R575
A
1007-4287(2010)08-1176-03
国家自然基金课题(课题编号30300153)
*通讯作者
2009-03-11)

