DC联合CIK细胞对中晚期消化系统肿瘤患者的免疫功能的影响
刘林林,刘 念,杨艳明,顾 华,王 欣
(吉林大学第二医院 肿瘤生物治疗科,吉林 长春 130041)
过继免疫治疗(Adoptive Cellular Immunotherapy)是通过能直接或间接介导抗肿瘤效应的免疫细胞输注肿瘤患者体内的一种肿瘤治疗方法,目前已成为肿瘤治疗的一个全新的领域。其中细胞因子诱导的杀伤(cytokine-induced killer,CIK)细胞是继淋巴因子激活的杀伤(lymphokine activated killer,LAK)细胞、肿瘤浸润淋巴细胞(tumor-infiltration lymphocyte,TIL)后的新型细胞,其增殖能力和杀伤活性显著高于LAK细胞,是一种安全的辅助治疗手段[1]。但临床观察中发现部分患者在接受CIK免疫治疗后,疗效不理想,认为是肿瘤细胞对这些免疫效应细胞发生了抵抗,这可能与肿瘤患者功能性的DC缺乏有关。DC作为体内功能强大的专职抗原递呈细胞 ,在细胞毒性T细胞的活化过程中发挥着重要的作用。CIK细胞和DC联合应用,不仅可增强免疫效应细胞的抗肿瘤活性,还可以使效应细胞对肿瘤靶细胞的杀伤更具特异性,是目前肿瘤过继细胞免疫治疗的首选方案。
消化系统肿瘤病程发展快,患者就诊时往往已属中晚期,失去了手术治疗的机会。为了探讨细胞免疫疗法对中晚期消化系统肿瘤的治疗效果,本研究选择27例中晚期消化系统肿瘤患者(男21,女6,中位年龄60岁),观察DC联合CIK细胞治疗对患者免疫功能的提升作用并评估近期疗效,为其在临床中晚期消化系统肿瘤治疗中的广泛应用提供临床资料和证据。
1 资料与方法
1.1 患者的入选标准本组27例均经影像学、细胞学及理学等检查确诊为消化系统恶性肿瘤 ,并根据国际抗癌联盟(UICC)分期标准进行临床分期,所有患者卡式评分达60分以上,预计生存期大于6个月,无严重的心脏、肾脏及肝脏功能损害(患者一般资料见表1)。

表1 入选患者一般资料
1.2 DC细胞的制备所有操作均严格遵守标准操作规程(SOP)的程序。应用外周血单个核细胞采集患者外周血2-3X109个单个核细胞 及血浆80 ml(Kabi Fresenius,German)。经 Ficoll-Hypaque(Gibco,USA)分离单个核细胞后,离心洗涤两次,用无血清RPM1640(PAA laboratories GmbH,Linz,Austria)重悬,调整细胞浓度为2-4×106/ml铺入6孔板,置于37℃、5%CO2培养箱中,孵育两小时后,轻晃 6孔板,收集悬浮细胞至另一个50 ml离心管,用无血清AIM V(invitrogene)培养液洗板1-2次,加入无血清AIM V(invitrogene)培养液继续培养;第三天补加DC培养液2-3 ml/孔;第五天加入肿瘤特异性抗原(终浓度为 20-80 μ g/ml),诱导后 12-16 小时,加入TNF-1(500 U/ml);第8天收集细胞,离心,生理盐水洗涤3次,用含有10%患者自身血浆的生理盐水重悬,总体积为100 ml,经静脉回输患者,共四次,每次回输间隔4天。
1.3 CIK细胞制备将经Ficoll-Hypaque(Gibco,USA)分离的单个核细胞重悬于无血清AIM V(invitrogene)培养液中,以 2×106/ml铺入培养瓶,补加INF-(1 000 U/ml),置于 37℃、5%CO2培养箱中孵育 ;次日补加 CD3单抗(0.5 μ g/ml)及 IL2(1 000 U/ml),继续培养;第3天用无血清AIM V(invitrogene)培养液进行补液;第11-12天收集CIK细胞,离心,生理盐水洗涤3次,用含有10%患者自身血浆的生理盐水重悬,总体积为100 ml,经静脉回输患者,共四次,回输时间选择在两次DC回输之间。
1.4 细胞的质量控制及活性分析
1.4.1 无菌检测 在每次细胞回输前两天将培养液涂板进行细菌学培养,在每次细胞回输前1小时通过凝胶法进行细菌内毒素检查。
1.4.2 细胞的免疫活性分析 分别在第7天及第12天收集DC及CIK细胞,数量为2×106,分别用CD3、HLA-DR、CDlα、CD80、CD86 标记 DC 细胞,用 CD3/CD56标记CIK细胞,在4℃避光标记30 min,洗涤两次,重悬于 500 μ lPBS 中,上机检测(Calibor BD)。
1.5 回输前后患者免疫功能分析分别于单个核细胞采集当天及治疗结束后第7天采集患者外周血,分别用 CD3、CD4、CD8、CD56 进行荧光标记 ,进行T细胞亚群的检测。
1.6 毒副反应观察每次免疫细胞回输后观察患者是否出现发热、皮疹等毒副反应。
1.7 患者近期疗效的评估
1.7.1 患者治疗前后生活质量改善 应用EORTC QLQ-C30生命质量测定表及卡氏评分标准评价患者生活质量改善情况。
1.7.2 按WHO关于肿瘤近期疗效评价的标准,在患者治疗前及治疗后1个月行CT及超声进行对照比较,疗效分为完全缓解(CR),部分缓解(PR),轻度缓解(MR),稳定(SD),进展(PD),治疗有效率=CR+PR,肿瘤缓解率=CR+PR+MR。
1.8 统计学处理采用SPSS 10.0统计软件分析。率的比较均采用 χ2检验,计量资料采用t检验。检验水准α=0.05。
2 结果
2.1 CIK细胞体外扩增及细胞表型分析结果经体外扩增后CD3+细胞阳性率由64%提高到95%,CD3+/CD56+细胞由3%提高到28.7%,有统计学差异(P<0.05,见图1)。
2.2 治疗前后患者免疫功能分析患者治疗前免疫功能低下,表现为T辅助细胞(CD3+/CD4+)百分率低于正常,而T抑制细胞(CD3+/CD8+)高于正常,造成二者比值降低。治疗后患者T辅助细胞阳性率显著升高,T抑制细胞阳性率降低,二者比值回复正常。同时患者体内NKT细胞(CD3+/CD56+)也明显升高。结果有统计学差异(P<0.05)(见表2及图2)。

图1 体外培养10天后CIK细胞表性分析
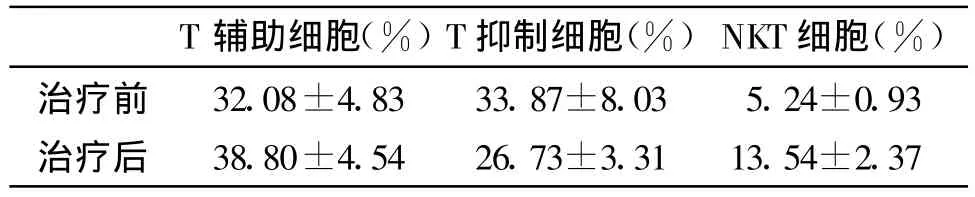
表2 患者治疗前后免疫细胞表性分析

图2 患者治疗前后免疫细胞表型对比分析
2.3 毒副反应观察患者经DC联合CIK细胞治疗后,27例患者中有5例患者出现一过性发热反应(温度≤38.5℃),未经过特殊处置在24 h内即降至正常。
2.4 患者生活质量改善
2.4.1 EORTC QLQ-C30生命质量测定表测定结果

表2 CIK细胞治疗后症状缓解情况
2.4.2 27例用Karnofsky评分来评估生存质量的改善。治疗后卡式评分平均提高10-20分,其中提高19例,稳定6例 ,下降2例,提高率为70.4%。
2.5 瘤体变化22例患者经DC联合CIK细胞治疗后 PR 5例,MR9例,SD 8例,PD 5例,有效率(CR+PR)为51.8%(14/27),肿瘤控制率(CR+PR+SD)为 81.4%(22/27)。
3 讨论
CIK(cytokine induced killer)细胞是外周血单个核细胞在体外经多种细胞因子共同培养一段时间后获得的一群异质细胞。Schmidt-Wolf[2]等首次报道了在多种细胞因子作用下,外周血淋巴细胞可以被定向诱导成具有杀伤肿瘤活性的免疫效应细胞,由于该种细胞同时表达CD3和CD56两种膜蛋白分子,因此具有T淋巴细胞强大的抗瘤活性自然杀伤细胞(NK)的非主要组织相容性复合体(MHC)限制性杀瘤的优点。体外及动物研究证实CIK细胞具有增殖速度快、杀瘤活性高、杀瘤谱广、对正常骨髓造血前体细胞毒性小等多种优势[3-4]。目前CIK细胞已应用于部分临床恶性肿瘤的治疗,取得了较好的效果。Kim[5]等将自体CIK细胞回输原发性肝细胞癌患者体内后,提高了机体的免疫应答水平,改善了肝脏功能,患者的症状减轻,无不良反应。Jiang[6-7]等研究显示,CIK细胞联合化疗治疗IV期胃癌的患者,能明显提高患者的生存质量,延长晚期胃癌患者的2年生存期,同时不良反应较小。但在应用CIK等免疫效应细胞进行过继免疫治疗时,部分患者的治疗效果不太理想,这可能与肿瘤患者功能性DC细胞缺乏有关。DC作为体内功能最强大的抗原递呈细胞,能诱导出抗原特异性细胞毒T淋巴细胞反应(Cytotoxic T lymphocyte,CTL),在人抗肿瘤免疫的治疗中发挥了重要的作用[8-9]。将CIK细胞和DC细胞联合起来治疗恶性肿瘤,将有助于解除部分肿瘤患者T细胞的免疫无能,从而最大程度发挥其协同抗肿瘤作用。
CIK细胞强细胞毒活性源于其较高的存活率和较强的增殖能力,在本研究中,27例患者的单个核细胞经体外培养后10天,CD3+细胞数平均增加了35倍;CD3+/CD56+细胞百分率从3%提高到28.75%,细胞平均扩增了320倍。说明本研究所采用的体外扩增技术能够满足对CIK细胞的高效扩增,从而发挥强大的抗肿瘤作用。恶性肿瘤患者存在T细胞亚群状态异常和比例失调[10]。在免疫治疗前,27例患者中90%以上的患者体内存在免疫功能低下,表现为T辅助细胞(CD3+CD4+)减低或T抑制细胞(CD3+CD8+)百分率升高,CD4/CD8比值下降,其中肝癌患者免疫功能下降最为明显。在应用DC联合CIK细胞进行过继免疫治疗后7天,CD3、CD3+/CD4+阳性细胞显著升高,CD3+/CD8+下降,差异有显著性(P<0.05),说明细胞免疫治疗能够明显增强机体的细胞免疫功能,提高机体的抗肿瘤免疫效应。治疗中出现不良反应仅为发热,发生率为0.18%,与文献报道相似[11]。27例患者中约70%以上的患者在治疗后出现体力增加、食欲增强、、睡眠恢复等生活质量改善征象。70.4%患者卡式评分增加10-20分,症状的改善与患者免疫功能的提高有关。在临床疗效方面,治疗肿瘤的总有效率为51.8%,肿瘤控制率为81.4%。研究中发现不同类型的肿瘤疗效并不相同,结直肠癌及胰腺癌的有效率高于肝癌,考虑与肝癌患者存在原发病毒感染导致免疫功能明显降低有关。
在本研究中,我们揭示了DC联合CIK细胞免疫治疗能够提高中晚期消化系统肿瘤患者的免疫功能进而发挥强大抗肿瘤免疫效应,是一种安全、有效的抗肿瘤治疗手段。
[1]Schmidt-wolf IG,Lefterova P,Johnston V,et a1.Propagation of largenumbers of T cells with natural killer cell markers[J].Br J Hacmatol,1994,87(3):453.
[2]Schmidt-Wolf IG,Negrin RS,Kiem HP,et al.Use of a SCID mouse/human lymphoma model to evaluate cytokine-induced killer cells with potent antitumor cell activity[J].J Exp Med,1991,174(1):139.
[3]Hongcng S,Petvises S,Worapengpaiboon S,et al.Generation of CD3+CD56+cytokine-induced kiler cells and their in vitro cytotoxicity against pediatric cancer cells[J].Int J Hematol,2003,77(2):175.
[4]Karlens S,Gilljam M,Chambers BJ,et al.A new method for in vitro expansion of cytotoxic human CD3+CD56+natural killer cells[J].Hum lmmunol,2001,62(10):1092.
[5]Kim HM,Lim J,Yoon YD,et al.Anti-tumor activity of ex vivo expanded cytokine-induced killer cells against human hepatocellular carcinoma[J].Int Immunopharmacol,2007,7(13):1793.
[6]Jiang J,Xu N,WuC,et al.Treatment of advanced gastric cancer by chemotherapy combined with autologous cytokine-induced killer cells[J].Anticancer Res,2006,26(3B):2237.
[7]Jingling Jiang,Changping Wu,Liangrong Shi.Side effects during treatment of advanced gastric carcinoma by chemotherapy combined with CIK-cell transfusion in elderly people[J].Chinese Journal of Clinical Oncology,2008,5(2):79.
[8]Banchereau J,Steinman RM.Dentric cells and the control of immunity[J].Nature,1998,392(6673):245.
[9]Reid SD,Penna G,Adorini L,et a1.The control of T cell responses by dentritic cell subsets[J].Curt Opin Immunol,2000,12:114.
[10]Robinson E,Segal R,Struminger L,et al.Lymphocyte subpopulations inpatients with multiple primary tumor[J].Cancer,1999,85:2073.
[11]Paola Olioso,Raffaella Giancola,Maria Di Riti,et al.Immunotherapy with cytokine induced killer cells in solid and hematopoietic tumours:a pilot clinical trial[J].Hematol Oncol,2009,27:130.

