厚朴酚通过自噬途径促进HepG-2细胞死亡
李海波,谷建军,英锡相,关洪全
(1.辽宁中医药大学基础医学院,辽宁沈阳110032;2.辽宁中医药大学药学院,辽宁大连116600)
厚朴酚(Magnolol)是中药厚朴的主要有效成分之一,是从厚朴中分离出的具烯丙基取代的联苯酚类化合物。近年来,研究发现厚朴酚具有抗炎、抗菌、肌肉松弛、抗肿瘤和抗氧化的作用[1-2]。但有关其抗肿瘤的作用机制缺乏探讨。以人非小细胞性肺癌HepG-2细胞为材料,应用MTT法及荧光显微镜等方法,研究不同浓度的厚朴酚诱导肿瘤细胞死亡的机制,报道如下。
1 材料
1.1 药品与试剂 胎牛血清购自大连生物试剂公司。谷氨酰胺、胰蛋白酶、青霉素、链霉素、HEPES、MTT、三氯乙酸(TCA)、3-甲基腺嘌呤(3-MA)、MDC、RPMI-1640培养液购自Gibco(Grand Island,NY,USA);厚朴酚购自北京生物制品研究所,用二甲基亚砜(dimethyl sulfoxide,DMSO)溶解(终浓度≤0.01%);经HPLC检测纯度均大于98%。用RPMI-1640培养液稀释至所需浓度,并经0.22 μ m微孔滤器过滤除菌。荧光显微镜(Olympus,BX-51)。
1.2 细胞株 人非小细胞性肺癌HepG-2细胞(购自American Type Culture Collection)。将处于对数生长期的HepG-2细胞接种在含10%胎牛血清和2 mmol/L谷氨酰胺的RPMI-1640培养液中,在饱和湿度,温度为37℃,浓度为5%CO2的培养箱中培养。
2 方法
2.1 细胞生长抑制实验 取处于对数生长期的HepG-2细胞,以每孔100 μ L接种于96孔板。24 h后分别加入厚朴酚(浓度 0,5,10,20,40,60,80,160 μ mol/L),加药作用 6,12,24,48 h 后 ,每孔加入25 μ LMTT(5 g/L),继续培养4 h 后,弃上清,每孔加入150 μ L DMSO溶解,酶标仪492 nm检测,绘制时效及量效曲线。
抑制率(%)=[A492(空白组)-A492(厚朴酚)]/A492(空白组)×100%
2.2 TUNEL法检测4种细胞的凋亡率 取HepG-2细胞不同浓度的厚朴酚处理组和阳性药物处理组,消化离心,制成细胞涂片。按TUNEL试剂盒说明书操作:样本加蛋白酶K,37℃消化10 min,PBS漂洗后加标记缓冲液10 μ L/片,室温1 min,甩掉多余液体不洗。按每张片子取TdT和 Biotion-11-dUTP各1μ L,加入18 μ L标记缓冲液中,混匀,加至标本片上,置湿盒中4℃过夜,再37 ℃标记2 h,2×SSC洗5 min×3次。加 1%乙酰化的 BSA 封闭液 10μ L/片,室温20 min,甩掉封闭液不洗。加SAAP(链酶亲和素碱性磷酸酶)20 μ L/片,37℃反应30 min,PBS充分漂洗。BCIP/NBT 37℃显色30 min,伊红复染,细胞核中有紫蓝色颗粒者为阳性细胞,即凋亡的肺癌细胞。显微镜下观察拍照(×1 000)。同时分别以标记缓冲液替代TdT和Biotion-11-dUTP作空白对照,以正常细胞培养组为正常对照。每组样本随机选择10个区域,每个区域计数100个细胞,统计出凋亡的细胞数,计算凋亡细胞所占百分率。
2.3 LDH活力检测 乳酸脱氢酶(LDH)存在于细胞内,正常情况下,不能透过细胞膜。当细胞受到损伤时,由于细胞膜通透性改变,LDH可从细胞内释放至培养液中。释放出来的LDH再催化乳酸的过程中,使氧化型辅酶I(NAD+)变成还原型辅酶(NADH2),后者再通过递氢体-吩嗪二甲酯硫酸盐(PMS)还原碘硝基氯化氮唑蓝(INT)或硝基氯化四氮唑蓝(NBT)形成有色的甲基化合物,在490 nm或570 nm波长处有一吸收峰,利用读取的A值,即可测得杀伤细胞毒活性。用LDH试剂盒(Zhongsheng LDH kit,Beijing,China)来检测 LDH的活力,于 4℃下离心(240×g)5 min,分别测定培养板悬浮细胞中的LDH(LDHp):作为凋亡指数;上清液中LDH的量(LDHe):作为坏死指数;培养板中贴壁细胞LDH的量(LDHi):作为细胞内LDH指数。
凋亡与坏死的百分率计算如下:凋亡(%)=LDHp/(LDHp+LDHi+LDHe)×100 坏死(%)=LDHe/(LDHp+LDHi+LDHe)×100。
2.4 MDC染色法 MDC是一种荧光染料,可以被用作自噬泡的特异标志物检测自噬的发生[3],不同浓度的厚朴酚作用24 h后,加入50 μ mol/L MDC在37℃下作用1 h,并用4%多聚甲醛固定,于荧光显微镜下观察。3-MA是自噬过程早期特异性自噬抑制剂,在培养于盖玻片上的处于对数生长期的HepG-2细胞中加入3-MA(0,5,10,20,40 mmol/L)预先处理10 h,再加入高浓度厚朴酚作用24 h后,MTT法观察细胞的存活率。
2.5 统计分析 结果数据用单因素方差分析。
3 结果
3.1 厚朴酚对HepG-2细胞生长的抑制作用 不同浓度的厚朴酚于不同时间48 h HepG-2细胞后,细胞的存活率随时间的增加而减少。可见厚朴酚对HepG-2细胞具有细胞毒作用并呈明显的剂量依赖性(图 1)。低浓度(20 μ mol/L)刺激细胞的生长(图2B),可能与厚朴酚的抗氧化作用相关[4],40 μ mol/L在一定程度上诱导了细胞的死亡,细胞变圆、漂浮(图2C),80 μ mol/L发现大部分细胞发生死亡(图2D)。
3.2 厚朴酚处理的细胞中没有伴随凋亡的发生 由于厚朴酚能够抑制HepG-2细胞的生长,接下来采用细胞周期分析药物处理后的细胞周期变化,检测LDH的活力,即0,20,40,80,160 μ mol/L厚朴酚处理48 h后,高浓度组(80,160 μ mol/L)细胞坏死,而对照组(0 μ mol/L)和低浓度组(20,40 μ mol/L)没有坏死现象的发生(图略)。
TUNEL法对细胞用Br-dUTP标记,并用抗BrdUTP抗体染色,检测结果发现,高浓度处理组的HepG-2细胞中,有很少的细胞发生凋亡(图3)。
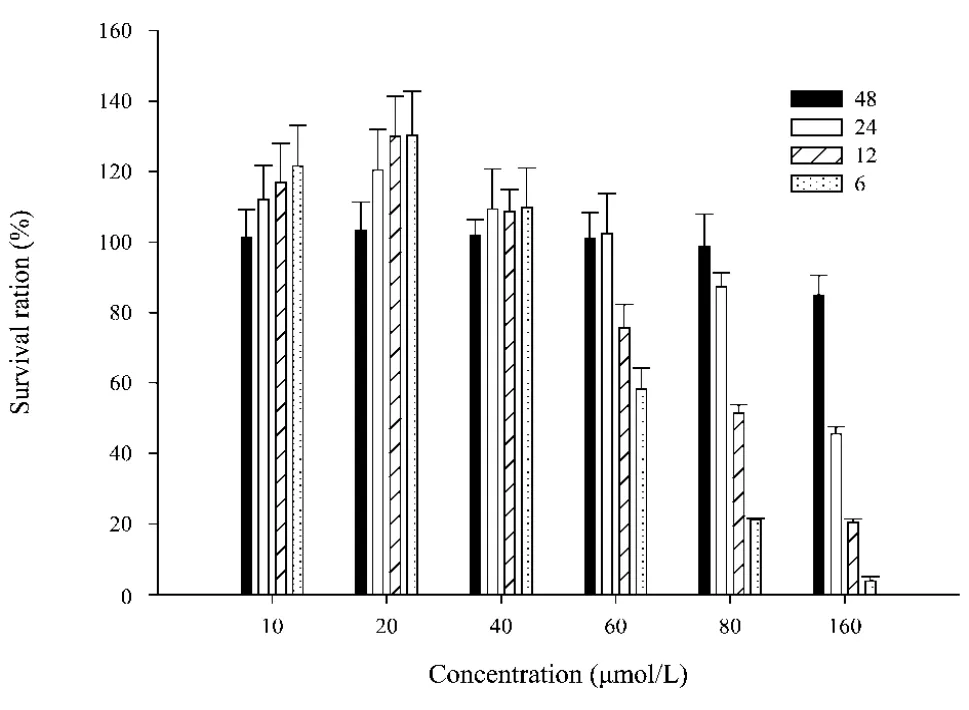
图1 厚朴酚对HepG-2细胞的细胞毒作用(mean±SD,n=3)
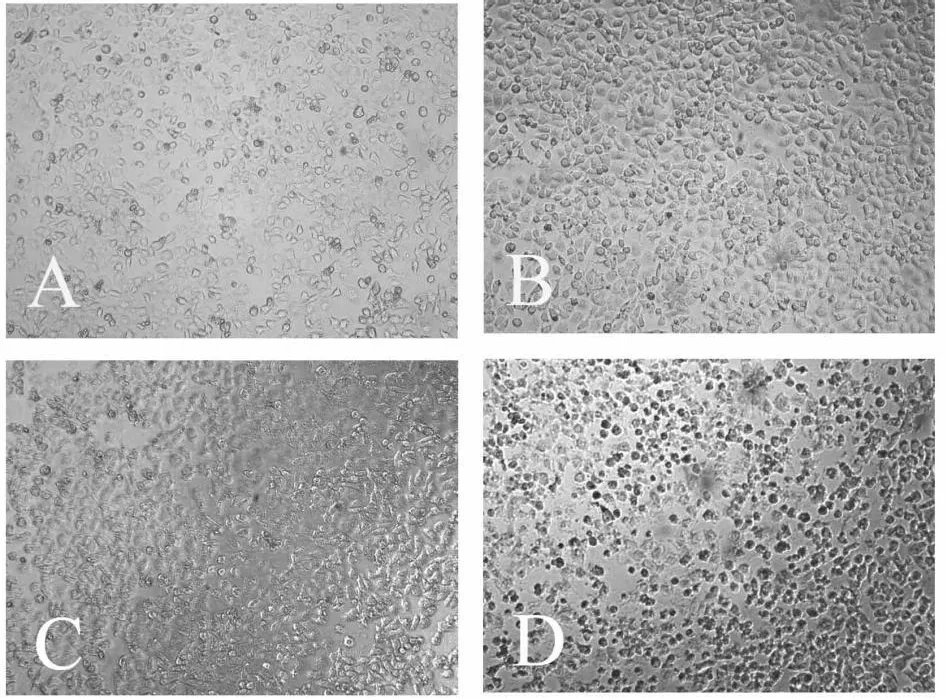
图2 厚朴酚诱导HepG-2细胞凋亡的形态学变化
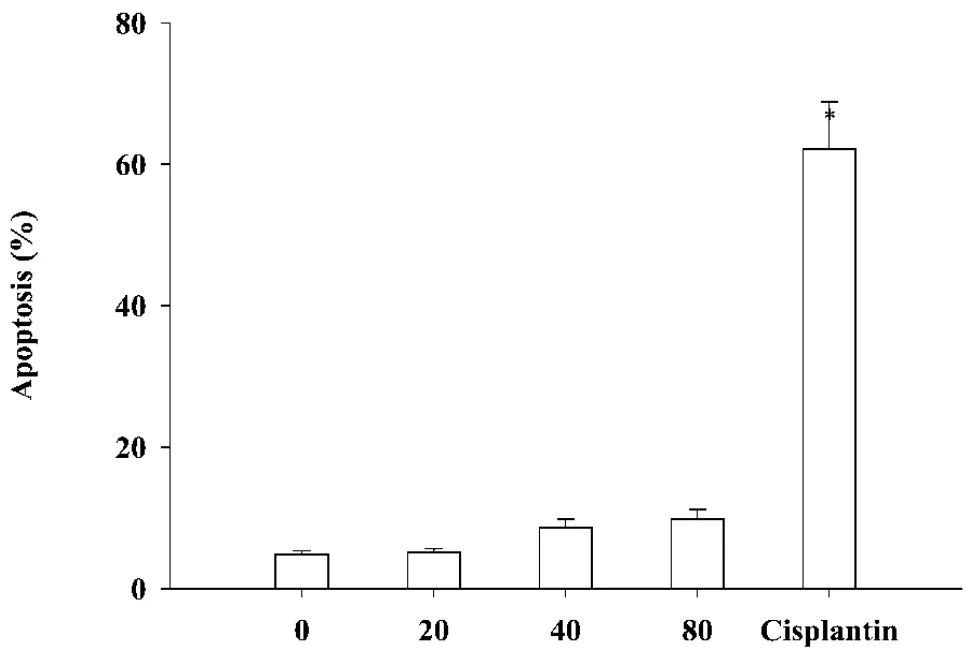
图3 TUNEL法检测厚朴酚作用HepG-2细胞后的凋亡情况(mean±SD,n=3)
以上结果显示,厚朴酚抑制HepG-2细胞的生长,不是通过细胞凋亡的途径。
3.3 厚朴酚诱导HepG-2细胞发生自噬 MDC染色法检测到,高浓度(80 μ mol/L)厚朴酚作用于HepG-2细胞24 h后,荧光显微镜下观察细胞出现大量空泡(图4c),3-MA(20mmol/L)预处理10 h后加80 μ mol/L的厚朴酚作用24 h的处理组可见空泡量减少(图4b),在对照组未见或少见空泡的出现(图4a)。

图4 MDC染色法标示厚朴酚诱导HepG-2细胞胞浆空泡
为了分析厚朴酚作用HepG-2细胞后产生的空泡现象,笔者采用自噬过程早期特异性自噬抑制剂3-MA进行检测,用浓度为5,10,20和40 mmol/L的3-MA分别作用细胞 10 min后,加入80 μ mol/L厚朴酚作用48 h,MTT法检测细胞的存活率,发现细胞的存活率上升,说明细胞自噬作用被抑制(图5)。
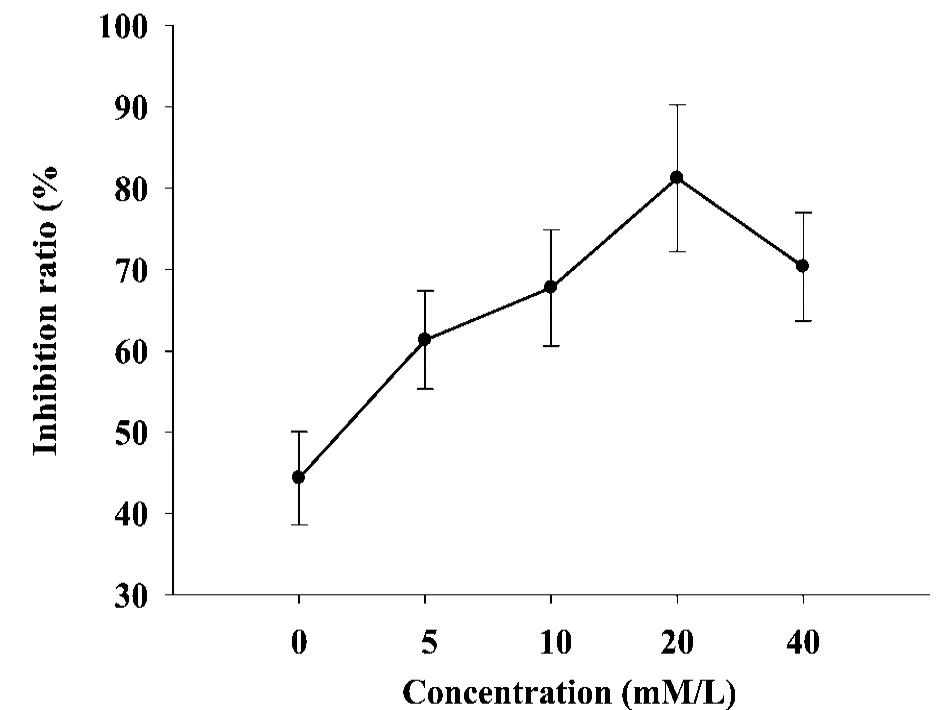
图5 3-MA对HepG-2细胞存活率的影响(mean±SD,n=3)
4 讨论
近年来研究表明,厚朴酚具有细胞毒活性及抗氧化作用等广泛的生物活性,有报道厚朴酚能够诱导人结肠癌细胞(COLO-205)和人肝癌细胞(HepG-2)凋亡,从而抑制其增殖[5]。细胞凋亡(apoptosis)又称程序化细胞死亡(programmed cell death)是多细胞有机体为调控机体发育维护内环境稳定,由基因控制的细胞主动死亡过程[6]。凋亡细胞在形态学上最重要的特征是细胞核染色质异常凝集,核固缩,继而通过形成凋亡小体而消亡。自噬性细胞死亡是一种非凋亡性程序性细胞死亡,是一种降解胞质内容物的溶酶体途径,可以降解细胞内长期存在的蛋白质和细胞器[7]。自噬可以促进坏死,与凋亡有所不同。自噬具有帮助细胞免于凋亡的作用,在应激条件下自噬与凋亡常常同时出现[8]。在研究中,MTT法证明厚朴酚对人非小细胞性肺癌HepG-2细胞具有细胞毒作用,并呈明显的时间依赖性。LDH活力检测显示高浓度厚朴酚可促进HepG-2细胞坏死,更明确其具有细胞毒作用。而TUNEL法检测时很少见高浓度的厚朴酚促进细胞发生凋亡,证明厚朴酚促进HepG-2细胞死亡,不是通过凋亡途径。MDC染色法表明高浓度厚朴酚作用后的细胞有大量胞浆内空泡,与文献描述的自噬过程出现的空泡相似[9],证明有自噬泡的产生。3-MA为特异性自噬抑制剂,对厚朴酚诱导的自噬过程具有很强的抑制作用。当自噬作用被3-MA抑制后,细胞死亡率比厚朴酚单独作用时的细胞死亡率明显减少,进一步表明高浓度的厚朴酚作用可以诱导HepG-2细胞自噬体的产生,出现自噬性细胞死亡。
综上所述,厚朴酚可通过细胞自噬途径而非凋亡途径抑制HepG-2细胞生长。
[1]Li,H.B.,X.Yi,J.M.Gao,et al.,Magnolol-induced H460 cells death via autophagy but not apoptosis.Arch Pharm Res,2007,30(12):1566-1574.
[2]Lu,Y.C.,H.H.Chen,C.H.Ko,et al.,The mechanism of honokiol-induced andmagnolol-induced inhibition on muscle contraction and Ca2+mobilization in rat uterus.Naunyn Schmiedebergs Arch Pharmacol,2003,368(4):262-269.
[3]Biederbick,A.,H.F.Kern and H.P.Elsasser,Monodansylcadaverine(MDC)is a specific in vivo marker for autophagic vacuoles.Eur J Cell Biol,1995,66(1):3-14.
[4]Li,H.B.,J.M.Gao,X.X.Ying,et al.,Protective effect of magnolol on TBHP-induced injury in H460 cells partially via a p53 dependent mechanism.Arch Pharm Res,2007,30(7):850-857.
[5]Zhong,W.B.,C.Y.Wang,K.J.Ho,et al.,Magnolol induces apoptosis in human leukemia cells via cytochrome c release and caspase activation.Anticancer Drugs,2003,14(3):211-217.
[6]Schmitz,I.,S.Kirchhoff and P.H.Krammer,Regulation of death receptor-mediated apoptosis pathways.Int J Biochem Cell Biol,2000,32(11-12):1123-1136.
[7]Levine,B.and D.J.Klionsky,Development by self-digestion:molecular mechanisms and biological functions of autophagy.Dev Cell,2004,6(4):463-477.
[8]Pattingre,S.and B.Levine,Bcl-2 inhibition of autophagy:a new route to cancer.Cancer Res,2006,66(6):2885-2888.
[9]Pedro,M.,C.F.Lourenco,H.Cidade,et al.,Effects of natural prenylated flavones in the phenotypical ER(+)MCF-7 and ER(-)MDA-MB-231 human breast cancer cells.Toxicol Lett,2006,164(1):24-36.

