旋毛虫Ts43基因在各感染时期的转录水平上差异表达
宋铭忻,路义鑫,王守育,张子群,畅 丹,韩彩霞
(1.东北农业大学动物医学学院,黑龙江 哈尔滨 150030;2.黑龙江出入境检验检疫局,黑龙江 哈尔滨 150030)
旋毛虫(Trichinella spiralis)是一种感染宿主骨骼肌细胞的寄生虫。旋毛虫新生蚴钻入宿主骨骼肌细胞后,会导致其去分化,从而改造肌细胞,使之形成保姆细胞(nurse cell,NC)。保姆细胞可为旋毛虫提供营养,并具有免疫逃避的作用。许多学者认为旋毛虫保姆细胞的形成与旋毛虫43 ku~50 ku排泄-分泌(ES)抗原有关[1]。Ts43基因是43ku ES抗原蛋白的表达基因,其全长cDNA由美国研究者Vassilatis D K(1992)首先发现,为旋毛虫肌幼虫特异性表达基因[2]。本研究通过荧光定量PCR技术对旋毛虫各时期虫体Ts43基因表达进行定量分析,从而进一步探讨Ts43基因与保姆细胞形成的相关性。
1 材料与方法
1.1 虫种和质粒 旋毛虫虫种、质粒pMD18-TTs43和pMD18-T-18S为东北农业大学动物医学学院寄生虫病学教研室保存。
1.2 荧光定量PCR引物和探针的设计 根据GenBank中已发表的旋毛虫Ts43和18S rRNA(登录号分别为M95499和U60231)序列,设计并合成引物和探针:
Ts43的引物序列和探针为FP:5′-ACAT TT TTCTTAGTGCTT TCTGGGT-3′;RP:5′-ACCATTCTGTATCATCTGTAGCAGTTCT-3′;PROBE:5′-TGCACAACTGTTTGCAAATTCATGCAGC-3′。
18S rRNA的引物序列和探针为 FP:5′-AGGTTCGAAGGCGATCAGATAC-3′;RP:5′-CTGCTCG CCGAGTCTTAAATG-3′;PROBE:5′-CCAACCAGC-GAT TCGCCGAAGT-3′。
1.3 旋毛虫不同寄生时期虫体的收集 参考文献[3-4]的方法,在小鼠感染旋毛虫肌幼虫7 d后收集成虫(AW),并取适量成虫体外培养收集新生蚴(NBL),于感染后14、18 d和22 d收集成囊前期幼虫(PEL),于感染后 26、30、34、38、48 d 和 58 d 收集旋毛虫肌幼虫(ML)。将收集到的旋毛虫各时期虫体,用DEPC水洗涤3次,-20℃冻存备用。
1.4 旋毛虫总RNA和cDNA文库的制备 旋毛虫总RNA抽提按试剂盒说明进行。反转录合成cDNA后做18S rRNA的PCR,判断逆转录是否成功。
1.5 荧光定量PCR灵敏性、稳定性和重复性的检测 对1ng的pMD18-T-Ts43和pMD18-T-18S质粒进行10倍梯度稀释,分别用荧光定量PCR检测,根据Ct值来检测方法的灵敏性。对10-3ng的标准品分别做5个反应管检测比较同一次反应不同反应管间的批内变异及重复5次检测比较不同时间的反应结果的批间变异。
1.6 标准曲线的制备及 Ts43基因的表达水平的检测 用紫外分光光度计测质粒 pMD18-T-Ts43和pMD18-T-18S的浓度后取1 ng/μ L的质粒依次进行10倍的梯度稀释,分装为10-1~10-5ng/μ L作为标准品。将标准品的起始拷贝数取对数作为横坐标,其所对应的Ct值作为纵坐标,即可做出标准曲线。将旋毛虫各时期虫体的cDNA作为模板进行荧光定量PCR,获取相应的Ct值。根据Ct值以及标准曲线计算定量结果。
2 结果
2.1 旋毛虫各时期虫体cDNA的PCR鉴定 对PCR产物进行1%琼脂糖凝胶电泳分析,结果显示,旋毛虫各时期虫体的18S rRNA目的片段均在100 bp略下方,与设计的内标基因扩增产物91 bp大小一致(见图1)。
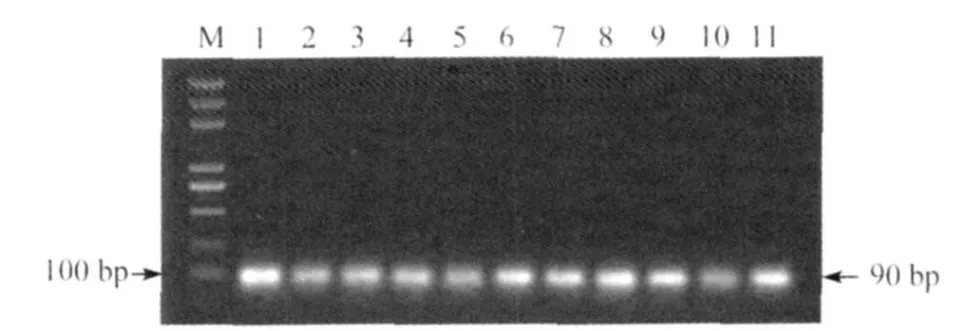
图1 各寄生时期虫体cDNA文库的PCR鉴定
2.2 荧光定量PCR的灵敏度、稳定性和重复性的检测 质粒pMD18-T-T s43和pMD18-T-18S的检测下限均为 10-8ng/μ L。对 10-3ng/μ L的质粒pMD 18-T-Ts43作5个反应管检测,同一次反应不同反应管的批内变异系数为2.0%,不同时间的反应结果的批间变异系数为3.5%,说明本方法的稳定性和重复性都很好。
2.3 标准曲线的制备 T s43基因的标准曲线为Y=-3.390X+13.451,一致系数为 0.999;18S rRNA的标准曲线为 Y=-3.246X+16.396,一致系数为0.992。结果显示两条标准曲线的斜率都接近理想值-3.322,一致系数都接近1.000,说明扩增效率均较好(见图2和图3)。
2.4 旋毛虫各时期虫体Ts43基因表达水平的检测 根据Ct值计算出旋毛虫各时期虫体T s43基因相对于107copies 18S rRNA的拷贝数(见表1)。旋毛虫在各寄生时期均有Ts43基因的表达,成虫和新生蚴的Ts43基因表达量相对于其他寄生时期的虫体很低,该基因表达量在感染后18 d开始逐渐上升,于感染后30 d达到高峰,而后开始逐渐下降,但至感染后58 d的虫体T s43基因表达水平仍高于成虫和新生蚴。
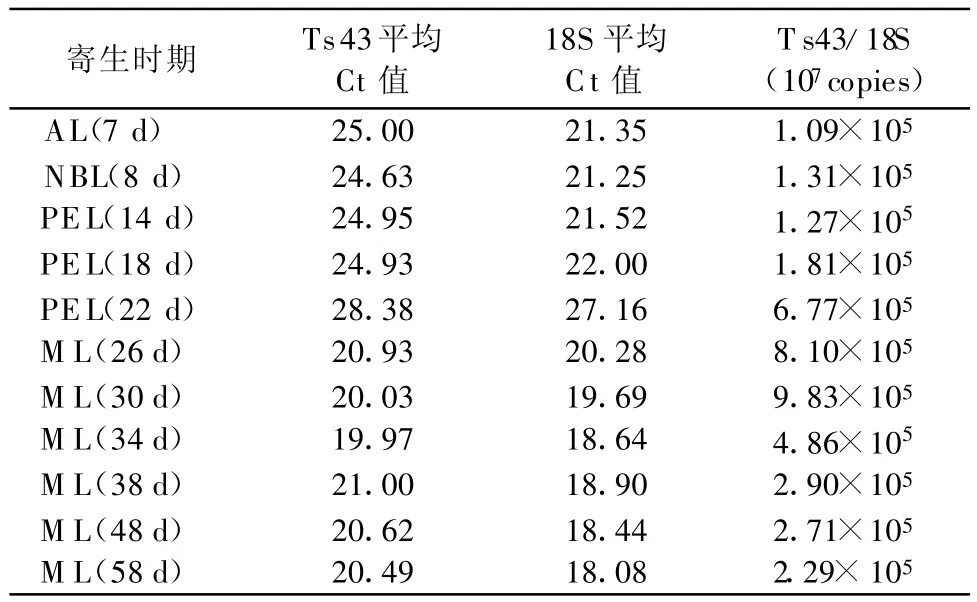
表1 不同寄生时期旋毛虫Ts43基因的定量
3 讨论
许多学者在研究旋毛虫保姆细胞的形成机制时,都注意到了ES抗原的重要作用。Despommier D等[5]用层析聚焦法在 ES抗原中发现了一种43 ku蛋白,它存在于感染后9 d的保姆细胞的胞浆、核质以及表皮上,表明其参与肌肉细胞的转化。Vassilaits D K等[6]制备了具有螺旋-环-螺旋样结构的43 ku重组蛋白抗原,认为其可能具有调节宿主骨骼肌细胞基因表达的功能。Jasmer D P等[7]构建了旋毛虫43 ku蛋白的表达质粒pMYCTsp43,并转染到鼠成肌细胞C2C12,结果表明该表达质粒对转染的成肌细胞具有明显的毒性而无去分化作用。在这之前,Vassilaits D K等[6]也认为43 ku蛋白并没有直接参与旋毛虫保姆细胞的形成,而是与43 ku蛋白相关的一系列蛋白参与了骨骼肌的去分化和保姆细胞的形成。至今关于43 ku蛋白是否与保姆细胞的形成有关还在争论中。
宋铭忻等[8]认为旋毛虫在小鼠骨骼肌中最早形成保姆细胞时间在感染后16 d,于感染后37 d所有肌幼虫都形成保姆细胞。本研究结果表明,T s43基因的表达量正是在感染后18d开始增加,在感染后30 d达到峰值,随后开始逐渐下降,到感染后38 d之后表达量基本维持在一个相对较低的水平,这与保姆细胞形成的时间基本一致[8]。这一现象说明Ts43基因的表达很可能与保姆细胞的形成有关系。此外,本研究中的Ts43基因在成虫和新生蚴中也有少量的表达,这与之前报道的Ts43基因表达具有期特异性有所不同[6,9]。Vassilaits D K等[6]采用RT-PCR的方法检测感染旋毛虫肌幼虫后9、10、11 、12、13、14 、15 d 和 21 d 的小鼠骨骼肌 ,在感染后11 d才发现T s43基因的表达。Wu Z L等[9]采用半定量RT-PCR法对旋毛虫的成虫、新生蚴进行基因定量,发现成虫、新生蚴都无Ts43基因的表达。出现上述不同的试验结果可能与各自所用的研究方法、仪器设备和引物等因素有关,这还有待做进一步的深入研究。
总之,本研究结果可以初步确定T s43基因的表达与保姆细胞的形成有较大关系,为进一步研究Ts43基因表达对小鼠骨骼肌细胞基因的影响提供了理论基础。
[1]Robinson M W,Connolly B.Proteomic analy sis of the ex cretory-secretory proteins of the Trichinella spiralis L1 larva,a nematode parasite of skeletal muscle[J].Proteomics,2005,5(17):4525-4532.
[2]Vassilatis D K,Despommier D D,M isek D E,et al.Analysis of a 43-Ku glycoprotein from the intracellular parasitic nematode T richinella spiralis[J].J Biol Chem,1992,267:18459-18465.
[3]史晓红,石磊,窦兰清,等.旋毛虫成虫新生幼虫及肌幼虫的收集方法[J].中国兽医科技,1993,23(12):26-27.
[4]张荣光,王中全,尹清源.旋毛虫成囊前期幼虫收集方法的研究[J].河南预防医学杂志,1998,9(4):192-194.
[5]Despommier D,Gold A,Busk S.Trichinella spiralis secreted antigen of the infective L1 larvae localizes to the cy toplasm and nucleoplasm of infected host cells[J].Ex p Parasitol,1990,71:27-38.
[6]Vassilatis D K,Polvere R I,Despommier D D,etal.Developmental expression of a 43 Ku secreted g lycoprotein from Trichinella spiralis[J].Mol Biochem Parasitol,1996,78(1-2):13-23.
[7]Jasmer D P,Kwak D.Fusion and differentiation of murine C2C12 skeletal muscle cells that express Trichinella spiralis p43 protein[J].Exp Parasitol,2006,112(2):67-75.
[8]宋铭忻,张桂红,路义鑫.毛形线虫各隔离种保姆细胞形成时间的研究[J].中国兽医寄生虫病,2002,10(1):9-11.
[9]Wu Z L,Nagano I,Nakada T,et al.Expression of excretory and secretory protein genes of Trichinella at muscle stage differs before and after cyst formation[J].Parasitol Int,2002,51(2):155-161.

