犬细小病毒黑龙江株(CPV-YN)的分离、鉴定及致弱的研究
刘大飞,王牟平,司 微,曲连东,高 艳,刘立奎,柴洪亮,林 欢,刘春国,刘大程,华育平*,张洪英*
(1.中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室,黑龙江哈尔滨150001;2.东北林业大学野生动物资源学院,黑龙江哈尔滨150040;3.莱阳市城厢兽医站,山东莱阳265200)
犬细小病毒(Canine parvovirus,CPV)可以引起犬急性出血性胃肠炎和幼犬急性心肌炎[1],于1978年在美国首次被分离鉴定[2]。我国于1982年证实存在CPV感染[3-4],病犬以呕吐、出血性肠炎、白细胞减少为主要特征[5],主要危害幼犬,特别是2月龄~6月龄犬。该病发病急,病程短,死亡率高,传染性强,发病率为50%~100%,病死率为10%~50%。
CPV属于细小病毒科细小病毒属猫细小病毒亚群,单负股DNA病毒,基因组全长约5.0 kb[6-7]。目前已证实 CPV有 CPV-2a、CPV-2b、CPV-2c(a)及CPV-2c(b)4个亚型[8],并通过不断的抗原变异产生新的突变株[9-10]。在我国主要为CPV-2a和CPV-2b两个亚型,1982年~1996年以CPV-2a流行为主,1997年后渐渐以CPV-2b占优势地位。
CPV疫苗的广泛应用,对于防控该病起到了积极作用,但是效果并不理想,疫情是否由CPV变异株出现引起亟需验证。本研究分离鉴定了CPV-YN株,通过接种CRFK细胞连续传代进行致弱。实验结果表明,CPV-YNR株具有良好的免疫原性,可以对同源强毒攻击的犬提供较好的免疫保护作用,为CPV单价苗或联苗的研制奠定了基础。
1 材料和方法
1.1 病 料 采集自哈尔滨市道外区某综合养殖场的发病死亡犬的肺脏、胰脏、肝脏、脾脏、肾、膀胱和淋巴结等组织病料。
1.2 细胞系 猫肾传代细胞CRFK(65代~95代)由中国兽医药品监察所提供。
1.3 实验动物 2月龄~4月龄幼犬(CPV抗体效价≤1∶2),购自哈尔滨医科大学实验动物学部。
1.4 主要试剂 ExTaqDNA聚合酶、pMD18-T载体和DH5α感受态细胞均购自宝生物工程(大连)公司;DNA提取试剂盒购自Promega公司;胶回收(小量)试剂盒购自上海华舜生物工程有限公司。
1.5 病毒分离
1.5.1 病料处理 取病料加入5倍体积PBS(pH7.2)充分研磨制成匀浆,反复冻融5次后,经5 000 r/min 4℃离心10 min,用无菌滤器(0.22 μm)过滤除菌。
1.5.2 病毒培养 将处理的病料4倍稀释后按培养量的1/10接种已长成单层的CRFK细胞,33℃吸附1 h,加入维持液于33℃5%CO2条件进行培养,待80%出现细胞病变(CPE)时收取病毒,设正常细胞作为对照。
1.6 病毒的鉴定
1.6.1 病毒的形态学观察 取培养72 h的CPV第5代细胞培养液进行负染色,电镜观察病毒形态。
1.6.2 病毒血凝(HA)试验及TCID50测定 取CPV毒株第5代细胞培养物用1%猪红细胞进行HA试验。将CPV的第5代细胞培养物作10倍倍比稀释,取10-6、10-5和10-43个稀释度,分别接种于 6瓶CRFK悬液内,每瓶1 mL。于37℃培养96 h,观察CPE,按Reed-Muench法计算TCID50。
1.6.3 PCR鉴定 参考GenBank中登录的NS基因序列(AY787929),设计CPV扩增引物,由宝生物工程(大连)有限公司合成。引物序列为:NS-F:5'-CA ATGGATCAAACCGAAGAAA-3'; NS-R: 5'-CCGA ACAAAGAGTCACCAACC-3'。扩增条件为:94℃4 min;94℃ 30 s、52℃ 30 s、72℃ 1 min,30次循环;72℃ 10 min。PCR产物用上海华舜公司胶回收(小量)试剂盒回收,将其克隆于pMD18-T载体中,构建重组质粒,经PCR鉴定后由宝生物工程(大连)有限公司测序,基因序列与GenBank中CPV序列进行比对分析。
1.6.4 动物回归试验 将6只2月龄~4月龄犬随机分为2组,对照组2只,口服生理盐水1 mL;实验组4只,口服细胞培养病毒104.0TCID50/犬,每天观察临床表现,测体温2次,连续观察14 d,并对死亡犬观察剖检变化。
1.7 病毒的致弱 将CPV-YN株通过连续同步接种CRFK细胞传代110代。分别选取第5、10、20、30、50、80、90、100、105和110代种毒以105.5TCID50/犬剂量接种犬,每代次接种犬5只,连续观察14 d,每天观察犬发病及死亡情况。
1.8 弱毒株免疫效力评价 20只2月龄~4月龄犬随机分组,每组5只。免疫组:A组(第90代)、B组(第 105代)和 C组(第 110代),接种剂量为104.5TCID50/犬,对照组:D组接种灭菌生理盐水1 mL。21 d后,4组犬皮下攻击同源强毒,剂量为200 TCID50/犬。攻毒后观察21 d,每日定时测量犬体温,并观察发病及死亡情况。
2 结 果
2.1 病毒分离与培养 接种第5代病毒的细胞,在72 h左右开始出现肿胀、圆缩、凝聚成团,并在细胞核内形成圆形和椭圆形嗜酸性、大小不等的包涵体等。
2.2 病毒的鉴定
2.2.1 形态学观察结果 在培养72 h的病毒培养物负染电镜标本中,可见到多数为空芯,少数为实芯、直径为20 nm、呈圆形的细小病毒粒子(图1)。
2.2.2 HA试验及TCID50测定结果 分离的病毒株第5代细胞培养物的HA效价为1∶256。分离的病毒株病毒滴度由第5代的105.5TCID50/0.1 mL增加到第110 代的 107.1TCID50/0.1 mL(表 1)。
2.2.3 PCR鉴定结果 利用特异性引物对分离株病毒进行PCR扩增,得到与预期片段(297 bp)相符的目的条带(图2)。PCR产物核苷酸测序结果证实,所得病毒序列为CPV病毒序列(命名为YN株)。对测定的NS基因部分序列进行BLAST比对,结果显示,CPV-YN株与CPV-2a亚型中国野毒株B-2004株NS1基因的核苷酸同源关系较近,可达到99%。

2.2.4 动物回归试验结果 用CPV-YN第5代细胞分离的病毒液感染健康犬6 d后,试验组4只幼犬先后发病。3只临床表现为精神不振、食欲减退、呕吐,发热;次日,发病幼犬精神高度沉郁,食欲废绝,剧烈呕吐、腹泻,体温稍高;第7 d~9 d先后死亡。病死幼犬剖检变化显示:肠道粘膜出血、脱落,心脏肿大、发炎,其他器官无特征性变化。对照组2只幼犬临床上无异常(表2)。
2.3 病毒致弱结果 将CPV-YN株经CRFK传代后对犬的致病力逐渐减弱。CPV-YN第5代和第10代次病毒对犬的致病力均为100%,但死亡率开始下降,发病犬体温升高、鼻流清液、排稀便等临床症状;CPV-YN第20代、30代、50代次毒对犬的致病力由80%下降到20%,从50代开始感染犬不死亡。从80代开始到110代CPV-YN对犬的发病率和死亡率均降到0。对照犬均正常(表3)。
2.4 弱毒株免疫效力评价结果 免疫组(A、B、C组)犬在接种后21 d,皮下攻击同源强毒,观察21 d无发病症状,也未死亡。而对照组(D组)犬则100%发病,死亡率为40%。发病犬表现为体温升高平均在40℃左右、呕吐、排番茄汁样便等临床症状(表 4)。
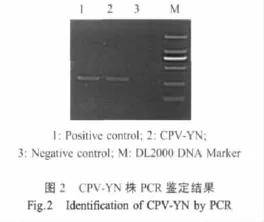
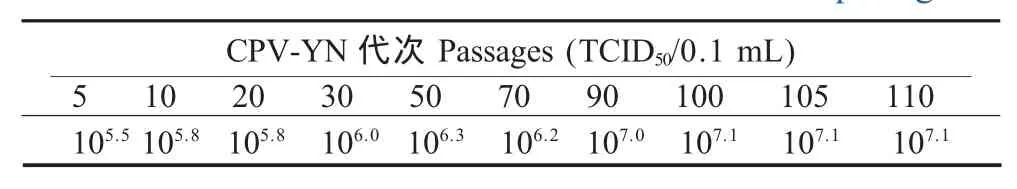
表1 CPV-YN株不同代次滴度测定结果Table 1 The virus titers of CPY-YN of different passages
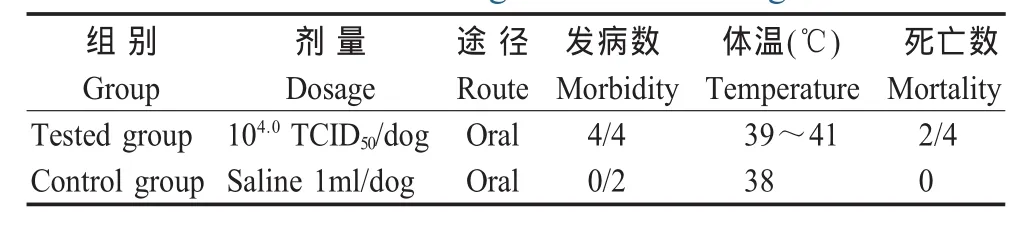
表2 动物回归试验结果Table 2 The regression test in dogs
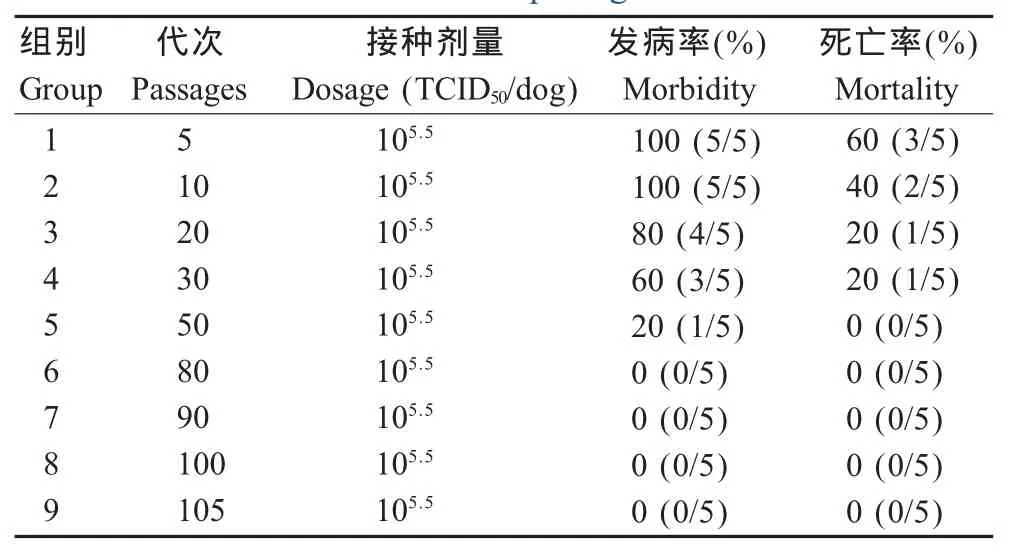
表3 CPV-YN株致弱评价结果Table 3 The evaluation of CPV-YN pathogencity for dog at different passages
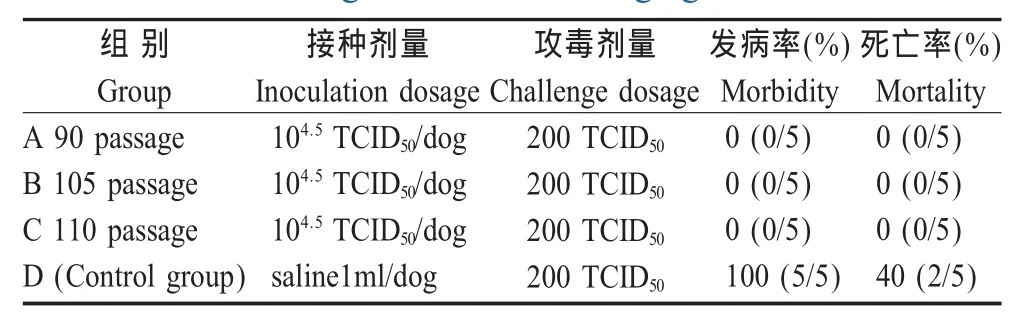
表4 CPV-YNR株免疫效力试验Table 4 The protection of dogs immunized with CPV-YNR against CPV challenging
3 讨 论
CPV在FK81细胞中增殖后可导致细胞圆缩、脱落等,而在MDCK、BHK21、Vero细胞及CEF细胞中生长时不能观察到明显的CPE[11]。本研究曾选用MDCK细胞和Vero细胞进行病毒分离,但效果不理想,后选用CRFK细胞分离,则可见明显的CPE,与之前的研究结果一致[12],原因可能是因为CPV对不同细胞系的敏感性不同造成的。CPV完全依赖宿主细胞DNA的复制机制进行复制,病毒的接种最好采用同步接种方式[13]。本研究将CPV-YN株同步接种CRFK,CPE出现较规律,即接毒后72 h,细胞开始圆缩、凝集成团。
有研究显示接毒的猫肾细胞培养物与兔抗CPV高免血清,按50∶1的比例混合,容易观察到凝集的免疫复合体。如果不加高免血清而单纯负染观察,只能观察到单个粒子或2个~3个粒子凝集在一起,并且很难找到。即使找到病毒粒子,也很难确认。可以肯定,猫肾细胞培养中含有大量的CPV粒子,兔抗CPV高免血清以50倍稀释为宜,这给其它血清学检测方法提供了参考依据[14]。本研究在电镜下,病毒为散在实芯和空芯、直径为20 nm、圆形、无囊膜的颗粒,通过动物回归试验也证明了分离得到的为CPV。
对该毒株NS基因遗传演化结果分析显示,CPV-YN株与CPV-2a亚型中国野毒株B-2004株NS1基因的核苷酸同源关系较近(99%)。但是该毒株的抗原性还需进一步研究,才能解决是否由于我国流行毒株与传统疫苗株抗原产生了差异而导致该病流行的问题。
对不同代次细胞培养进行免疫效力比较试验结果表明,用CPV-YN的第90代次~110代次细胞毒104.5TCID50接种犬,即可对犬提供100%保护。加之该弱毒株由分离自CPV高发区的野毒株驯化而来,因而其抗原针对性良好,可以作为用于防控CPV的候选疫苗株,为CPV单价苗或多价苗的研制奠定了基础。
[1]Battilani M,Scagliarini A,Ciulli S,et al.High genetic diversity of the VP2 gene of a canine parvovirus strain detected in a domestic cat[J].Virology,2006,352(1):22-26.
[2]Appel M J,Scott F W,Carmichael L E.Isolation and immunization studies of a canine parco-like virus from dogs with haemorrhagic enteritis[J].Vet Rec,1979,105(8):156-159.
[3]梁士哲,渠川玫,魏喜仁,等.犬传染性肠炎的研究I-腹泻犬粪便中检出的细小病毒颗粒[J].上海畜牧兽医通迅,1982,2(4):172.
[4]徐汉坤,郭保发,金淮,等.血凝和血凝抑制试验在犬群暴发犬细小病毒肠炎中的应[J].中国畜禽传染病,1983(4):43-45.
[5]Decaro N,Desario C,Parisi A,et al.Genetic analysis of canine parvovirus type 2c[J].Virology,2009,385(1):5-10.
[6]Dokia M,Fujita K,Miura R,et al.Sequence analysis of VP2 gene of canine parvovirus isolated from domestic dogs in Japan in 1999 and 2000[J].Comp Immunol Microbiol Infect Dis,2006,29(4):199-206.
[7]Chapman M S,Rossmann M G.Structure,sequence,and function correlations among parvoviruses[J].Virology,1993,194(2):491-508.
[8]Ikeda Y,Nakamura K,Miyazawa T,et al.Feline host range of canine parvovirus:Recent emergence of new antigenic types in cats[J].Perspectives,2002,8(4):1-11.
[9]Pe'rez R,Francia L,Romero V,et al.First detection of canine parvovirus type 2c in South America[J].Vet Microbiol,2007,124(1-2):147-152.
[10]Decaro N,Elia G,Martella V,et al.Characterisation of the canine parvovirus type 2 variants using minor groove binder probe technology[J].J Virol Meth,2006,133(1):92-99.
[11]刘忠华,钟翎,张钰,等.PCR方法检测犬细小病毒生长动态及与其它方法的比较[J].上海实验动物科学,2000,22(1):20-22.
[12]魏巍,李肖梁,帅江冰,等.犬细小病毒HZ0761株的分离与鉴定[J].畜牧与兽医,2008,40(7):1-4.
[13]符子华,李淑霞,呼西旦,等.犬细小病毒新疆株的分离与初步鉴定[J].中国兽医科技,1994,24(11):21-23.
[14]李六金,李秦,张海,等.犬细小病毒流行毒株的分离与鉴定[J].青海科技,2000,7(6):9-12.
——W 字幼犬队

