苯乙酸钠诱导人白血病细胞 HL60凋亡及其机制
, , ,,
(中国医科大学附属盛京医院,沈阳 110022)
苯乙酸钠(NaPA)是一种苯丙氨酸的生理性代谢产物,对多种肿瘤细胞有明显的诱导分化和逆转肿瘤表型作用[1~3],且毒性很低,其抗癌作用及其机制的研究日益受到重视,但其在白血病的研究中鲜见报道。2010年 2~3月,我们通过应用不同浓度NaPA诱导 HL60细胞,探讨 NaPA在促进人白血病细胞 HL60凋亡中的作用及机制。
1 材料与方法
1.1 材料 人白血病细胞 HL60由沈阳市军区总医院细胞生物实验室提供;NaPA购于美国 Fluka公司;CCK-8购自上海同仁研究所;碘化丙啶(PI)购自美国 Sigma公司;RPMI 1640购自美国 clone公司;ECL化学发光底物系统购自 Milipore公司;鼠抗人Bcl-2和 Bax单克隆抗体购自美国 Santa cruz公司;血小板衍化生长因子 β(PDGF-β)ELISA试剂盒购自上海研吉生物科技有限公司。
1.2 方法
1.2.1 细胞培养 人白血病细胞 HL60培养于含10%小牛血清和 100 U/m l青霉素和链霉素的 RPMI 1640培养基中,37℃、5%CO2的恒温密闭培养箱内传代培养,细胞悬浮生长。2~3 d传代 1次,取对数生长期的细胞用于实验。
1.2.2 HL60细胞存活率测定 细胞生长至对数生长期,按 1×106个 /ml的细胞浓度接种于 96孔板,每孔 200μl。设对照组(无 NaPA诱导)和实验组。实验组包括 :不同浓度 NaPA(5、10、15 mmol/L)诱导 HL60细胞和不同诱导时间组(12、24、48 h)。各组分别设 4个复孔。在 RPMI 1640培养液中依据实验设计加入不同浓度NaPA。实验结束后,每孔加入10μl CCK-8溶液。微震荡后 37℃细胞培养箱内继续孵育 1 h。酶标仪上测出波长 450 nm处的各孔光密度(OD值)。细胞相对存活率 =(OD实验组/OD对照组)×100%。实验重复 3次。
1.2.3 HL60细胞周期变化检测 5、10、20 mmol/L NaPA 3个药物浓度诱导 HL60细胞 24 h进行细胞周期分析,同时设置对照组(无药物诱导组)。培养不同时间后收集细胞用 PBS洗涤 3遍,70%乙醇悬浮细胞 4℃过夜。然后 PBS洗涤 2遍,PI染色 30 min,检测分析。
1.2.4 细胞培养上清 PDGF-β检测 5、10、20 mmol/L的 NaPA诱导 HL60细胞,每个浓度梯度设立 3个复孔,同时设立空白对照孔,24 h后收集细胞培养液上清。用 ELISA试剂盒检测 PDGF-β水平,操作按 ELISA试剂盒说明书进行。
1.2.5 Bcl-2和 Bax的表达检测 5、10、20 mmol/L的 NaPA诱导 HL60细胞,并设置对照组。培养 24 h后,离心收集。收集到的细胞用预冷的 PBS漂洗 2遍,加入适量的细胞裂解液及蛋白酶抑制剂置冰上30min后,以 12 000 r/min于 4℃离心 10min,调整蛋白浓度,加入 5×SDS-PAGE加样缓冲液,置 95~100℃沸水中变性 5 min。80 V恒压电泳后,过夜转至 PVDF膜上。用 5%脱脂奶粉封闭 1.5 h,TTBS洗膜后,加 1∶1 000稀释后的一抗,37℃孵育 1.5 h。加HRP标记二抗 37℃孵育 40min。洗膜,ECL显影。
1.2.6 统计学方法 运用 SPSS 16.0统计软件分析数据,数据以±s表示,用 t检验分析差异显著性,以 P≤0.05为差异有统计学意义。
2 结果
2.1 细胞存活率 不同浓度 NaPA对 HL60细胞存活率的影响见表1。由表 1可见,随着药物浓度的增加HL60细胞存活率降低,且呈剂量依赖性(P<0.01)。
表1 NaPA对 HL60细胞的存活率的影响(±s)

表1 NaPA对 HL60细胞的存活率的影响(±s)
注:与对照组比较,*P<0.01
组别 12 h 24 h 48 h对照组 100 100 100 NaPA 5mmol/L组 84.69±3.14*76.75±2.41*69.87±3.52*NaPA 10mmol/L组 71.65±3.25*65.45±5.32*58.45±4.32*NaPA 20mmol/L组 54.65±2.09*43.62±4.78*39.72±3.47*F值 743.29 654.27 456.24 P<0.01 <0.01 <0.01
2.2 细胞周期分布 见表 2。由表2可见,不同浓度 NaPA诱导 HL60后 24 h细胞周期结果分析表明,DNA合成期(S期)细胞比例明显减少,发生了明显的G0/G1期阻滞,并呈现出剂量依赖性(P<0.01)。
表2 不同浓度 NaPA对 HL 60细胞周期分布的影响(±s)
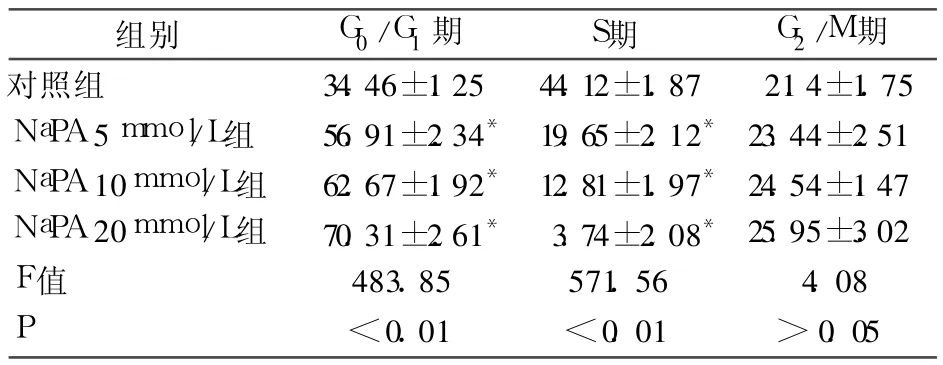
表2 不同浓度 NaPA对 HL 60细胞周期分布的影响(±s)
注:与对照组比较,*P<0.01
组别 G0/G1期 S期 G2/M期对照组 34.46±1.25 44.12±1.87 21.4±1.75 NaPA 5mmol/L组 56.91±2.34*19.65±2.12*23.44±2.51 NaPA 10mmol/L组 62.67±1.92* 12.81±1.97*24.54±1.47 NaPA 20mmol/L组 70.31±2.61* 3.74±2.08*25.95±3.02 F值 483.85 571.56 4.08 P<0.01 <0.01 >0.05
2.3 PDGF-β分泌 在 NaPA诱导 HL60细胞的上清液中,对照组、NaPA 5、10、20mmol/L组 PDGF-β的分泌量分别为(825.64±57.24)、(512.58±64.45)、(323.51±45.61)和(218.43 ±51.34)pg/ml,随着 Na-PA的诱导浓度增大而降低(F=18 120,P<0.01)。
2.4 Bcl-2及 Bax表达 5、10、20 mmol/L的 NaPA诱导 HL60细胞 Bcl-2的表达量随 NaPA诱导浓度增加而降低,而 Bax的表达量随 NaPA诱导浓度增加而明显增加。见图 1。
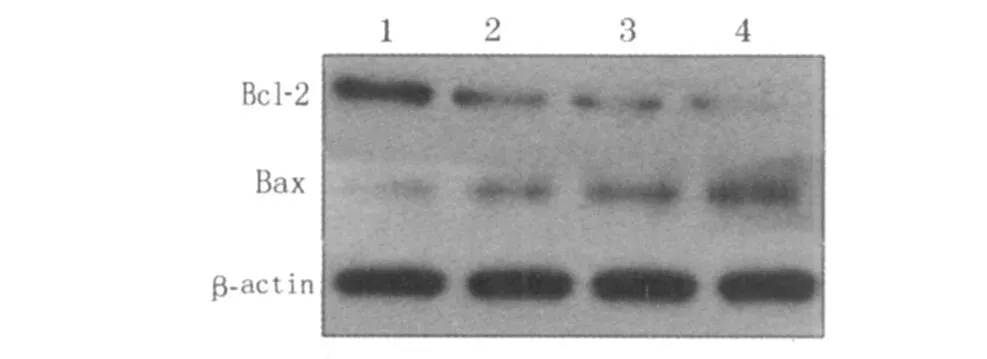
图1 Bcl-2及 Bax蛋白免疫印迹法检测结果
3 讨论
NaPA作为一种对人体无毒性的分化诱导剂,具有诱导多种肿瘤细胞向成熟分化[4]和凋亡等生物学作用,因此日益受到重视。但其作用机制尚未完全明确,仍然需要进一步的探索。
本研究结果表明,NaPA可通过影响人白血病细胞 HL60的 G0/G1期到 S期这个关键点而抑制人白血病细胞 HL60细胞的生长,使肿瘤细胞生长阻滞在G0/G1期,且这种变化呈剂量依赖。转化生长因子 β是一种多功能细胞因子,可通过调节微环境中的生长因子来正负调控各种细胞的增殖。其促增殖作用主要是通过诱导细胞 c-sis基因编码的PDGF-β起作用。本文研究结果表明,人白血病细胞HL60的培养上清液中PDGF-β分泌量随着NaPA的诱导浓度增大而降低。因此推测 NaPA可通过调节生长因子的合成及释放来影响细胞生长。Bcl-2是细胞死亡的负性调节因子,可延长非周期细胞的寿命,抑制周期细胞的凋亡。而同属 Bcl-2家族的Bax的作用与 Bcl-2相反,可促进凋亡[5]。本研究结果表明,将 NaPA作用于人白血病细胞 HL60,检测到 Bcl-2降低,同时发现 Bax的表达增高。与 Adam等[6]研究得到的结果相似。据此可推测调节 Bcl-2家族中的 Bcl-2和 Bax的表达为 NaPA诱导多种肿瘤细胞凋亡的机制之一。
[1]Samid D,Wells M,Greene ME,et al.Peroxiso meproli ferator-activated receptor gamma as a novel target in cancer therapy:binding and activation by an aromatic fattyacid with clinicalantitumor activity[J].Clin Cancer Res,2000,6(3):933-941.
[2]Di Benedetto M,Starzec A,Vassy R,et al.Inhibition of epidermoid carcinoma A 431 cell growth and angiogenesis in nudemice by early and late treatmentwith a novel dextran derivative[J].Br J Cancer,2003,88(12):1987-1994.
[3]Gervelas C,Avramoglou T,Crepin M,et al.Growth inhibition of humanmelano matumor cellsby the combination of sodium phenylacetate(NaPA)and substituted dextrans and one NaPA dextran conjugate[J].Anticancer Drugs,2002,13(1):37-45.
[4]WatanabeM,Sugano S,Imai J,et al.Suppression of tumourigenicity,and induction of differentiation of the canine mammary tumour cell line MCM-B2 by sodium phenylacetate[J].Res Vet Sci,2001,70(1):27-32.
[5]金琳芳,陈同钰.Bc l-2基因蛋白家族与细胞凋亡[J].医学综述,2005,11(5):446-447.
[6]Adam L,Crepin M,Israel L.Tumor growth inhibition,apoptosis,and Bcl-2 down-regulation ofMCF-7ras tumors by sodium phenylacetate and tamoxifen combination[J].Cancer Res,1997,57(6):1023-1029.

