泡沫分离法提取文冠果果皮皂苷的工艺条件
吴伟杰,李博生
(北京林业大学 生物科学与技术学院,北京 100083)
文冠果树的适应性强,抗旱、耐瘠薄和耐寒能力强。在内蒙古、辽宁、河北、山西、陕西等省均有栽种,是我国北方重要的木本油料树种。文冠果种子含油率高达35% ~40%[1],文冠果籽油是优质的食用油,也可作为生物柴油的原料。生物柴油作为清洁可再生能源,对经济可持续发展,推进能源替代,减轻环境压力,减少碳排放,应对气候变暖有着重要的战略意义。文冠果果实的综合利用是降低生物柴油生产成本的重要途径之一。文冠果包括果皮和种子,两者比例为1∶1。年产10万t生物柴油,需要文冠果种子30万 t,同时产生30万 t果皮,而目前文冠果果皮主要用作活性炭原料,没有得到有效地利用。文冠果果皮含有1.5%~2.4%的皂苷。研究表明,文冠果果皮皂苷具有良好的抗肿瘤活性、显著改善多种记忆障碍、抗缺氧、抗氧化、抗疲劳等功效[2]。文冠果果皮皂苷的开发所产生的附加价值可以有效地降低生物柴油的生产成本。在生产生物柴油的过程中要处理极大量的果皮,就须寻求简捷易行、高效率、环境友好的皂苷分离方法。
目前,皂苷的分离方法主要有萃取法和大孔树脂吸附分离法。乙醇-正丁醇萃取分离工艺已经应用于无患子皂苷的提取分离中[3],但所需溶剂量大,纯度低。采用大孔树脂分离法纯度较高,但周期长,溶剂耗量大,树脂成本高[4]。
泡沫分离是一种成本低、工艺简捷、环境友好、适于大规模工业化生产的分离方法。皂苷是一种天然的表面活性剂,无需另加表面活性剂[5]。泡沫分离法已广泛用于人参皂苷、无患子皂苷、甘草等的分离,并考察了气速、pH值、初始浓度、料液温度等对泡沫分离的影响[6-8],而文冠果果皮皂苷泡沫分离纯化的研究尚未见报道。我们应用泡沫分离法对文冠果果皮皂苷进行分离纯化,并对其工艺条件优化及影响因子作了探讨。
1 材料与方法
1.1 材料
文冠果果皮:采于内蒙古赤峰,50℃烘干,粉碎机粉碎。所用试剂均为分析纯。
1.2 仪器与设备
仪器:SHB循环水多用真空泵,郑州长城科工贸有限公司;721紫外可见分光光度计,上海光谱仪器有限公司;DF204电热鼓风干燥箱,北京西城区医疗器械二厂;高速万能粉碎机,天津市泰斯特仪器有限公司;FA10004A电子天平,精天精密仪器厂;旋转蒸发仪;6 cm×70 cm树脂柱;气体流量计;气泵。
1.3 实验方法
1.3.1 文冠果果皮的总皂苷含量测定
称取干燥恒重的人参皂苷Re 4.35 mg,用无水甲醇定容至10 mL(对照品)。吸取对照品溶液0.1、0.2、0.3、0.4、0.5 mL,分别加入10 mL试管中,水浴挥尽溶剂,加新配制的5%香草醛冰醋酸溶液0.2 mL和高氯酸0.8 mL,70℃水浴加热15 min,加冰醋酸5.0 mL,摇匀,静置15 min,立即用分光光度计于546 nm波长处测定吸光度[9],绘制标准曲线。
称取干燥恒重的文冠果果皮粉末200 g,置于2 000 mL圆底烧瓶中,加入70%乙醇1 400 mL,70℃冷凝回流5 h。滤去残渣,回收乙醇至20%,室温静置过夜,过滤除去胶质,继续回收乙醇得浸膏8.365 g。浸膏用8倍水量溶解,3 500 r·min-1离心15 min,上清液用乙酸乙酯 (1∶1,V∶V) 萃取3次,除去杂质,水层继续用水饱和正丁醇(1∶1,V∶V)萃取3次,合并正丁醇相,浓缩得浸膏[10]。浸膏用60 mL水溶解,经滤膜过滤,吸取0.5 mL加入100 mL容量瓶中用甲醇定容至刻度,制备成待测液。吸取0.5 mL待测液于试管中,水浴蒸干溶剂,采用皂苷测定方法,计算出文冠果果皮总皂苷的含量。
1.3.2 泡沫分离法纯化文冠果果皮皂苷单因素实验
分别以初始浓度、气体流速、温度、pH为单因素进行单因素实验,考察各单因素对泡沫分离法纯化文冠果果皮皂苷效果的影响,重复3次。
1.3.3 优化泡沫分离法纯化文冠果果皮皂苷的工艺条件正交试验
通过单因素水平实验[11],筛选确定正交试验各因素1~3水平 A初始浓度 1,2,3 mg·mL-1,B气体流速 1.5,2.0,2.5 L·min-1,C温度 20,35,50℃,D pH值3,5,7。
2 结果与分析
2.1 文冠果果皮的总皂苷含量
以人参皂苷为标准样,按皂苷的测定方法,y表示吸光度,x表示皂苷的含量,得回归方程为:y= 2.963 2 x -0.010 3。两者的相关系数 R2=0.999 3。可见,皂苷含量与溶液吸光度呈密切相关。据此测得文冠果果皮的总皂苷含量为1.973%。该检测方法完全可用于研究泡沫分离工艺检测皂苷的含量变化。
2.2 初始浓度对皂苷富集效果的影响
在温度20℃,气体流速2.5 L·min-1,pH值5的条件下,考察初始浓度对皂苷富集效果的影响,结果 (图 1)显示,在初始浓度为 1~2 mg·mL-1时,随着初始浓度的增加,富集比升高2.02%,纯度升高3.73%;初始浓度在2~5 mg·mL-1时,随着浓度的增加,回收率升高14.65%,而富集比和纯度分别下降29.7%和10.15%。
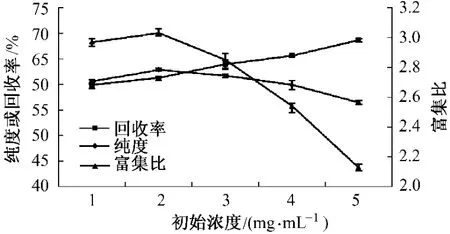
图1 初始浓度对皂苷富集比、回收率和纯度的影响
究其原因,可能初始浓度1~2 mg·mL-1时,随着浓度的增加,泡沫稳定性增强,夹带的皂苷量增多,因而提高了富集比;而初始浓度在2~5 mg·mL-1时,随着浓度增高,形成大量细密稳定的泡沫,皂苷量和夹带的液体量增多,夹带液的增率高于皂苷的增率,富集比下降。初始浓度在1~2 mg·mL-1时,泡沫夹带的皂苷量增多,因此纯度升高;在2~5 mg·mL-1时,夹带的皂苷量和非皂苷类固形物也随之增多,非皂苷类固形物的增率大于皂苷的增率,纯度开始降低。随着浓度的增加,泡沫的稳定性增强,夹带的皂苷量增多,回收率逐渐增大。到达5 mg·mL-1时,回收率虽然升高,但此时富集比和纯度下降。由此综合考虑,初始浓度以2 mg·mL-1左右为宜。
2.3 pH对皂苷富集效果的影响
在初始浓度为2 mg·mL-1,温度20℃,气体流速2.5 L·min-1下,考察初始浓度对富集效果的影响,结果 (图2)表明,pH值在3~5时,富集比、回收率和纯度升高;pH在5~11时,富集比和纯度降低。pH在3~7时,随着pH的升高,回收率升高;pH在7~11时,回收率降低。

图2 pH值对皂苷富集比、回收率和纯度的影响
分析其原因,pH值在3~5时,泡沫稳定性增加,泡沫夹带的皂苷量增多,因而提高了富集比;而当pH值在5~7时,形成大量细密稳定的泡沫,皂苷量及夹带的液体量增多,前者增率小于后者,富集比下降;当pH值在7~11时,泡沫稳定性降低,皂苷量及夹带的液体量均降低,前者降低率大于后者,富集比继续下降。pH值在3~5时,泡沫夹带的皂苷量增多,纯度升高;pH值在5~7时,皂苷量及夹带的非皂苷类固形物增多,前者增率小于后者增率,纯度降低;pH在值7~11时,皂苷量及非皂苷类固形物降低,前者降低率大于后者,纯度持续降低。pH值在3~7时,夹带的皂苷量增多,回收率逐渐增大;pH值在7~11时,泡沫夹带的皂苷量降低,回收率降低。pH值在5~7时,回收率升高,但富集比和纯度下降。综合考虑,pH值以5左右为宜。
2.4 温度对皂苷富集效果的影响
如图3所示,在初始浓度为2 mg·mL-1,气体流速为2.5 L·min-1,pH值5下,35℃时的富集比比20℃时升高,回收率略有升高,纯度降低;从35℃增加到80℃,富集比降低了24.41%,纯度降低。20~50℃时,回收率增加;50~80℃时,回收率降低。

图3 温度对皂苷富集比、回收率和纯度的影响
分析其原因,温度在20~35℃时,泡沫起泡性增强,泡沫夹带的皂苷量增多,因而提高了富集比;35~50℃时,泡沫粘度增高,皂苷量及夹带的液体量增多,前者增率小于后者,富集比下降;温度在50~80℃,泡沫起泡性减弱,皂苷量及夹带的液体量减少,前者降低率大于后者,富集比持续降低;20~50℃时,泡沫中皂苷量及非皂苷类固形物增多,前者增率小于后者,纯度降低;温度在50~80℃时,皂苷量及非皂苷类固形物降低,前者降低率大于后者,纯度持续降低;温度在20~50℃时,泡沫夹带的皂苷量增多,回收率增大;温度在50~80℃时,夹带的皂苷量减少的,回收率降低;温度在50℃时,比35℃的回收率升高;pH值在5~7时,回收率升高,但富集比和纯度均下降。综合考虑,温度以35℃左右为宜。
2.5 气体流速对皂苷富集效果的影响
在初始浓度为 2 mg·mL-1,温度20℃,pH值 5的条件下,气体流速从 1 L·min-1增至 3 L·min-1,富集比降低了 29.02% (图 4);从 1 L·min-1增到2 L·min-1时,纯度达到最高点,气体流速继续增高到 3 mL·min-1时,纯度从64.97%降到60.28%。

图4 气体流速对皂苷富集比、回收率和纯度的影响
分析其原因,当气体流速为1~3 L·min-1时,随着气体流速的升高,气泡在分离设备中停留时间短,皂苷量及夹带的液体量增多,前者增率小于后者,富集比降低;1~2 L·min-1时,皂苷含量增多,纯度增大;在气体流速为 2~3 L·min-1时,皂苷量及夹带的非皂苷类固形物增多,前者增率小于后者,纯度降低;气体流速为1~3 L·min-1时,皂苷量增多,回收率增大;在气体流速为3 L·min-1时,回收率升高;pH值5~7时,回收率升高,但富集比和纯度均下降。综合考虑,气体流速以 2 L·min-1为宜。
2.6 正交试验结果
L9(34)正交试验结果 (表1)表明,回收率、富集比及纯度都是指标越大越好,尤以回收率和纯度对于文冠果果皮皂苷的提纯更为重要,因此根据实际的生产需要,回收率及纯度的权重各占40%,富集比占20%。其中,富集比=C0/C;回收率= (C0×V0) /(C×V);纯度= (C0×V0) /m0;y= ( y1n/y1max×0.4+ y2n/y2max×0.2+ y3n/y3max×0.4) ×100(C0和 C分别指收集液和初始液中文冠果果皮总皂苷的浓度,V0和V分别指收集液和初始液的体积,m0为收集液烘干后所得产品的质量,y为综合得分,y1为回收率,y2为富集比,y3为纯度)。
根据表1的极差分析可知,文冠果果皮总皂苷泡沫分离效果影响因素的主次为:初始浓度>气体流速>pH>温度。

表1 泡沫分离条件的筛选结果
根据方差结果,初始浓度和气体流速因素均为显著因素;pH和温度对分离的影响不显著。这主要是因为料液的浓度决定了溶液中表面活性物质的浓度,从而影响了溶液的起泡能力及泡沫的稳定性。气体流速决定泡沫的产生速度以及泡沫的大小,从而影响文冠果果皮总皂苷的富集和纯化。而温度和pH对溶液的起泡性及泡沫的稳定性影响不大。
由表1可以看出,正交实验得出文冠果果皮总皂苷泡沫分离的最佳工艺条件为A2B3C1D2,即料液初始浓度 2 mg·mL-1,气体流速 2.5 L·min-1,温度20℃,pH值5。此时的富集比为3.05,回收率为60.02%,纯度为63.35%。
3 小结与讨论
本实验测得文冠果果皮总皂苷含量为1.973%。不同产地的文冠果果皮皂苷含量变动在1.887 0% ~2.007 8%[12]。本实验得出文冠果皂苷泡沫分离的最佳工艺条件为:料液初始浓度2 mg·mL-1,气体流速 2.5 L·min-1,温度20 ℃ ,pH值5。相对于人参、三七等皂苷泡沫分离时使用的气体流速来说,文冠果果皮的气体流速较低,这样可以更大限度地减少能耗,降低成本。泡沫分离可在室温条件下进行,避免了加热所需的能量消耗。经测定,文冠果果皮皂苷的水溶液pH值在5左右,所以进行泡沫分离时无需调节pH值。此时的富集比为3.05,文冠果皂苷的回收率为60.02%,纯度为63.35%。泡沫分离法可以达到较高的富集比,纯度和回收率,本实验使用的是实验室自制的起泡装置。人参、三七等皂苷泡沫分离装置已经相应成熟,可以进行工业化生产,并且可以更好地控制各参数的变化,如果应用到文冠果果皮皂苷的纯化,可进一步提高皂苷的纯度和回收率。
可见,泡沫分离法作为初步分离文冠果皂苷的方法是可行的。皂苷应用范围越来越广泛,如医药、食品添加、表面活性剂等,对皂苷纯度的要求差别较大,故通过气泡提取得到的皂苷也可能直接应用到食品添加或表面活性剂,而医药要求较高的纯度,气泡提取可作为有效的皂苷初提,对于生物柴油生产,既可节约提取成本、减少前期投入,又避免了环境污染,这对促进生物能源树种文冠果迅速发展有重要现实意义。
[1]王中山,王玉欣.文冠果 [J].特种经济动植物,2002(11):29.
[2]黄玉广,乔容群,赵军.文冠果营养及综合加工 [J].食品研究与开发,2004,25(3):73-75.
[3]饶厚曾,郭隆华.无患子皂苷提取工艺研究 [J].江西科学,2002,20(1):55-58.
[4]魏凤玉,余锦城.天然无患子皂苷的提取分离 [J].安徽化工,2007,33(3):15-17.
[5]韩丽,苏艳桃,杨明.泡沫分离技术在皂苷分离中应用的探讨 [J].世界科学技术-中医药现代化,2004,6(6):60-62.
[6]修志龙,张代佳,贾凌云,等.泡沫分离法分离人参皂苷[J]. 过程工程学报,2001,7(3):289-292.
[7]魏玉凤,张静,解辉.泡沫分离纯化无患子皂苷 [J].中成药,2009(7):1021-1024.
[8]苏艳桃,韩丽,张艳艳,等.甘草皂苷分级泡沫分离工艺研究 [J].中成药,2006(11):1571-1573.
[9]李光勋,王力华,陈玮.分光光度法测定文冠果果皮总皂苷含量研究 [J].安徽农业科学,2008,36(8):3071-3072.
[10]李光勋,王力华,陈玮.正交试验优选文冠果果皮中文冠果皂苷提取工艺 [J].食品科学,2009,30(2):58-60.
[11]兰洁,李锐,韩丽,等.泡沫分离法分离重楼皂苷的工艺研究 [J].中草药,2008(1):44-48.
[12]郭影,王世成,窦德强.不同产地文冠果果壳中总皂苷含量测定 [J].辽宁中医药大学学报,2009(5):165-166.

