氯化锂对脾切除大鼠海马tau蛋白的影响
谭文斐,田阿勇,王俊科,曹学照,马 虹
(中国医科大学第一医院麻醉科,辽宁 沈阳 110001)
氯化锂能够抑制糖原合成酶-3β(GSK-3β),对蛋白激酶的活性进行调节[1],进而影响 tau蛋白磷酸化。近些年,术后认知功能障碍逐渐成为研究热点,但是,对于手术创伤诱发中枢神经系统炎性反应如何影响与记忆有关的tau蛋白的研究并不多见。研究提示,手术创伤引发了大鼠短暂的记忆下降,并且伴随有海马内炎性因子的释放[2]。因此,探讨手术创伤诱发海马炎性因子是否通过GSK-3β通路介导tau病理变化是很有意义的。
1 材料与方法
1.1 动物和手术 150只♂ 6月龄SD大鼠吸入异氟烷麻醉诱导后气管插管,机械通气维持异氟烷浓度为1.5%,麻醉期间保持大鼠直肠温度在(36~37)℃。大鼠随机分为4组:健康对照组(group A,n=15);麻醉组(group B,n=45);手术和氯化钠组(group C,n=45),异氟烷麻醉后脾切除,腹腔注射氯化钠;手术和氯化锂组(group D,n=45),异氟烷麻醉后脾切除,腹腔注射氯化锂 200 mg·kg-1[3],从实验开始持续至术后7 d,每天1次。氯化钠组给予同等容积的氯化钠。B、C、D组所有动物均麻醉2 h,B组麻醉2 h后即刻处死,C,D 组手术后 1、3、7 d处死(15只/时点)。每个时点标记为 B1、B3、B7、C1、C3、C7、D1、D3 和 D7。
1.2 方法
1.2.1 Real-time PCR 按照参考文献[4],利用 Applied Biosystems(ABI公司,美国)系统进行实时定量 PCR。大鼠 IL-1β上游引物:5'-ATCCCAAACAATACCCA-3',下游引物:5'-CAACTATGTCCCGACCA-3';TNF-α上游引物:5'-CCACGC TCTTCTGTCTACTG-3',下 游 引 物:5'-GCTACGGGCTTGTCACTC-3';3-磷酸甘油醛脱氢酶(GAPDH)上游引物:5'-GCAAGTTCAACGGCACA-3',下 游 引 物:5'-CATTTGATGTTAGCGGGAT-3'。PRISM 7500HT检测系统(ABI公司,美国)进行荧光测定,以 GAPDH为对照,IL-1β mRNA和 TNF-α mRNA 为 测 试,对 循 环 数 Ct值 计 算 后 (比 值(测试/对照)=2Ct对照-Ct测试)进行比较。
1.2.2 Western blot 按照参考文献[5],海马组织用溶解液匀浆处理后提取蛋白。蛋白提取物置入加样缓冲液,100℃煮沸5 min,聚丙烯酰胺凝胶电泳分离,转膜。分别与一抗(1∶500,Signalway Antibody,美国)4℃过夜。其后,膜与辣根过氧化物酶结合二抗室温孵育2 h。最后膜与ECL系统曝光,成像。以β-actin的光密度值做为内参照,采用目标条带与β-actin的光密度值比值做为指标进行统计学分析。
2 结果
2.1 手术创伤诱发炎性反应 与A组比较,B组各时点IL-1β mRNA、TNF-α mRNA、IL-1β 和 TNF-α 的表达水平差异无统计学意义(P>0.05),C组、D 组术后 IL-1β mRNA、TNF-α mRNA和IL-1β的表达上调(P<0.01),见 Tab 1。
Tab 1 Expression of IL-1β and TNF-α mRNA and protein(±s,n=5)
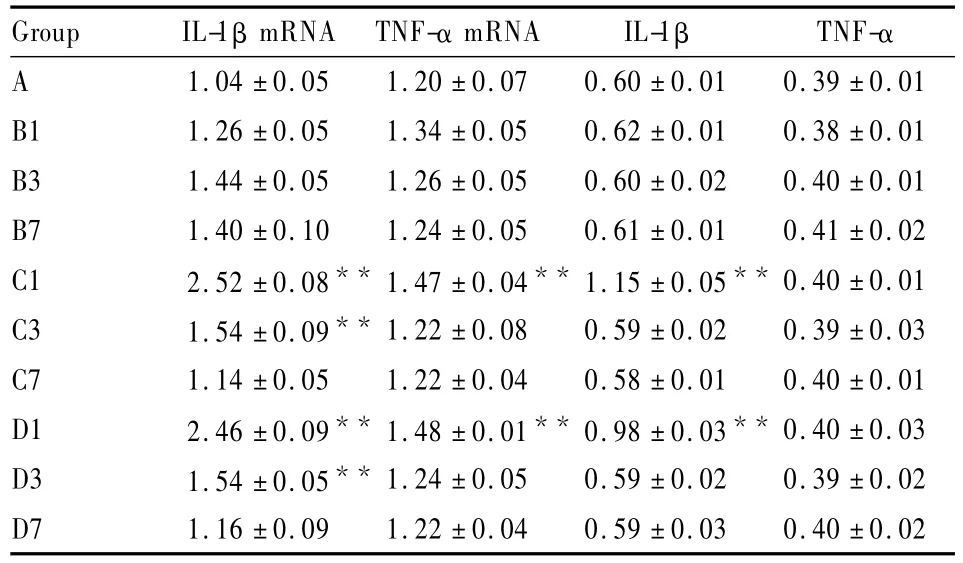
Tab 1 Expression of IL-1β and TNF-α mRNA and protein(±s,n=5)
**P<0.01 vs group A
Group IL-1β mRNA TNF-α mRNA IL-1β TNF-α A 1.04 ±0.05 1.20 ±0.07 0.60 ±0.01 0.39 ±0.01 B1 1.26 ±0.05 1.34 ±0.05 0.62 ±0.01 0.38 ±0.01 B3 1.44 ±0.05 1.26 ±0.05 0.60 ±0.02 0.40 ±0.01 B7 1.40 ±0.10 1.24 ±0.05 0.61 ±0.01 0.41 ±0.02 C1 2.52 ±0.08** 1.47 ±0.04** 1.15 ±0.05** 0.40 ±0.01 C3 1.54 ±0.09** 1.22 ±0.08 0.59 ±0.02 0.39 ±0.03 C7 1.14 ±0.05 1.22 ±0.04 0.58 ±0.01 0.40 ±0.01 D1 2.46 ±0.09** 1.48 ±0.01** 0.98 ±0.03** 0.40 ±0.03 D3 1.54 ±0.05** 1.24 ±0.05 0.59 ±0.02 0.39 ±0.02 D7 1.16 ±0.09 1.22 ±0.04 0.59 ±0.03 0.40 ±0.02
Tab 2Expression of site-specific phosphorylation of tau and GSK-3β(±s,n=5)

Tab 2Expression of site-specific phosphorylation of tau and GSK-3β(±s,n=5)
**P<0.01 vs group A
Group Total tau pT205 pS396 GSK-3β pGSK-3β A 76 ±0.02 B1 1.14 ±0.04 1.22 ±0.03 0.96 ±0.02 0.91 ±0.04 0.76 ±0.03 B3 1.12 ±0.04 1.23 ±0.05 0.97 ±0.05 0.91 ±0.04 0.79 ±0.07 B7 1.14 ±0.05 1.21 ±0.04 0.96 ±0.01 0.91 ±0.05 0.77 ±0.07 C1 1.14 ±0.05 1.23 ±0.08 0.97 ±0.06 0.92 ±0.02 0.76 ±0.04 C3 1.15 ±0.02 4.53 ±0.05** 2.15 ±0.03** 0.90 ±0.06 0.34 ±0.08**C7 1.14 ±0.02 1.22 ±0.06 0.96 ±0.06 0.89 ±0.04 0.76 ±0.06 D1 1.14 ±0.04 1.22 ±0.01 0.97 ±0.01 0.91 ±0.04 0.75 ±0.08 D3 1.14 ±0.04 1.23 ±0.02 0.95 ±0.05 0.89 ±0.06 0.76 ±0.07 D7 1.14 ±0.02 1.22 ±0.05 0.95 ±0.05 0.91 ±0.02 0 1.16 ±0.04 1.22 ±0.01 0.97 ±0.03 0.91 ±0.02 0..76 ±0.07
2.2 炎症反应通过激活GSK-3β诱发tau蛋白磷酸化 与A 组比较,B 组各时点 tau、pT205、pS396、GSK-3β 和 p-GSK-3β的表达水平差异无统计学意义(P>0.05),C组术后pT205和 pS396的表达上调,而 p-GSK-3β表达下调(P<0.01)。D组给予氯化锂后 pT205、pS396和 p-GSK-3β的表达恢复对照水平,说明GSK-3β活性抑制后 tau蛋白磷酸化水平恢复,见Tab 2。这些结果提示,炎性因子对 tau蛋白磷酸化的影响是通过GSK-3β介导的。
3 讨论
Tau蛋白在非神经源性细胞中的过度表达可诱导细胞凋亡[6],而磷酸化 tau蛋白可以诱发神经细胞病理变化[7],损害记忆形成。脾切除术可反映切除一个器官的手术创伤,同时脾又是一个免疫器官,实施脾切除术大鼠海马内激活炎性因子的释放[2]。有研究表明GSK-3β可以被炎性因子 IL-1β和TNF-α激活,导致苏氨酸205位点 tau蛋白磷酸化增加[8]。还有研究发现氯化锂可通过诱导失活形式的 p-GSK-3β表达增高而抑制GSK-3β的活性,进而抑制Tau蛋白磷酸化[5]。这些结果都支持本研究结论。
本研究发现接受脾切除的大鼠,海马内炎性因子可以激活GSK-3β,诱发 tau蛋白高度磷酸化。利用氯化锂抑制GSK-3β的活性,可以使高度磷酸化的tau蛋白恢复正常对照组水平。氯化锂可能成为治疗术后认知功能障碍的临床策略中一个选择。
[1] Li X,Bijur G N,Jope R S.Glycogen synthase kinase-3beta,mood stabilizers,and neuroprotection[J].Bipolar Disord,2002,4(2):137-44.
[2] Wan Y,Xu J,Ma D,et al.Postoperative impairment of cognitive function in rats:a possible role for cytokine-mediated inflammation in the hippocampus[J].Anesthesiology,2007,106(3):436 - 43.
[3] Tsaltas E,Kontis D,Boulougouris V,Papadimitriou G N.Lithium and cognitive enhancement:leave it or take it[J].Psychopharmacology(Berl),2009,202(1 -3):457 -76.
[4] Rosczyk H A,Sparkman N L,Johnson R W.Neuroinflammation and cognitive function in aged mice following minor surgery[J].Exp Gerontol,2008,43(9):840 - 6.
[5] 孙治坤,杨红旗,陆国强,等.氯化锂抑制β-淀粉样蛋白诱导细胞 Tau蛋白磷酸化[J].中国药理学通报,2008,24(1):24-8.
[5] Sun Z K,Yang H Q,Lu G Q,et al.The effects of LiCl on Tau phosphoryla tion induced by β-amyloid peptide[J].Chin Pharmacol Bull,2008,24(1):24 -8.
[6] 李 琪,冯利杰,王海萍,等.tau蛋白的过度表达对非神经源细胞生长与分化的影响[J].中国药理学通报,2008,24(3):365-9.
[6] Li Q,Feng L J,Wang H P,et al.Effects of tau overexpression on non-neuronal cell growth and differentia tion[J].Chin Pharmacol Bull,2008,24(3):365 - 9.
[7] 褚燕琦,张 兰,李 玮,等.人参皂苷对蛋白磷酸酶抑制剂冈田酸拟阿尔采末病细胞模型的影响[J].中国药理学通报,2008,24(7):879 -84.
[7] Chu Y Q,Zhang L,Li W,et al.Effects of ginsenoside on cellular model of Alzheimer disease induced by protein phosphatase inhibitor okadaic acid[J].Chin Pharmacol Bull,2008,24(7):879 -84.
[8] Kitazawa M,Trinh D N,LaFerla F M.Inflammation induces tau pathology in inclusion body myositis model via glycogen synthase kinase-3beta[J].Ann Neurol,2008,64(1):15 - 24.

