回顾与展望肥胖的药物治疗
塞伦 等
肥胖的定义与影响范围
肥胖已成为全球性健康问题,且仍在迅速发展,对其解决已迫在眉睫。其原因很复杂,但根本的机制是能量代谢紊乱及入大于出。在20世纪后半程随着现代化生活模式到来,人们的饮食结构发生了巨大变化,廉价、可口、高能量而低营养的简易食品盛行,以及久坐的生活方式和各种节省人力设备的应用都大大促进了这一问题的发生。即使一天中只有很少的能量过剩都会引起体重增加而至终生受害。随着社会城市化水平和人们收入的不断增加,这一问题仍将加剧。
体重指数(BMI)是体重除于身高的平方,当其≥30kg/m2时即为肥胖,而≥25kg/m2时定义为超重。2005年世界卫生组织评估结果显示,全球成年超重和肥胖患者分别为16亿和4亿,预计到2015年上述两项数据将分别上升到23亿和7亿。此外,随着儿童肥胖率的急剧增长(现约有15%的未成年人为肥胖患者),肥胖对人类健康的危害将提前发生。2005年Olshansky及其同事预测,由于在接下来的几十年中肥胖对健康的影响,20世纪中人类预期寿命上升的趋势将会出现逆转。
对健康的影响
超重和肥胖同高血压、脂代谢异常、血糖代谢异常等这些已明确的危险因素一样也是一种心血管疾病的独立危险因素,随着对过量脂肪组织尤其是腹部脂肪或内脏脂肪作用的深入了解,这一观点得到了理论支持。脂肪组织通过产生游离脂肪酸和致炎因子而引起胰岛素抵抗、脂代谢异常、内皮功能障碍、以及血栓及动脉粥样硬化的发生。
超重和肥胖是2型糖尿病及其并发症(如微血管病变、糖尿足、眼底病变、糖尿病肾病等)发生发展的重要危险因素。另外,肥胖还与多种肿瘤、阻塞性睡眠呼吸暂停、骨骼肌代谢异常、不孕和抑郁症等的发病有关。目前肥胖的手术治疗以其显效快、维持时间长而被认为是肥胖最有效的治疗方法,一项对手术治疗的肥胖患者长期随访的研究显示,体重下降可以使许多肥胖相关疾病状况得以改善并且可增加预期寿命。2007年一个关于肥胖患者手术治疗的回顾性队列研究显示,这些观察者的全因死亡率、糖尿病相关疾病死亡率、冠心病死亡率、相关肿瘤死亡率分别下降了40%、92%、56%、60%。
神经内分泌系统在控制能量代谢中的作用
由于肥胖的手术治疗存在较大的风险,因此研发安全有效且可长期应用的减肥药物成为焦点,而对能量代谢生理机制的研究对此很重要。在过去二十年,这一领域的研究中我们已取得许多进展,接下来的内容就是对这些进展的简要回顾。
控制能量代谢和体重平衡的神经中枢在脑干和下丘脑,外周神经和内分泌信号所携带的关于能量利用率的信息与高级中枢的信息如压力或心情等整合来调节食欲和能量代谢;胰岛释放的胰岛素和来自脂肪组织的体液因子(如瘦素等)与中枢神经系统相互作用来影响长期的能量代谢;作为神经内分泌系统的组成部分,胃肠激素的分泌与进餐和短期内营养素的利用有关(见图1)。食物被摄入后通过刺激消化道的牵张感受器、化学感受器及肠道内分泌激素的局部受体而引起迷走神经兴奋。这些神经元最后汇聚于脑干的延髓孤束核,在此附近的最后区血脑屏障结构不健全,其作为外周循环激素作用的第二位点来影响这些神经回路。肠脑反射环通过从延髓孤束核发出的迷走神经传出纤维支配胃肠道来调节消化功能,另外来自脑干的上行投射系统将信息上传至下丘脑,在那里有控制能量代谢平衡的中枢。在下丘脑的漏斗核和弓状核含有两种功能相反的神经元核群来调节机体的摄食功能。其中的促食欲神经元释放神经肽Y和刺鼠相关蛋白来促进机体进食,相邻的降食欲神经元则通过释放来自阿片黑皮质素前体的黑素细胞刺激因子及苯丙胺来抑制机体摄食。这两种功能相反但又联系紧密的神经元通过对神经内分泌系统反馈的大量信息适时做出细微调节。这其中包含大量胃肠道上传信息。正中隆起与弓状核、漏斗核紧密相连,此处也缺少血脑屏障,这就为瘦素、胃肠激素等体液因子直接作用于食欲调节神经元提供了通路。高级中枢通过奖赏机制和情绪等来影响这一机制的正常进行。弓状核、漏斗核发出的神经元突触投射到室旁核并通过影响下丘脑甲状腺轴改变基础代谢率、交感神经介质释放及体温的变化来调节能量代谢。
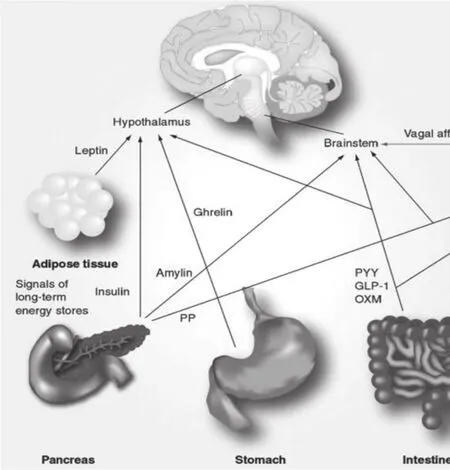
图1 体液因子同迷走神经传入信号一样也能直接影响脑干下丘脑神经介质的释放
单基因遗传引起的肥胖虽然少见但对食欲调节重要通路的研究有很大帮助。例如缺乏阿片—促黑素细胞皮质素原或黑皮质素—4受体(降食欲神经元释放的促黑色素细胞刺激激素的受体)纯合子基因的人容易在早期发生严重的肥胖。有趣的是神经肽Y基因敲出的小鼠模型并不像预想的那样食欲下降而至瘦弱,而是表现为进食正常,这很可能是由于饥饿激活了多种代偿保护通路的原因。传统观点认为机体拥有一套完善的体重调节系统,这一系统对体重下降的保护作用比对抗体重增加的作用更明显,以上的这些发现为这一传统观点提供了有力支持。
遗传作为影响肥胖的常见因素成为最近研究的热点,对这一机制的认识将对新药的研究提供帮助。观察发现,人们对现代生活方式致肥胖的抵抗能力不同。一项关于孪生兄弟(姐妹)的研究显示,在人群中约有70%的肥胖是由遗传因素决定的。因此,把肥胖看成仅仅是吃的太多或活动太少这种大众化观点太过局限和狭隘。当前亟待解决的问题是对于那些易受外因影响而难以维持正常体重的个体其生物学决定因素是什么?要解释肥胖及其他复杂的常见病的高遗传倾向和多种遗传因子之间的相互作用,我们还有很长的路要走。随着高效能的基因组联合研究的进展为新的候补基因的研究铺平了道路,如肥胖者的FTO基因就是一最新例证。高加索地区人群中普遍存在FTO等位基因,其中纯合子成年人比人群平均体重重2~3kg且体重指数较高,儿童时期饱感阈值升高。虽然FTO基因影响肥胖的具体分子机制尚未阐明,但已知其能编码一种2-酮戊二酸依赖性核酸脱甲基酶,这种酶在下丘脑具有较高的表达量。
当前的肥胖治疗方法
生活方式
虽然没有强有力的证据,许多政府决策者仍支持把鼓励人们积极脱离易致肥胖环境和改变生活方式作为方针进行社会干预,当然这些努力是很重要的,但要想短期内把肥胖对人们健康的威胁控制住,这种方法似乎不现实。饮食干预和体育锻炼仍是肥胖治疗的主要方法,并应鼓励与其他治疗方法相结合。单纯坚持限制热量摄入,女性每天1500 kcal,男性每天1800 kcal,而不考虑饮食中营养搭配和进餐时间,可以收到非常相似的减肥效果,两年大约可减2~3kg。体育锻炼可以增加能量消耗并通过增加机体肌肉组织含量而提高基础代谢率,然而不足之处是仅通过生活方式干预并不能使体重得到长期的控制,大多数节食者在3~5年后体重又恢复到基线水平。这一现象即使在接受了饮食控制教育并有预防体重复增知识强力支持的瘦身试验参与者身上同样得到验证,这些参与者均接受了饮食控制教育并可在短期内进行良好的食欲控制,但由于机体自身生物调定点的作用,上述节食效果并不能长期维持。
药物疗法
人们在了解了肥胖对健康危害的同时认识到研发安全有效的减肥药物刻不容缓。不幸的是目前用于体重控制的药物不但数量有限而且效果也不明确,曾经有很多种药物用于降体重的治疗,但由于明显的副作用(如高血压、严重的情绪障碍、明显的心肌病理改变和死亡率的增加)而不得不终止治疗。这些药物的作用机理大多为通过激活中枢肾上腺素能系统而抑制食欲并增加能量的消耗,但这同时也激活了全身的交感神经系统而导致副作用的出现。目前仍有三种安非他明样拟交感神经药物得到了FDA认可而用于临床降体重的治疗。这三种药物是二甲苯乙胺、安非泼拉酮、苯二甲吗啉。这类药物的副作用包括高血压、肺动脉高压及潜在的成瘾性。这三种药物已证明在短期应用中有效,但未用于肥胖的长期治疗。
FDA规定能够用于肥胖长期治疗的药物应该能够使体重较对照组下降至少5%并能维持12个月以上。缓慢但持续的体重下降能明显改善超重和肥胖个体的心血管病危险因素尤其是糖耐量异常状况。对于BMI>30 kg/m2或BMI>27 kg/m2且伴有合并症者均应开始药物治疗,这为降体重药物应用提供了一个潜能巨大的市场,然而目前只有两种药物在美国获得批准用于肥胖的长期治疗,第一种是罗氏生产的奥利司他(塞尼可),另一种是雅培公司生产的西布曲明(诺美婷)。
奥利司他以共价键与脂肪酶活性基团中的丝氨酸残基不可逆结合而抑制其活性。脂肪酶将食物中的甘油三酯水解为可被吸收的游离脂肪酸,应用奥利司他后可使摄入的脂肪的吸收率降低30%,这也是这些药物引起最常见的胃肠道不适和腹泻等副作用的原因所在。有些学者指出应用这些药物的肥胖患者如进食低脂饮食不但可以避免以上副作用还可以使药物发挥最佳效果。长期应用这些药物还有脂溶性维生素缺乏的危险。FDA的药物不良事件报告系统报道了从1999年到2008年间服用奥利司他的肥胖患者中有六例发生了肝衰竭。相关机构正在对这些肝衰竭患者和其他与奥利司他相关的肝损伤者进行分析,但迄今仍没有得出明确的相关性结果。关于奥利司他有效性的临床试验meta分析指出,在为期12个月的实验中服用奥利司他组的肥胖患者较安慰剂组患者体重平均降低2.89kg。由于这种药的治疗效果不明显且可导致严重的副作用因而使应用者难以坚持服用。在加拿大对17,000位服用奥利司他患者进行调查的结果显示,能够坚持应用1年的患者不到10%,坚持应用2年的更是微乎其微,竟不足2%。在2007年,GSK从罗氏公司获得许可,推出了一种小剂量的非处方奥利司他(Alli),当年这种药在美国的销售额达到了119,600,000美元,然而到2008年竟下跌到76,700,000美元,其在欧洲的销售情况具有相同趋势。西布曲明是一种血清素和去甲肾上腺素再摄取抑制剂,它可以使突触间隙5-羟色胺的浓度升高。其可能也是通过提高交感神经活性而增加能量消耗,应该引起注意的是这种药可以使心率加快、血压升高。一项对在肥胖和超重的心血管高危人群中正在进行的前瞻性双盲随机对照试验Sibutramine Cardiovascular Outcomes (SCOUT)所做的分析显示,服用本药的超重和肥胖个体可能会使心血管事件的发生率增加,因此其可用性尚需FDA给予进一步的指示。早期临床meta分析指出,服用西布曲明一年的肥胖患者平均可使体重下降4.2kg并可使他们体重至少降低原体重5%的几率增加20%~30%。
手术治疗
目前从显效性和持久性方面考虑,治疗肥胖的最佳方法是外科手术。胃束带术是一种限制性手术,其将一种可调节性束带套在胃的上部来限制食物的摄入量,Roux-en-Y 胃旁路术包括胃大部切除和近端小肠旷置两部分。胃旁路手术并无明显的致吸收不良作用且接受这种治疗的患者可使体重明显下降,可达原体重的30%而接受胃束带术者只减少原体重的20%,胃旁路手术能迅速降低患者的食欲并使糖代谢状况得到改善,然而仍需一定的时间才能见到明显的体重下降。这一术式的这些优点考虑与分泌胃肠激素部位的解剖变异有关。在胃旁路术后患者体内可见某些抑制食欲的激素如胰升血糖素样肽-1(GLP-1)、多肽YY(PYY)等餐后水平升高而在胃束带术患者体内并没有发现这一现象。GLP-1也可作用于胰岛β细胞增加糖依赖性胰岛素释放及所谓的肠升胰岛素作用。然而胃旁路手术的费用较高而且还有较高的风险及0.5%的死亡率,这将刺激安全有效的减肥药物的研发。
肥胖的其他药物治疗
上述减肥药物的缺点促进了人们对新药的研发。下面的内容将主要阐述几种将来可能用于临床降体重治疗的新型药物。
作用于外周靶点的药物
治疗肥胖的药物其作用机制大体上可分为作用于外周系统药物和作用于中枢系统药物两大类。由alizyme公司研发的脂肪酶抑制剂—cetilistat已进入Ⅲ期临床试验研究,这种药物控制体重的效果与奥利司他相当而且在Ⅱ期临床试验中并没有发现明显的胃肠道不适的副作用。还有几种通过外周作用机制的药物正处于研究阶段,如营养素吸收抑制剂和脂肪酸代谢调节剂。然而这些药还只处于早期研究阶段,有可能将来会用于临床。Fatostatin是新近发现的一种可抑制固醇调控元件结合蛋白的分子,它是调节脂肪生成酶基因编码的主要转录因子。在对肥胖基因ob/ob序列药理学研究中发现用fatostatin干预的小鼠其体重、内脏脂肪含量、血糖均有下降趋势。
作用于中枢靶点的药物
目前有许多作用于中枢靶点的抗肥胖因子正在处于临床研究阶段,它们通过影响食欲调节神经而起作用。临床观察到这类药的副作用比大麻素受体拮抗剂还要严重,内源性大麻素是一种脂类依赖性神经传递因子,接受花生四烯酸的传入信号后激动大麻素受体(CBs)。在中枢神经系统,CB1激活后可引起多种神经递质的释放,如中脑边缘系统的多巴胺,还可以通过调节下丘脑促食欲神经肽和抑食欲神经肽的表达来影响食欲和能量代谢,最终引起食欲增加。由Sanofi-Aventis研制的CB1受体拮抗剂利莫那班在经过4次Ⅲ期临床试验后已在欧洲获准用于减肥的治疗。服用利莫那班的肥胖患者一年后体重较服用安慰剂患者平均下降4.5kg,而且内脏脂肪含量、腹围及其他代谢综合征的指标均有了明显的改善。然而药物售后调查研究显示,服用利莫那班可能会导致神经精神异常,如抑郁、自杀倾向及癫狂症。2007年7月FDA下属内分泌与代谢药物咨询委员会(EMDAC)指出,由于利莫那班生产商Sanofi-Aventis没有提供关于药物安全性方面的足够证据,因此延期批准其生产申请。随后欧洲医药评价署(EMEA)一致认同利莫那班弊大于利并停止了欧洲范围的市场审定。从那时起,所有的制药企业均停止了对中枢作用药CB1拮抗剂的进一步研究。
5-HT2C激动剂
5-HT2受体家族介导了包括欲求行为、情绪和平滑肌功能在内的广泛生理学功能。早期的食欲抑制剂如苯氟拉明和右旋苯氟拉明为低选择性5羟色胺受体激动剂,因发现这种药与心脏瓣膜病有相关性故而在上世纪90年代退出市场,研究发现这一副作用是通过5-HT2B受体亚型介导的。Lorcaserin是一种对5-HT2C比对5-HT2B的选择性强104倍的5-羟色胺受体激动剂,因此其具有食欲抑制作用而无明显的副作用。5-HT2C受体广泛分布于中枢神经系统,包括控制奖赏机制和情绪反应的高级中枢以及下丘脑和孤束核的食欲调节区。5-HT2C基因敲除小鼠表现出肥胖、精神失常及对5羟色胺受体激动剂类减肥药抵抗等。对饮食诱导的肥胖大鼠进行长期lorcaserin治疗发现其对摄食量的控制和体重下降呈剂量依赖性。Lorcaserin已经通过了行为修正后的Ⅲ期临床试验及超重和肥胖治疗试验(BLOOM),第一阶段结果显示治疗一年后Lorcaserin组体重下降5.77kg而安慰剂组只下降2.14kg,另外结果还显示接受药物治疗组患者有47%体重至少下降原体重的5%,22.6%下降原体重的10%,而在安慰剂组分别只有20.3%和7.7%体重下降达到上述标准。值得注意的是在此药两年应用观察期间并没有发现相关性心脏瓣膜病例的报告。在BLOOM试验中因不良事件而放弃继续治疗的比例在lorcaserin治疗组与安慰剂组相似,在治疗第一年时分别为7.1%和6.7%,第二年分别为3.0%和3.0%。
Qnexa
Vivus制药公司研制的Qnexe是一种以小剂量二甲苯乙胺和抗惊厥药托吡酯合成的复合制剂,可用于肥胖的长期治疗。托吡酯是一个由氨基磺酸酯取代单糖的抗癫痫药,用于顽固性癫痫和偏头痛的治疗,它通过阻断电压门控钠通道和GABA及谷氨酸系统来抑制兴奋性神经传递。关于托吡酯促进体重下降的确切机制尚不清楚,然而一项关于此药剂量与体重关系的研究揭示其降体重作用呈剂量依赖性。EQUATE试验第三阶段用了28周的时间对756例肥胖受试者进行了观察,最后对Qnexa的药效进行了评估。试验中服用全量和半量Qnexa患者体重平均分别下降了原体重的9.2%和8.5%,而服用安慰剂的对照组体重只下降了原体重的1.7%。试验还观察到实验组患者在体重下降的同时HbA1c水平也得到了明显改善。试验揭示高剂量实验组感觉异常、口干、味觉改变等并发症的发生率分别为20%、18%、15%。相比较而言,对照组这几种并发症的发生率分别为3%、0%、0%,但对引起情绪异常方面实验组和对照组之间没有差别。
Contrave
Contrave是丁氨苯丙酮和纳曲酮的复合制剂,丁氨苯丙酮是多巴胺和去甲肾上腺素再摄取抑制剂,纳曲酮是一种阿片受体抑制剂,可用于各种成瘾性疾病的治疗。这两种药可以协同阻断内啡肽介导的对阿片-促黑素细胞皮质素原(POMC)神经元的抑制作用,引起下丘脑食欲抑制神经元活性增加。一项由793名肥胖患者参与的名为NB-302的双盲对照试验结果显示,应用此药的实验组体重平均下降9.2~11.4kg而应用安慰剂的对照组只下降7.3kg,且实验组约41.5%的受试者体重下降了原体重的10%而对照组此比例只有20.2%左右。试验中因为不良事件而停用药物的比例实验组为25.9%对照组为13.0%,但试验组和对照组的抑郁症发生率并无差异。然而在试验组有4.6%的患者因恶心反应而停止继续应用药物,且发现这种副作用呈剂量依赖性。
再摄取抑制剂
Tesofensine是一种突触前抑制剂,抑制突触前膜对去甲肾上腺素、多巴胺、5-羟色胺的摄取,这种机制在Neuro Search进行的一项随机对照双盲Ⅱ期临床试验中得到证实。这项实验耗时24周,有203名肥胖患者参与了试验。结果显示,接受Tesofensine治疗的实验组患者体重下降了6.7~12.8kg而对照组下降2.2kg,接受高剂量和中等剂量药物治疗的实验组分别有74%和35%的患者体重下降超过原体重的10%而对照组只有7%的患者达到这一标准。然而在高剂量实验组有20%的患者由于不良事件而退出试验,而在中等剂量组和对照组只有8%的患者退出。与此药剂量相关的恶心、口干、失眠等副作用的报道和越来越多与此药相关的情绪障碍的报道应给予重视,因为这正是大麻素受体拮抗剂类减肥药退出市场的原因。这些副作用在将来Ⅲ期试验中需要仔细监视。
专家评论
胃肠激素对肥胖的治疗
瘦素和胃肠激素是两种主要的负责体重调节的神经内分泌激素,这一发现为肥胖的治疗提供了新方法,在其引起的降低食欲和体重下降后可长期维持能量平衡,同时伴有较少的副作用,本文接下来的部分将对这些治疗策略进行重点阐述。
瘦素
瘦素是由脂肪组织的肥胖基因编码的一种含有167个氨基酸的多肽类循环激素。血浆瘦素水平和机体脂肪组织含量密切相关。通过外周或脑室注射瘦素可使野生型和瘦素基因敲除的小鼠摄食量和体重下降,但在瘦素受体缺陷的小鼠无此作用。
瘦素受体在中枢神经系统内有广泛表达,尤其是下丘脑。现在已了解瘦素通过调节下丘脑神经元活性来调节能量平衡,在机体体重稳态维持中有一种负反馈环路发挥着重要作用,瘦素正是作用于这一反馈环而起作用。在人类有很多早发性肥胖是由于先天性瘦素缺陷所致,这种患者通过瘦素替代治疗有效。然而大多数的肥胖患者体内存在高瘦素血症和瘦素抵抗,因此限制了单独应用瘦素来治疗肥胖的进展。最近有许多研究发现瘦素联合其他减肥药物可使肥胖患者的体重明显下降。对瘦素抵抗分子机制的了解可能会开创抗肥胖治疗的新方法。瘦素受体的信号传导是通过蛋白酪氨酸激酶信号传导与转录活化因子途径(JAK-STAT)实现的。这一信号通路可被酪氨酸蛋白激酶抑制因子(SOCS)阻断。缺乏SOCS3的小鼠不易发生食源性的肥胖并保持对瘦素的敏感性,相信在不远的将来,这些蛋白抑制因子的拮抗剂将会成为有潜力的抗肥胖药物。
多肽YY
多肽YY同胰多肽和神经肽Y一样属于折叠多肽家族,根据其与受体结合的必需基团共同发卡折叠序列命名。折叠多肽类激素通过一系列与G蛋白耦联的Y受体发挥作用,包括Y1、Y2、Y4、Y5、Y6受体。这些受体除中枢神经系统外在外周同样有广泛的分布,且这些多肽激素对每种受体都有一定的交叉作用,因此共同组成一个作用交叉的复杂系统。然而有证据表明这些折叠类多肽激素更倾向与某种受体亚型特异结合,在能量代谢平衡中发挥重要作用。多肽YY由胃肠道的L细胞分泌并与进食量成正比。此激素在循环中的水平于餐后15分钟开始升高并持续2小时。经静脉快速注入多肽YY以模拟其餐后分泌浓度可消耗约一餐35%的热量。重要的一点是在瘦素抵抗的肥胖患者中发现对其他降食欲激素仍然敏感。餐后多肽YY的浓度与体重负相关的预期结果提示其在肥胖发病过程中起作用。另外在许多由胃肠道疾病导致的食欲下降而引起体重下降的患者餐后多肽YY快速反应上升速度减慢。多肽YY基因敲除的小鼠表现出食欲亢进和肥胖倾向,而这种作用可被外源性替代的多肽YY逆转。多肽YY有引起饱感的作用这是通过延迟胃排空和抑制回肠蠕动的机制实现的。然而作为脑肠轴的一种神经递质释放入血液循环的多肽YY在调节食欲的作用方面发挥更为重要的作用。循环中多肽YY主要经由正中隆起作用于下丘脑。试验显示随着外源输入多肽YY,作为神经元活性标志的c-fos水平升高,同时发现POCM mRNA表达增加而神经肽Y mRNA表达降低。急性应激时通过下调弓状核神经肽Y促激素活性引起食欲缺乏的机制与上述十分相似。对于多肽YY下调食欲作用的研究预示其有望在将来成为治疗肥胖的新药。同其他引起食欲降低的胃肠激素一样,对多肽YY的副作用报道最多的仍是与剂量相关的恶心反应。这可能只是这些胃肠激素预期效应的一部分,从饱感到过饱最后变为恶心。曾进行过一项关于多肽YY的Ⅱ期临床试验,试验中于每餐后经鼻给予多肽YY,然而此实验在24周后被迫终止,因为发现其减体重效果并不比现已用于临床的西布曲明好,而且还有明显的恶心反应。然而本实验中多肽YY的最大浓度达到150pmol/L明显高于正常餐后的50 pmol/L。另外,试验中药物于18~26min达到峰浓度,远不如正常餐后生理分泌曲线缓和及持久。因此,这种药物恶心反应的高发生率及经鼻给药控制食欲和降低体重尝试的失败很可能与药物释放模式及药代动力学有关。所以,研制能长期应用且效果稳定的多肽YY剂型值得期待。对Y受体系统和多肽YY在食欲调节中涉及的神经环路复杂机制的深入了解对研发性能更好的抗肥胖药物有重要意义。生理浓度时多肽YY作用并激活下丘脑的突触前膜的Y2受体,若同时给与Y2受体拮抗剂则其外周降食欲作用降低,这同试验发现的Y2受体基因敲除小鼠给予多肽YY后不会出现食欲下降的结果相符。最近人体磁共振机能成像研究指出,多肽YY可能作用于更高级的大脑中枢,如通过食物引起的奖赏机制来选择自己偏爱的食物。处于慢性应激状态的B6.V-Lepob/J肥胖小鼠循环中通常含有较高水平的NPY,有证据表明通过药物抑制其外周Y2受体可控制脂肪组织增生、减轻腹型肥胖、改善代谢异常,因此应对Y受体超家族与折叠多肽类激素间复杂的相互作用引起重视。
胰多肽
胰多肽在胰腺胰岛的PP细胞中合成并于餐后在迷走神经控制下分泌,分泌量与摄入的能量成正比,并可维持6小时。在啮齿类动物试验中观察到持续给予胰多肽可减少动物进食量,增加能量消耗,并使体重下降。过度表达胰多肽的小鼠表现为瘦弱和食欲缺乏,通过外源给予胰多肽抗体可逆转这些表现。健康偏瘦志愿者外源注入胰多肽以模拟正常餐后水平,在随后的24小时能量摄入下降了25%。胰多肽可能通过迷走神经间接发挥作用并且能够直接作用于脑干通过与其亲和力较高的Y4受体发挥食欲调节作用。向切断迷走神经的啮齿类动物腹腔内注入胰多肽后未出现抑制食欲效应。直接将胰多肽注入大鼠的迷走神经背核可刺激迷走神经传出纤维兴奋,说明外周胰多肽也可直接作用于脑干。这一机制可能是通过临近富含Y4受体区域产生的。下丘脑也被证明在胰多肽的食欲调节过程中起作用。在下丘脑弓状核和室旁核发现有Y4受体表达。外周注射胰多肽后会导致下丘脑NPY表达量下降。这可能是下丘脑对外周胰多肽直接反应或是对来自脑干神经信号的间接反应。这些对胰多肽和多肽YY引起饱感效果的初步探索为研发此类抗肥胖药物提供了依据。7TM制药企业(哥本哈根)已研制出两种类似物,TM-30339是一种选择性Y4受体激动剂,以证明其可使食物诱导的肥胖小鼠体重明显下降,现在正在对其进行Ⅱ期临床试验以评估此药的安全性、人体耐受性及降体重的最佳剂量。TM-30338命名为Obinepitide是Y2和Y4双重受体激动剂,在Ⅰ期和Ⅱ期临床试验中证明其对人体有良好的安全性和耐受性,给予肥胖志愿者皮下注射此种复合制剂一天一次可明显降低食物摄入量并能维持9小时,现正准备对其进行下一步的临床试验。
胰淀素
胰淀素(Amylin,胰岛淀粉样多肽)是由37个氨基酸构成的多肽,由胰岛β细胞合成并与胰岛素按1:100比例释放。与其他胃肠激素相似,在摄入营养素的刺激下胰淀素迅速释放,60分钟达峰并可持续4小时。胰淀素能有效抑制胰高血糖素的释放并可减慢胃排空。尚未鉴定出胰淀素特异性受体,其可以通过降钙素受体而产生作用,由于不同组织降钙素活性修饰蛋白的表达不同,因此各组织对其敏感程度有组织特异性。长期应用胰淀素的患者可引起食欲降低,有证据表明其可直接作用于脑干。将胰淀素直接注入大鼠垂体前叶可引起明显厌食效应,然而外周给予此物质引起的降低食欲效应在孤束核受损大鼠体内不复存在,这种现象也可通过向垂体前叶注入胰淀素拮抗剂AC187而出现。内源性胰淀素有形成淀粉蛋白样纤维的趋势并沉积在组织中,长此以往可造成组织的损伤。已研制出一种性质稳定、无淀粉样病变副作用、可皮下注射的胰淀素类药物,被命名为普兰林肽,在美国已获得批准用于治疗1型和2型糖尿病。由于应用普兰林肽治疗糖尿病的过程中发现其有降体重的作用,因此研究人员将其作为减肥药用于非糖尿病的肥胖患者并对此进行了研究。二代胰淀素类似物davalintide正在进行Ⅱ期临床试验以确定其在健康超重和肥胖志愿者中应用时的安全性、可耐受性及降体重效果等。在啮齿类动物试验中发现胰淀素可增加肥胖动物体内瘦素的敏感性,在此基础上研制出了普兰林肽和重组人瘦素美曲普汀(metreleptin)的复合制剂,在对其进行的Ⅱ期临床试验中将受试对象分为应用安慰剂的对照组、单独应用普兰林肽组、单用美曲普汀组和合用普兰林肽与美曲普汀组,试验前4周为诱导期,对所有受试177名肥胖患者均注射高剂量或低剂量普兰林肽并进行饮食限制,为期24周的试验发现合用普兰林肽和美曲普汀组个体的体重在基线基础上平均下降11.5kg,明显高于单用美曲普汀组的7.4kg和单用普兰林肽组的7.9kg,试验中因恶心反应有4例受试者在试验诱导期退出试验,1例合用两种药物受试者中途退出,关于这种联合治疗更广范围的临床试验值得期待。
胰高血糖素样肽-1
胰高血糖素样肽-1由肠道L细胞合成并随多肽YY和胃泌酸调节素一同释放,其血浓度可于餐后迅速升高并可维持几个小时。同胃泌酸调节素和糖依赖性胰岛素释放肽一样,胰高血糖素样肽-1也是一种肠降血糖素,可于餐后刺激胰岛素分泌。除了通过胰腺发挥调节血糖的作用外,其活性形式GLP7-36amide还有降低摄食量的作用。在小鼠长期给予此种药物可引起明显的体重下降,如同时给予特异性GLP-1受体拮抗剂exendin9-39可抑制此作用,然而试验发现GLP-1受体敲除小鼠的摄食量和体重并无明显变化(即使这些小鼠已表现为糖耐量异常)。同许多神经肽及其受体基因敲除的动物种系表现出肥胖一样,这可能是由于机体代偿发育的结果。向野生型大鼠脑室直接注入GLP-1可明显抑制摄食量,但这种作用可被同时给予的exendin9-39所抑制,另外向大鼠脑室内单独注入exendin9-39可使已饱食的大鼠再次进食,这说明生理量的内源性GLP-1有调节食欲的作用。体重正常的人对GLP-1降低食欲的作用与剂量相关,并能明显降低摄食量,约可降低正常量的12%。这种食欲抑制作用被用于人类肥胖和糖尿病患者的研究中。循环中GLP-1发挥其食欲调节作用可能是通过迷走神经的传入纤维或直接作用于脑干和下丘脑的效应部位,不论GLP-1作用于中枢神经系统还是外周系统均可强烈诱导室旁核c-fos表达。研究发现在下丘脑的弓状核、室旁核和视上核均有GLP-1受体mRNA表达,进一步研究发现迷走神经切断或下丘脑和脑干离断后的动物外周给予GLP-1后降食欲的效果减弱。拥有短的血浆半衰期是所有胃肠激素共有的特点,如GLP-1的半衰期为2 min,在二肽基肽酶作用下氨基末端断裂而失活。Exendin1-39amide是一种从希拉巨蜥唾液中提纯的蛋白质,由Amylin制药企业联合礼来公司共同研制而成,其常用的商品名为Byetta,是一种长效GLP-1受体激动剂,已被批准为2型糖尿病口服药治疗的一种辅助用药。荟萃分析显示艾塞那肽(exenatide)除了降血糖作用外还可使体重下降,研究显示药物治疗组比安慰剂组体重平均多下降2.13kg而比胰岛素治疗组多下降4.67kg。礼来公司进行了一项关于非糖尿病肥胖人群为期24周的双盲随机对照试验,试验中给予高剂量的exenadide并联合了饮食控制和体育锻炼作为干预因素。给予exenatide组个体体重平均下降5.06kg,而给予安慰剂的对照组个体只下降1.61kg,给予exenatide个体中有9.6%体重下降超过了原体重的10%。与其他多肽激素用法不同,Byetta需一天两次皮下注射,这降低了很多人对其的应用兴趣。Amylin和礼来制药公司正在联合研制一种可一周注射一次的新型制剂exenatide LAR,这种制剂已被证明长期应用比一天应用两次的常规制剂可更好的控制血糖并能发挥相同的降体重作用。在2009年伊始,Alta治疗公司授予Amylin和Eli Lilly制药公司特权,允许其在世界范围内应用Alta特有透皮递药系统研制经皮吸收的exenatide制剂。一种可一天皮下注射一次的exenatide制剂正在2型糖尿病人群中进行Ⅰ期临床试验。应用exenatide制剂最常见的副作用是恶心,在对照研究中应用exenatide制剂组恶心发生率为33%~57%而应用胰岛素类似物的对照组只有0.4%~9%,但总的来说这种副作用可用早期滴定法减轻并继续应用,有证据表明此药在这种不良反应缓解后仍能发挥良好的控制血糖和降体重作用。在2007年10月FDA曾发出警告,称exenatide类制剂可诱发急性胰腺炎。这一警告基于一项售后调查结果,此结果显示有30例应用Byetta的患者发生了急性胰腺炎。这些病例中有22例停用药物后症状好转,6例在剂量加倍时发生,3例是再次应用时发生。需要说明的是肥胖或2型糖尿病患者本身就有发生胆囊结石和高甘油三酯血症的倾向,然而这两种疾病均与急性胰腺炎发病相关。事实上Byetta的生产厂家已根据回顾性调查数据分析结果否认了此药可增加胰腺炎发生率的说法。
最近推出了第二种GLP-1类似物:利拉鲁肽liraglutide(Victoza;Novo Nordisk),它与人类蛋白有97%的同源性,其16碳脂肪酸的侧链可增加与白蛋白的结合力故而延长了半衰期,这一机制与地特胰岛素相似。其与人体蛋白的高度同源性降低了免疫源性(大约有40%的患者在服用exenatide后会产生此类药物的抗体,但实际上很少发生明显的临床反应)。Victoza在欧洲已用于2型糖尿病的治疗,结果显示其降糖效果优于exenatide而且与exenatide有相似的减肥效果。NovoNordisk在继22周的比较利拉鲁肽和奥利司他效果的双盲、对照Ⅱ期临床试验后又对利拉鲁肽在非糖尿病肥胖人群中进行了为期32周的开放性试验并公布了结果,52周的实验显示,给予大剂量利拉鲁肽组比安慰剂组体重平均多下降5.5~6.0kg,接受大剂量利拉鲁肽治疗组有75%体重下降超过原体重的5%,有35%下降超过原体重的10%,有10%的患者因不良反应退出试验,主要是因为恶心反应,其发生率与exenatide相似,而胰腺炎的发生率在实验组和对照组无明显差异。然而在动物试验中发现应用利拉鲁肽会导致甲状腺髓样肿瘤发生率轻微升高并与剂量相关,这应引起注意。
其他长效GLP-1类似物有Zealand制药企业的lixisenatide(此药当前已进行Ⅲ期临床试验);ConjuChem生物制药公司的CJC-1134-PC,它是一种exendin-4与人白蛋白的结合产物;GSK公司的albiglutide以及罗氏的taspoglutide。在独立研发过程中Emisphere公司推出了多肽YY及以辛酸钠为载体的GLP-1口服制剂,早期研究揭示用这种方法经口给予肽类激素后可在消化道迅速吸收并可达到正常餐后几倍的血液浓度。单独应用GLP-1口服制剂(2mg的片剂)或联合应用多肽YY口服制剂(1mg片剂)均可明显抑制热量的摄入。
胃泌酸调节素
胃泌酸调节素(OXM)是由前胰高血糖素原裂解生成的含有37个氨基酸的多肽,由肠道L细胞分泌,循环中水平与摄入的热量成正比,其水平于餐后30min达高峰并能维持几小时。OXM对胃肠道的作用有抑制胃肠消化液分泌、延缓胃排空及抑制胰腺外分泌。长期应用此类药物的啮齿类动物表现为食欲下降并可使体重下降。给偏瘦的人静脉输入此种药物后可降低食欲但不会引起恶心反应也不会导致厌食,可使热量摄入降低19%。健康超重或肥胖志愿者应用超过4周可使体重平均下降2.3kg,而应用安慰剂的对照组只下降0.5kg。其部分降体重的作用是通过增加能量消耗实现。对肥胖志愿者进行一天三次皮下注射OXM,连续应用4天,可发现非活动相关的能量消耗增加了26%。成对饲养大鼠试验支持这一结果,试验中给予皮下注射QXM处理的大鼠体重较同等条件下喂养的皮下注射生理盐水的大鼠有明显的下降。目前尚未发现OXM的特异性受体,现认为其生物学作用是通过GLP-1受体介导的,其与GLP-1受体的亲和力只有GLP的五十分之一。GLP-1受体基因敲除的小鼠给予OXM后并无食欲下降表现。现认为OXM虽然与GLP-1在降低摄食量方面有相同功效但其刺激胰岛素释放的作用不如GLP-1。这提示OXM很可能还作用于其他受体或是作用于存在于中枢系统的迄今尚未被鉴定的OXM特异性受体。为证实这一点,人们对给予OXM的小鼠大脑进行了增强核素扫描,发现弓状核、室旁核及视上核部位的神经元被激活,而GLP-1通常作用于室旁核及下丘脑腹内侧核群。伦敦帝国理工学院下属的Thiakis Ltd生物工程公司研制的长效OXM类似物复合制剂TKS1225将用于肥胖的治疗,最近这一成果被Wyeth制药企业收购,目前正在进行I期临床试验。
胆囊收缩素
胆囊收缩素(CCK)是第一个被发现有食欲调节作用的胃肠激素,主要是促进摄食终止而不会长期影响食欲,其主要是通过作用于迷走神经起作用。在肥胖和非肥胖人群中短期给予CCK均可减少摄食量,但当重复给药时有导致快速耐受性的倾向即激素的食欲抑制作用减弱。在大鼠连续腹膜腔注射给药24小时后产生耐受。对大鼠的短期研究发现,短期给予CCK可使进食时间缩短但这一作用可被后期发生的进食频率增加所代偿。GSK制药企业经过对CCK-1类似物(GI 181771X)的Ⅱ期临床试验后放弃了此项研究计划,因为试验中发现CCK并未引起明显的体重下降,这很可能是由于在长期用药过程中机体对CCK产生耐药性所致。最近研究发现,CCK与瘦素联合应用有协同降体重作用,这一机制的发现将为研制新型CCK类减肥药重开希望之门。
胃促生长素
胃促生长素是在探寻内源性促生长激素受体配体时发现的,在中枢神经系统、胃肠道、肝脏、胰腺、肾脏及脂肪组织均有广泛表达。胃促生长素是由28个氨基酸组成的多肽,主要由胃泌酸腺的X/A样细胞分泌。翻译出的胃促生长素蛋白在其酰基转移酶作用下第三个丝氨酸残基酰基化后才能与受体结合。胃促生长素是已知的唯一可刺激食欲的胃肠激素,当机体饥饿时胃促生长素从胃部释放,循环中的水平在进食前已升高,可促进进食,随着热量摄入的增加其水平逐渐下降,在进食规律的情况下形成规律的分泌曲线,通常血浆胃促生长素水平与体重成负相关。然而有报道称,在肥胖人群中餐后胃促生长素下降并不明显,相反通过饮食限制引起的体重下降会导致水平升高,因此想要通过节食来进一步降低体重只存在理论上的可能,这也在一定程度上解释了为什么肥胖者的持续节食疗法往往不能成功。对大鼠进行试验时不论外周给药还是将胃促生长素直接应用于中枢神经系统均会在短期内引起摄食量明显增加,长期应用则会使体重增加。在健康偏瘦人群静脉给予胃促生长素后食物摄入量增加了28%。胃促生长素可使弓状核部位的神经肽Y和调节蛋白(Ag RP)表达量增加,切除弓状核后再给予胃促生长素,其促进食欲的作用不复存在。然而,试验中还发现外周注入胃促生长素后脑干中c-fos的表达量增加,还有证据表明迷走神经也发挥一定作用,因为切断迷走神经后胃促生长素的食欲促进作用将会减弱。有趣的是功能性核磁共振对人体的研究显示,胃促生长素可能对包括奖赏系统在内的高级大脑中枢的神经元活性有调节作用,如眶额部的皮质,这种作用是否是由下丘脑的上行投射系统介导目前尚不清楚。在抗肥胖药物治疗领域已研制出GHS-R1a(一种胃促生长素受体)拮抗剂类药物,短期应用可使偏瘦小鼠、饮食诱导的肥胖小鼠及ob/ob型小鼠摄食量明显减少,长期应用可使ob/ob型小鼠体重下降。有几家制药公司进行了开发胃促生长素类似物的计划但均未得出预期的结果。如Ipsen研究组研制的GHS-R1a拮抗剂BIM-28163在现实活体内应用时表现为促进食欲和体重增加。在此基础上还有一些其他形式的尝试。NOXXON制药研制的spiegelmers是一种稳定的左旋异构体,可与活化的胃促生长素不可逆性结合并使其灭活,NOX-B11可降低大鼠的摄食量,同系列的NOX-B11-2长期应用可使饮食诱导的肥胖小鼠体重下降。辉瑞制药集团已获得研制NOX-B11的许可。Cyto生物技术工程利用胃促生长素的免疫共轭体诱导的免疫反应研制出 “疫苗”,但不幸的是在其Ⅰ、Ⅱ期临床试验中并未得出像动物实验中导致体重下降那样的预期结果。将来可能会将抑制酰基转移酶活性作为可行的治疗靶点,因为胃促生长素是已知唯一需要酰基化激活后才能与受体结合的肽类激素。
五年目标
本阶段的目标仍应致力于肥胖持续上升的发病率与其相关疾病的研究,最重要的是针对个人及进行社会范围的生活方式干预,然而研发具有更高耐受性和更好效果的药物无疑也是很重要的。机体控制能量代谢和欲求行为的系统很复杂,在研制能够作用于这一系统相关受体和神经递质而影响其功能的药物时得到重要启示,这些药物通常会同时影响几种机体的高级功能而出现不可避免的副作用,如情绪障碍。对能量代谢平衡生理机制和肥胖病理机制的深入了解将会为研发选择性更高、目标性更强的相关药物不断提供理论依据。能量代谢平衡是机体一种非常重要的生理稳态,因此在这一系统中有很多相关的代偿机制,这些机制对维持正常体重起重要作用,生理情况下其对抗体重下降的作用要强于对体重增加的控制。随着更多相关药物的出现,联合用药或改变给药途径可能对上述问题的解决有所帮助。对遗传学在肥胖发病中作用的深入研究将有助于这一领域的进一步发展,比如受体多态性及由此引出的个体化用药等。作为天然的食欲调节活性因子,胃肠激素可能会成为抗肥胖药物研究领域的焦点。有可能利用胃肠激素的联合用药实现药物性“胃肠分流”,并获得胃分流术那样的效果,体重明显下降并最终使健康受益,这还可以避免手术相关的风险。在这一领域里尚需进一步探索的有,研制长效多肽类激素类似物以克服内源性多肽激素半衰期短的缺点,以及研发新型制剂如缓释注射剂型、抗酶口服剂型、吸入剂型及透皮贴剂等。

