从时间生物学角度看肥胖
加劳莱特 等
背景介绍:什么是时间生物学?
从生理角度界定时间的概念是比较困难的,至今也没有明确的定义。自古以来,人类都是通过钟表和日历知道和预知时间。而生物体自身(当然包括人类)也可以衡量时间,其中最受关注的是生物节律(生物体组织的不同层次都会有生物节律),以定期和可预测的方式进行。早在1729年,法国天文学家Jean Jacques d'Ortous De Marian发表了第一篇有关生物节律的详细研究(含羞草的滤泡运动),结果得出,叶子的张开闭合行为在持续几天的黑暗条件下依然存在。在20世纪中叶的首批对此领域的研究中,昆虫生态学家Colin S Pittendrigh进行了一项对果蝇的研究,发现果蝇以环境时间为基本原则活动。这个基本原则就是昼夜节律,并由基因决定。
人类的昼夜节律
虽然有大量与此有关的记录,包括睡眠和觉醒的时间、摄食和饮水等行为、体温调节和内分泌、肾和生殖功能等都有昼夜节律。然而,人类的内源性昼夜节律似乎被忽略了,直到1866年William Ogle对人类体温进行仔细观察后才提出。正如他自己说的:“早上体温上升,无论我们是否在睡梦中;晚上体温下降,无论我们是否清醒。”后来有确凿的证据证明,人类的体温节律是内源性的。如今,体温作为生理变量之一,更广泛地用于人类时间生物学研究中。
许多激素表达具有昼夜节律。如,皮质醇、生长激素、醛固酮、泌乳素、睾酮、促甲状腺激素、促黄体激素(LH)和卵泡刺激素。脂肪组织(目前认为它是一个内分泌器官)也具有昼夜节律。从这个意义上说,激素和细胞因子(如,瘦素、降脂素、抵抗素、脂联素和内脂素),与脂肪组织的昼夜节律密切相关。脂联素已被提出作为对抗代谢综合征的 “守护天使”,它的循环水平同样表现出波动性(慢速释放)和昼夜变化。对这些物质昼夜节律性的认识,是了解人类生理病理的关键要素,特别是肥胖。
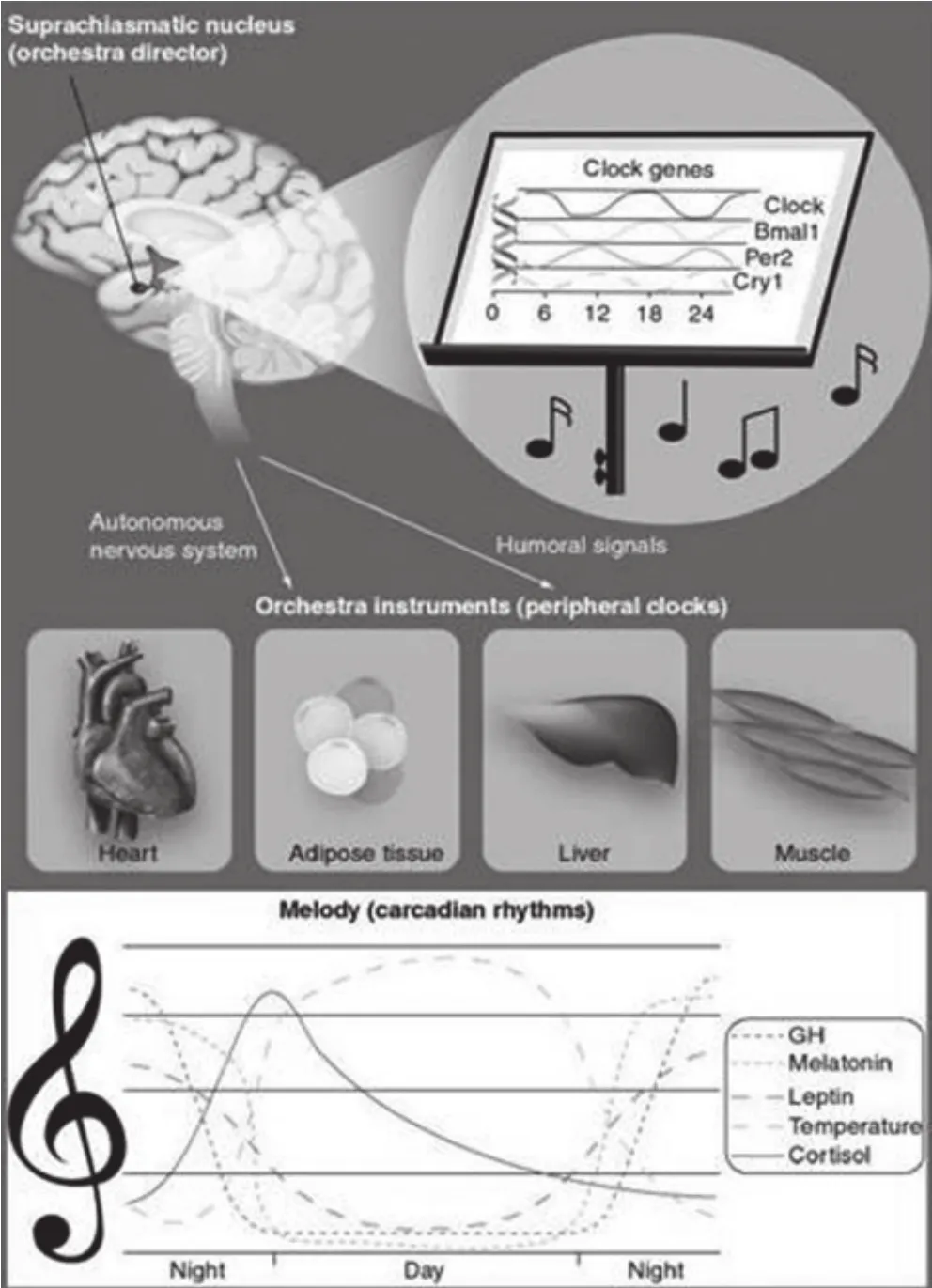
图1 昼夜节律乐团的组织结构
昼夜节律指挥官——视交叉上核
基于微阵列研究数据,普遍认为每天组织的所有基因表型有10%~25%发生显著变化。这意味着大多数行为、生理和生化的变量有昼夜节律。因此,在不同变量之间维持一个适当的内部时间秩序对健康至关重要。每一个变量在高峰或低谷时,昼夜节律系统必须精心调校,以保持健康状态时的节律(图1)。
昼夜节律乐团的指挥器官是存在于下丘脑上的视交叉上核(SCN)。它是昼夜节律系统的“起搏器(pacemaker)”(也叫生物钟,激发生物节律并使之稳定维持的内部定时机制),它的每一个神经元有一个反馈环组成的分子齿轮,包括正反馈(Clock 和 Bmal1)和负反馈(Per和Cry)。那么,这个系统是怎么工作的呢?首先,含黑视素的神经节细胞把感受到的光刺激信号直接投射到视交叉上核,使昼夜节律的起搏器与外界环境的光照同步;其次,视交叉上核通过周期性的激素分泌和外周神经系统的活动,使整个昼夜节律乐团的各个不同组织器官节律同步。清楚这一点,我们就不难理解,健康状态时的昼夜节律和不健康状态时(节律被扰乱)的区别,仅取决于外周组织器官反馈(波峰)或不反馈(波谷)乐团指挥器官的精确命令。
如前所述,SCN的昼夜节律由基因转录—翻译调节组成的两个反馈环路形成,包括正反馈和负反馈。正反馈核心元件包括Clock(circadian locomotor output cycles kaput,是细胞内进行生物节律调节的核心调控因子)和BMAL1(brain and muscle ARNT-like-1,是哺乳动物生物钟转录、翻译反馈环路中的核心成分),两者表达后相互作用形成异质二聚体,诱导分子齿轮的负反馈成分表达,如Pers(Pers1,2和3)、Crys(Cry1和2)和REV-ERB-α的表达。这些元件形成二聚体(PER-CRY)后经过核移位,对Clock和BMAL1表达形成负反馈抑制。因此,上述这些对SCN的正和负反馈元件的转录、翻译和反馈调控形成了周期振荡,周期大约接近24小时。
生物钟(或叫起搏器)的一些元件,如REVERB-α、BMAL1和Clock基因,能诱导额外的基因表达,称为生物钟调节基因(CCG,指受生物钟调节的一类基因),它不直接参与调控生物钟,但可诱导多种靶基因的表达。
1972年有2个研究团队都发现了生物钟结构。每个SCN的神经元可以看作一个小型生物钟。对这些神经元体外分离,发现它们好几天都能保持近24 小时的、以一定频率放电的节律运动。前面提到,SCN的昼夜节律(近24小时)与外环境的光刺激的相位和周期同步。其中,昼夜节律主要同步于白昼—黑夜周期。最近,对血细胞也做了类似的研究,在黑夜给予血细胞强光刺激(已知这个方法能有效调整中枢生物钟),结果证明血细胞的生物钟也受外界光线的影响。另外,其他的外部因素(如定期活动、社会接触)也对生物钟有同步影响。
生理状态时,不同的组织器官都有不同的昼夜节律,并受视交叉上核驱动。举例来说,SCN夜间活化了合成褪黑素的关键酶AANAT(arylalkylamine N-acetyltransferase),使褪黑素水平在夜间达到高峰。也有相反的情况,SCN夜间抑制了促肾上腺皮质激素(ACTH)释放,使皮质醇水平在早晨达到高峰;体温在白天比夜间略高(下午达到高峰)。成千上万的生物体内都有这样的“交响乐团”。
外周组织的昼夜节律各不一样
心脏、脂肪组织、肾上腺、肺和血管平滑肌都有各自的振荡器(图1)。虽然在某些情况下,它们可以独自振荡,但通常情况下,从整个乐团节奏一致的潜在需要而言,它们必须保持对指挥器官的“忠诚”。
在我们体内,SCN通过神经、交感神经和副交感神经,选择性地激活神经递质(如褪黑素、prokineticine 2,TGF-α和nocturnin),把需要传达的信息给各个组织脏器。
不难理解,健康状态时内部的定时机制(正常昼夜节律)和不健康状态时的节律(昼夜节律被扰乱)是不相同的,造成这种差异的原因在于对指挥器官精准命令的反馈(是否听从命令),包括积极的(波峰)和消极的(波谷)两种状态。
被扰乱的昼夜节律
我们体内的昼夜节律被扰乱的状态,叫做CD(chronodisruption),这是一个术语,提示昼夜节律不同步时,可能对健康有不良影响。这种扰乱的状态可能持续几天、几个月甚至几年。有人定义CD为内部的与生理和生化相关行为的定时机制受到干扰。从外界环境看,CD表示内部的昼夜节律和24 小时的外界环境周期的正常相位关系破裂。对此,CD可用节律振幅减少的幅度进行评估,大概有这3种情况,节律全部消失,节律延迟或节律超前,其中当然包括相逆的昼夜节律(如,夜间工作者)。从自身内部环境看,CD表示内部的各个层次的昼夜节律不同步。我们研究现代社会中普遍存在的时差、夜班、夜间光污染、睡眠不足或夜间进食现象,都会引起CD,并与不同疾病的相关因素高度相关,包括肥胖。
与昼夜节律不同步的行为可导致肥胖
夜班
流行病学研究已经表明这一点。另外,一项由Di Milia等作的横断面研究(n = 346),旨在调查肥胖与夜班的关系。结果表明,夜班工作者与白班工作者相比,平均BMI显著增加。另一项重要的横断面研究,涉及27,485例工人(来源于the Västerbotten intervention program),对受试者进行了采血和健康问卷调查,结果显示,相对于白班工作者,夜班工作者与肥胖、高甘油三酯和低HDL-C的关系更紧密,这提示夜班工作可能和代谢综合征相关。
夜间进食
有研究结果表示,相对于夜间不进食者,夜间进食者超重或肥胖增加4.4倍。
睡眠不足
临床研究报告表明,睡眠时间≤5小时的女性相比睡眠时间达到7小时的女性,体重增加大约3.0kg。最近的一项由Van Cauter等人进行的研究,对健康人睡眠时间限制在4小时,连续6夜,结果显示,这些受试者的糖耐量受损,随之出现胰岛素抵抗。这种后果在儿童中更严重,有研究表明,睡眠时间不足是儿童肥胖的一个独立的危险因素。睡眠不足和肥胖有关,涉及多种因素。一项针对成人的研究结果显示,睡眠不足和瘦素和/或胃促生长素(ghrelin)的浓度变化相关(这种变化导致增加食欲,摄入更多碳水化合物类零食)。此外,基于增加能量摄入能消除疲劳的惯性理论,不难理解,睡眠不足(疲劳)会导致体重增加和肥胖(通过增加能量摄入)。在儿童,体温调节的变化也涉及肥胖的形成,随着年龄的增加,睡眠不足和肥胖的相关性会越来越弱,可能是由于儿童对睡眠的要求比较高。
扰乱昼夜节律的可能因素
被扰乱的昼夜节律是整个乐团在不同层次发生变化的结果。扰乱可以在信息输入的时候(如光暗周期或进食时间),可以在信息输出的时候,也可以在中央起搏器(褪黑素和糖皮质激素分泌相关)。
信息输入时
已证明,光照不足(无论是否由不恰当的时间、次优的频谱或强度不足所致)可能会导致与CD相关的疾病因素。
进食时间
进食时间也被认为是最重要的外部同步器或授时振荡器之一。不规律的进食时间有助于CD相关疾病因素的产生。例如,夜间生活方式(醒得晚、不用早餐、晚餐很晚),导致夜间瘦素和褪黑素分泌减少,引发高血糖。因此,夜间生活方式可能是夜间进食综合征、肥胖和糖尿病的危险因素之一,威胁着现代人的健康。
起搏器
关于起搏器对CD的“贡献”,最初认为是生物的各个组织器官的昼夜节律不同步,并且是时差和夜班工作引起CD的原因所在。事实上,内部不同步的过渡状态是SCN和外界环境的振荡器(光-暗周期)耦合强度不同的结果,或受外界同步器不同的影响(摄食时间或光照)。
被扰乱的昼夜节律也可能是核心生物钟的分子齿轮(如,分子BMAL1、Per2、Clock)相关的变化,都可影响机体的生理以及昼夜节律。2005年首次证明,生物钟基因缺陷与肥胖显著相关。由Turek等人进行的研究发现,Clock基因突变的小鼠,摄食的昼夜节律性大大减弱,表现为贪食、肥胖,并导致了代谢综合征(高脂血症、脂肪肝、高血糖及低胰岛素血症)。另一项由Ando等人进行的实验模型研究发现,肥胖与CD相关。事实上,脂肪组织中的Clock基因和脂肪细胞因子的表达节律性减弱,增加了小鼠的肥胖程度。但是,对于这些问题存在重大争议。Kennaway的研究结果显示,扰乱肝脏和骨骼肌的Clock基因表达,没有引起肥胖;在Clock突变小鼠,血清甘油三酯和游离脂肪酸显著降低。
信息输出时
昼夜节律系统信息输出时被扰乱也会引起CD,主要包括上述提到的褪黑素(其它的如TGF-α和prokineticine2)。众所周知,褪黑素具有抗氧化抗炎作用,同时也可能是一个合成的调节器(补充褪黑素可调整生物钟),直接清除自由基。作为保护性激素,它也与肥胖有关(分泌不足会导致肥胖)。事实上,它还能恢复胰岛素敏感性,降低血压和改善血糖。
脂肪组织的昼夜节律
中枢性昼夜节律已被证明与脂肪合成途径相关。首先,脂肪组织的关键代谢酶和脂质代谢相关的转录因子相互作用,影响中枢性昼夜节律;其次,中枢性昼夜节律受激素、摄取的营养成分和是否定时用餐的影响。从这个意义上说,昼夜节律系统和肥胖的关系,最重要的问题之一,是要确定,是否脂肪组织延迟了昼夜节律,是否脂肪组织有自己的生物钟?有研究分析了小鼠的脂肪组织,显示了强劲的24小时Clock基因的表达。脂肪组织的Clock基因的相对相位与SCN的Clock基因的表达是一致的。此外,微阵列研究表明,高达20%的小鼠或人类的脂肪转录是根据昼夜节律表达的。许多不同的研究(无论是实验模型还是人类血清)已经表明,脂肪组织中的脂肪细胞分泌蛋白具有昼夜节律性。
最近进行了一项对人类白色脂肪组织的Clock基因表达的体外研究,从肥胖者体内取出内脏及皮下脂肪组织,并保存在组织培养液中过夜,然后每6小时操作一次,持续24小时。结果显示,在脂肪组织中的Clock基因,振荡准确并独立于视交叉上核(图2);其内在的振荡节律性似乎与其他基因协同,如HPPAR和糖皮质激素相关基因。内脏和皮下的脂肪组织的昼夜节律模式是不同的。
脂肪细胞因子的昼夜节律与肥胖相关。实验模型已证明,脂联素、抵抗素、内脂素和瘦素的昼夜节律性由于肥胖会减弱。最近,我们的小组研究的脂联素mRNA的表达谱及其受体(ADIPOR1和ADIPOR2)清楚地表明,病态肥胖患者的皮下和内脏脂肪组织有24 小时昼夜节律;并且,肥胖与CD相关。对相关基因的昼夜节律和代谢综合征成分的分析显示,肥胖(包括腹部肥胖)与脂联素和脂联素受体的振幅减少相关。另外,CD和肥胖的相关性可能牵扯到脂蛋白脂酶(LPL)的昼夜节律。这种酶与脂肪酸在脂肪细胞中的积累相关。正常情况下,LPL显示昼夜节律性,并在用餐时达到最大分泌量,这有利于脂肪在脂肪组织中积累。但是,如果没有按时进餐,LPL水平会随之改变(节律被扰乱),游离脂肪酸可能会被储存在异位组织,产生脂毒性,导致肝脏、肌肉或胰腺合并症和代谢综合征。简而言之,以上的这些数据表明,24小时的昼夜节律对脂肪组织的功能是重要的,脂肪组织的昼夜节律与代谢状态相关。
营养遗传学与时间生物学
最新的时间生物学研究涉及到人类的营养遗传学。基因与环境相互作用的概念得到新的证据支持,主要来自涉及饮食、肥胖和相关危险因素的研究。普遍认为,与脂质代谢、炎症和肥胖相关的候选基因的变异性,与代谢综合征经典的和新的生物标志物的血浆水平的改变相关。
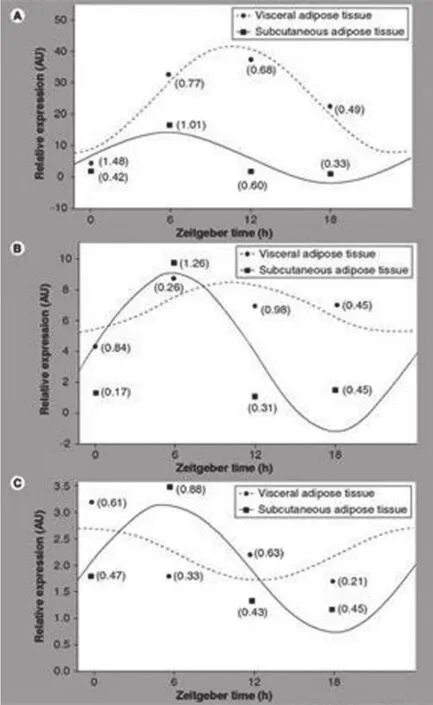
图2 Clock基因在人体皮下和内脏脂肪组织中的节律性表达(A)hPer2(B) hBmal1和(C)hCry1
2008年,Scott等第一次提出Clock基因变异的多态性与肥胖(特别是腹部肥胖)相关;并认为,Clock基因的遗传变异性可能在代谢综合征、2型糖尿病和心血管疾病的发生发展中发挥作用。
我们的团队在北美群体和来自西班牙东南部的地中海群体,重复了GOLDN(Genetics of Lipid Lowering Drugs and Diet Network)研究。发现这两个群体的Clock基因具有单核苷酸多态性(SNPs),其中五分之四与肥胖(包括腹部肥胖)和能量摄入增加有关。此外,对于SNP rs4580704位点基因型,少量携带者和没有携带者相比,糖尿病风险减少了31%,高血压风险减少了46%。
地中海群体中,Clock基因rs1801260位点变异与基线水平肥胖相关,并且,此变异基因不利于体重的下降。并且,携带该变异基因的等位基因(G)的患者表现出较强的减重抵抗,少量携带者和没有携带者相比,失眠(≤6小时/天)的频率大大提高(59%Vs.41%)。令人感兴趣的是Clock基因变异和脂肪酸组成之间的关系。我们可以确定,基因-饮食相互作用,影响Clock基因表达的多态性,并牵扯到代谢综合征。通过对分单不饱和脂肪酸(MUFAs)摄入,我们发现,rs4580704位点的基因型,对血糖和胰岛素抵抗影响不同,并且,仅在大量摄入单不饱和脂肪酸时,次要等位基因对胰岛素敏感性才有保护作用。我们还发现,Clock 3111T/C的基因型对饱和脂肪酸的摄入量影响不同,并且,仅在大量摄入饱和脂肪酸时,该基因的变异多态性对腰围产生有害影响。以上这些结果表明,昼夜节律和代谢综合征的关系,牵扯到饮食来源和MUFAs摄入量。
结论
人类的昼夜节律系统就像一个生理交响乐团,由指挥器官统领着外周不同的组织,以保证两者节律能够同步。健康状态时的内部节律和不健康状态时的节律是不相同的,造成这种差异的原因在于外周组织对指挥器官的精准命令的反馈(是否听从命令),包括积极的(波峰)和消极的(波谷)两种状态。肥胖可能是昼夜节律被扰乱的结果。来源于流行病学、生理和遗传学的许多因素都可能扰乱节律。
未来展望
肥胖和时间生物学相关性的研究才刚刚开始,尽管有些研究人员和医生对此高度质疑。目前,人们已经普遍接受了分子钟是代谢异常和肥胖发生中一个有趣而重要的机制,发表的论文数量迅速增加正说明了这一点。
事实上,研究证据与日俱增。从2005年的Clock基因敲除实验模型研究数据到流行病学证据,以及最近的营养遗传学研究数据,可以说取得了一个很大的进步。我们的看法是,如果一切都指向同一个方向,时间生物学将不仅能帮助我们深入理解肥胖和代谢综合征的相关性,更重要的是它可能成为治疗肥胖的重要新工具,包括不同的时间生物学问卷、对基因型的分析、以及对各种生理性昼夜节律的测量。那时,我们在考虑肥胖危险因素的同时,还要考虑这些因素产生的时间。

