泥螺等7种海洋生物的体外抗菌活性研究
马剑茵,石亚素,童国忠,陶 莉
(1.浙江海洋学院食品与药学学院、医学院,浙江舟山 316004;2.浙江省舟山市定海区疾病控制中心,浙江舟山 316000)
随着抗生素的长期使用,病原菌的耐药性明显增强,新的致病菌和病毒不断出现。因此,有必要从天然产物中寻找新的抗菌药物资源。海洋生物是一种十分巨大的有待深入开发的生物资源。目前,已从海洋生物中提取分离得到许多新的生物活性物质,其中有些表现出较强的抗菌活性。然而,被筛选的活性物质与丰富的海洋资源相比还是微乎其微。
海洋生物的抗菌活性与其生活环境、生长阶段、提取方法等多种因素有关,因此不同条件下的研究结果也就有所差异,有关海洋藻类和贝类生物的提取物对革兰阳性菌和革兰阴性菌的抑制作用至今未有统一的结果。
RAO等[1]的研究结果表明,海藻提取物对革兰阳性菌和革兰阴性菌的抑制作用没有明显的差别。CACCAMESE等[2]则报道海藻提取物对革兰阳性菌的抑制率高于革兰阴性菌。MITTA等[3]从2种贻贝(Mytilus edulis、Mytilus galloprovincialis)中分离到多种抗菌肽,根据其一级结构和二硫键形成的不同形式可分为4类:防御素、贻贝素、贻贝肽和贻贝霉素,研究发现均有较强的抗菌活性。范秋领等[4]从隔贻贝、泥螺等醇提物中也发现有明显抑制金黄色葡萄球菌的活性成分。
本研究对从舟山海域采集到的泥螺等常见海洋生物进行体外抗菌活性实验,以期获得具有一定抗菌活性的物质。
1 材料与方法
1.1 材料
1.1.1 标准菌株
金黄色葡萄球菌 Staphylococcus aureus,ATCC-26003;大肠埃希氏菌 Escherichia coli,ATCC-44102;宋内氏志贺菌Shigella sonnei,ATCC-51334;鼠伤寒沙门氏菌Salmonella tyhimurium,ATCC-50115;副溶血性弧菌Vibrio parahemolyticus。其中金黄色葡萄球菌、大肠埃希氏菌、志贺氏痢疾杆菌、鼠伤寒沙门氏菌由中国药品生物制品检定所提供,副溶血性弧菌由浙江省质控中心提供。
1.1.2 海洋生物
泥螺、毛蚶、青蛤、厚壳贻贝、海带、红毛菜、条斑紫菜,均采集于浙江舟山群岛海域,由浙江海洋学院食品与药学学院王斌博士鉴定。
1.1.3 培养基
Mueller-Hinton(MH)琼脂和Mueller-Hinton(MH)肉汤分别由北京奥博星生物技术有限公司和美国BBL公司提供。
1.1.4 仪器
CJ-S-I层流洁净工作台(上海医疗器械厂);SPX-150B-2型生化培养箱(广东省医疗器械厂);DRP-9272型电热恒温培养箱(上海医疗器械厂);麦氏比浊管(北京天诚沃德生物技术有限公司);DS-1型高速组织捣碎机(上海标本模型厂);TDZ4-WS型离心机(上海卢湘仪离心机仪器有限公司);JP300型超声波提取器(武汉嘉鹏电子有限公司);RE-52旋转蒸发器(上海亚荣生化仪器厂)。
1.2 方法
1.2.1 海洋生物提取液的制备
1.2.1.1 水煎液的制备
将泥螺等7种海洋生物洗净后,置于高速组织捣碎机中匀浆3 min,加100 mL蒸馏水,浸泡2 h后加热煮沸并不断搅拌1 h,用高温消毒的4层纱布趁热过滤,残渣同前法再加水煎煮1次。合并2次滤液并加热浓缩至100 mL,然后将浓缩液离心(5 000 r/min,5 min)。取上清液,用蒸馏水调至药材比量为1 g/mL,倾入无菌试管,高压灭菌后置于4℃冰箱中保存备用。
1.2.1.2 醇提液的制备
将泥螺等7种海洋生物洗净后,置于高速组织捣碎机中匀浆3 min,加100 mL 40%乙醇溶液,加热70℃左右回流1 h,用高温消毒的4层纱布趁热过滤,将滤液加热浓缩至100 mL,然后将浓缩液离心(5 000 r/min,5 min)。取上清液,用40%乙醇溶液调至药材比量为1 g/mL,倾入无菌试管,高压灭菌后置于4℃冰箱中保存备用。
1.2.1.3 超声提取液的制备
将泥螺等7种海洋生物洗净后,置于高速组织捣碎机中匀浆3 min,加100 mL蒸馏水,浸泡2 h后用超声波提取器70℃左右提取1 h,用高温消毒的4层纱布趁热过滤,将滤液加热浓缩至100 mL,然后将浓缩液离心(5 000 r/min,5 min)。取上清液,用蒸馏水调至药材比量为1 g/mL,倾入无菌试管,高压灭菌后置于4℃冰箱中保存备用。
1.2.2 菌悬液制备[5]
将上述各供试菌种接种到MH琼脂培养基中,36℃培养18~20 h后用接种环挑取菌落接种于MH肉汤培养液中。菌液浓度用麦氏比浊管比浊校正,再用活菌计数法进行菌落计数,使含菌量约为1.0×108CFU/mL,备用。
1.2.3 抑菌试验
1.2.3.1 纸片法初筛抗菌活性
取灭菌过的圆形滤纸片(Φ 6 mm),分别加10 μL样品(每种样品的浓度为1 g/mL),于56℃烘箱烘干备用。将5种供试菌液(浓度1.0×108CFU/mL)分别涂布于MH琼脂平板,稍干后贴上已制备好的各种抗菌活性纸片,同时作空白纸片的对照,置于37℃恒温培养箱中培养18~24 h观察结果,测量抑菌圈直径[6]。
1.2.3.2 最低抑菌浓度(MIC)测定[7]
采用试管倍比稀释法,分别取无菌试管12支,在第1、2管分别加入各提取液 0.5 mL,在第 2管至第10管分别加人MH 肉汤 0.5 mL,用 1.0 mL分度吸量管从第2管开始管内倍比稀释药液至第10管,充分混匀后从第 10管中弃去 0.5 mL。第11管加MH肉汤1.5 mL,第 1 管至 10 管分别各加 MH肉汤 1.0 mL,第 12 管加 2.0 mL;第1至11管各加菌悬液0.5 mL。第 11 管不加药液为阳性对照,第12管只加2.0 mL MH 肉汤为阴性对照。充分混匀放置37℃恒温箱培养18~24 h,观察结果。结果判别:如试管内呈浑浊,证明有细菌生长;如试管内澄清透明,证明无菌生长。以无肉眼可见细菌生长的药物最低浓度即为该待测菌最低抑菌浓度(MIC)。
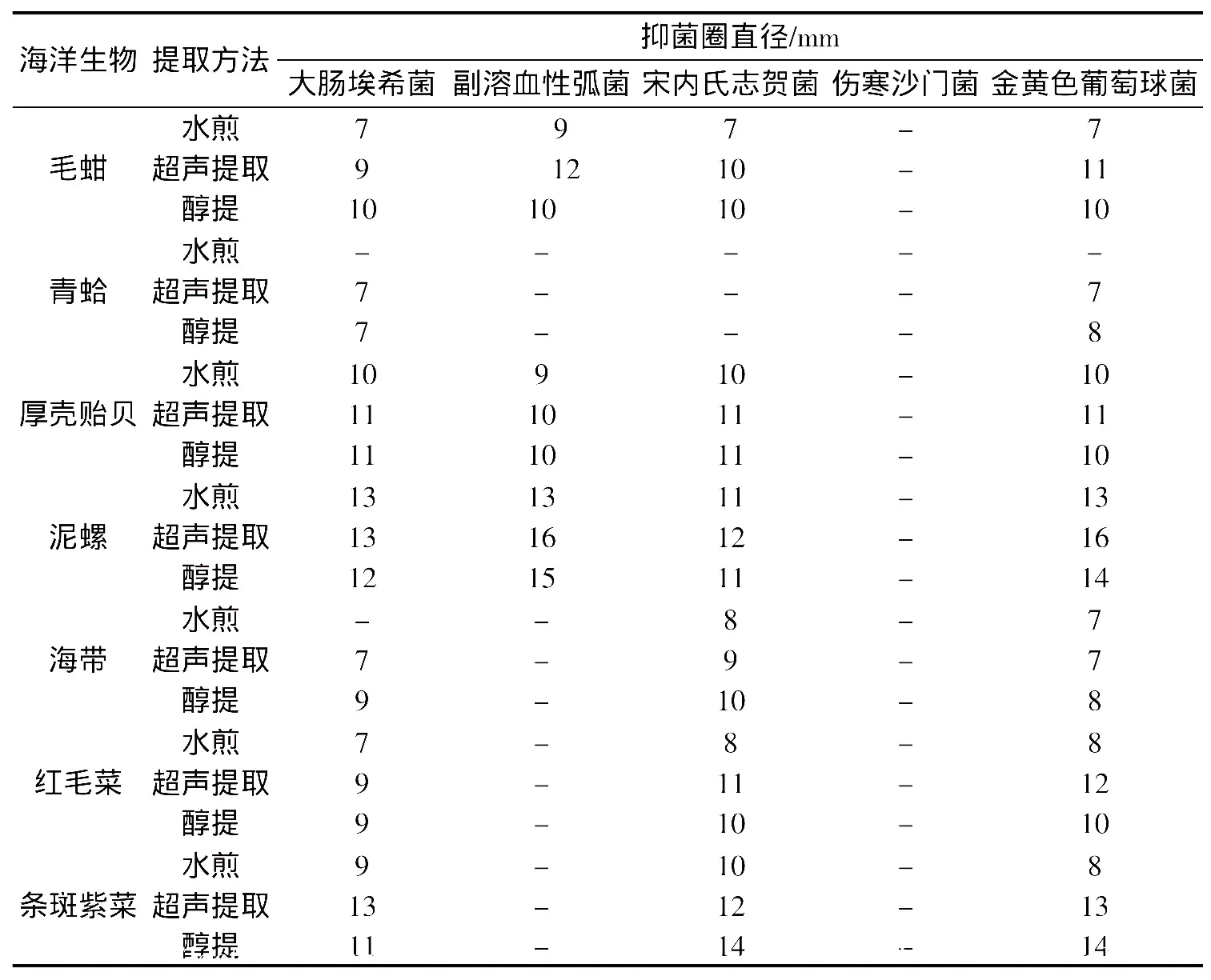
表1 纸片法初筛抑菌活性的测定结果Tab.1 Results of screening for inhibitory activities of 7 marine organisms
2 结果
7种海洋生物提取液的抗菌活性初筛结果见表1,MIC的测定结果见表2。泥螺、条斑紫菜、厚壳贻贝、红毛菜、毛蚶、海带对大肠埃希菌、宋内氏志贺菌和金黄色葡萄球菌有一定的抑菌作用,其中泥螺、条斑紫菜的超声提取液和醇提液的抑菌作用尤为明显。泥螺超声提取液对副溶血性弧菌和金黄色葡萄球菌的MIC均为62.5 mg/mL,泥螺醇提液对副溶血性弧菌和金黄色葡萄球菌的MIC分别为125 mg/mL和62.5 mg/mL,条斑紫菜醇提液对宋内氏志贺菌和金黄色葡萄球菌的MIC分别为62.5 mg/mL和125 mg/mL。青蛤的水煎液、超声提取液和醇提液对大肠埃希菌、副溶血性弧菌、宋内氏志贺氏菌、金黄色葡萄球菌均无明显抗菌活性。7种海洋生物的各类提取液对伤寒沙门菌均无抗菌作用。
3 讨论
本研究结果显示,舟山群岛海域采集到的3种海洋藻类生物,其中红毛菜和条斑紫菜的抗菌谱较广,对大肠埃希菌、宋内氏志贺菌和金黄色葡萄球菌均有不同程度的抑制作用,尤其以条斑紫菜醇提液对宋内氏志贺菌的抑制活性最强。
条斑紫菜中的抗菌活性物质的结构鉴定尚未见报道,其在藻体中的存在状态和性质也尚未阐明。江龙法等[8]用一系列不同极性的溶剂对紫菜进行提取,结果发现,乙醇质量分数在0~40%范围内时,随乙醇质量分数的升高提取物抗菌性增加;继续提高乙醇质量分数,提取物抗菌性降低;当乙醇质量分数高于60%时,提取物无抗菌能力;乙醚提取物也无抗菌性。本研究结果发现,条斑紫菜超声提取液的抑菌作用较强,分析条斑紫菜中的抗菌物质可能存在于细胞内,超声波对提取效果的贡献可能是通过破坏细胞结构实现的。
贝类的体液免疫因子在机体防御中起着十分重要的作用,贝类的体液免疫因子主要包括水解酶类、凝集素和抗菌肽。抗菌肽是动物免疫防御系统经诱导产生的一类防御性活性肽类物质,能对抗外源性病原体的致病作用,是动物体液防御系统的一个重要组成部分,迄今已有500多种被分离鉴定。在贻贝、菲律宾蛤仔、太平洋牡蛎、泥螺、泥蚶等贝类体内均提取到具有一定抗菌活性的肽类物质。它们具有一些共同的特点:多数是富含半胱氨酸的阳离子型分子;分子量一般在10 kDa以下;具有广谱抗菌活性,且细菌不容易对其产生耐药性[9]。
本研究结果表明,泥螺和厚壳贻贝的提取物具有较强的抗菌活性,尤其是泥螺的超声提取液,对副溶血性弧菌和金黄色葡萄球菌均表现出较强的抗菌活性。本研究工作还显示,不同来源、不同提取方法所得到的样本,其抗菌活性有较大区别。我们将对其进行深入研究,对各种提取液中的抗菌活性物质进行进一步的纯化和结构分析,希望能从中找到一些新的抗菌化合物,用以进行后续开发。
[1]RAO P P S,KAO P S,KARMARKAR S M.Antibacterial substances from brown algae[J].Bot Mar,1986,29:503-507.
[2]CACCAMESE S,TOSCANA R M,FURNARI G,et al.Antimicrobial activities of red and brown algae from Southern Italy Coast[J].Bot Mar,1985,28:505-507.
[3]MITTA G,VANDENBULCKE F,ROCH P.Original involvement of antimicrobial peptides in mussel innate immunity[J].FEBS Lett,2000,486(3):185-190.
[4]范秋领,黄才国,缪辉南,等.浙江舟山群岛12种海洋动物中生物活性物质的初步筛选 [J].中国海洋药物杂志,2005,24(1):37-39.
[5]马绪荣,苏德模.药品微生物学检验手册[M].北京:科学出版社,2000:197-205.
[6]徐叔云,卞如濂,陈 修.药理实验方法学[M].北京:人民卫生出版社,2003:1 647-1 651.
[7]Clinical and Laboratory standards Institute.Performance standards for Antimicrobial susceptibility testing[M].M100-S15,2005.
[8]江龙法,沈泽峰,钱志刚,等.紫菜中提取抗菌活性物质初步探讨[J].淮海工学院学报:自然科学版,2007,16(2):59-61.
[9]杨 明,侯 敢,黄迪南,等.海洋贝类体液防御机制的研究进展[J].水产科学,2006,25(8):428-430.

