腹腔镜胆囊切除术意外胆囊癌 37例临床分析
西安交通大学医学院第一附属医院普通外科(西安 710061)陈 域 马清涌 付 京 刘 骁
腹腔镜胆囊切除术 (Laparoscopic cholecystectomy,LC)具有微创、直观、安全等独特的优势,目前已基本取代传统的开腹胆囊切除术(Open cholecystectomy,OC),成为治疗胆囊良性疾病的标准术式。但对于胆囊癌等恶性肿瘤,腹腔镜手术被认为更易引起切口肿瘤种植和腹腔肿瘤播散等并发症而受到限制。意外胆囊癌(Incidental gallbladder carcinoma,UGC)是指临床上因良性疾病行胆囊切除术中或术后偶然发现胆囊癌的病例。随着 LC的广泛开展,LC术中或术后 UGC的发生率也越来越多,引起广泛的关注。但因国内、外对 UGC缺乏大样本的临床随机对照研究,故国际上尚无统一的治疗标准。我院和解放军第451医院于 2000年 5月至 2006年 3月期间,在 13 547例 LC中发现 37例 UGC,现分析报告如下。
资料与方法
1 临床资料 本组 37例,其中男 15例,女 22例,男女比例为 1∶1.47。 年龄 39~ 72岁,平均 58岁;其中 < 50岁 4例 ,占 10.8%;50~ 59岁 11例 ,占 29.7%;60~ 69岁 12例 ,占 32.4%;70~ 79岁有 7例 ,占18.9%;80岁以上 3例,占 8.1%。术前主要表现为反复发作右上腹或剑突下隐痛不适 31例 (占 83.8%),其中伴腰背放射 13例 (占 35.1%);皮肤、巩膜黄染 16例 (占 43.2%);恶心呕吐 11例 (占 29.7%);上腹饱胀感 5例 (占 13.5%);发热 14例 (占 37.8%);食欲减退 10例 (占 27.0%);体质量减轻 9例 (占 24.3%);无症状 1例 (占 2.7%)。 37例患者入院后均行肝功生化检测,其中有 17例 (45.9%)出现不同程度的血清胆红素升高,15例 (40.5%)出现转氨酶升高,9例 (24.3%)出现低蛋白血症。术前 B超及 CT检查,发现胆囊结石 34例 (91.9%);胆囊息肉 3例 (9.1%);胆囊肿大 19例 (51.4%);胆囊壁增厚 23例(62.2%);胆囊壁回声不均 8例 (21.6%)。所有患者术前均未检查 CA125、CA19-9、CEA等血清肿瘤标志物含量。术前诊断:结石性胆囊炎 34例 (占 91.9%),胆囊息肉 3例 (占 9.1%)。无 1例术前确诊为胆囊癌。
2 病理资料 术中发现 UGC 11例(占 29.7%),术后发现 26例(占 70.3%),均经病理证实为胆囊癌,其中腺癌 32例 (占 81.1%),鳞癌 5例 (占 18.9%)。 按照 Nevin分期标准:I期 4例 (10.8%),II期12例 (32.4%),III期 11例 (29.7%),IV 期 6例(16.2%),V期 4例 (10.9%)。体底部癌 28例 (75.7%),颈部癌 9例 (24.3%)。
3 治疗方法 所有病例计划手术方式均为 CO2气腹下行 LC或联合腹腔镜胆总管切开取石术。术中探查并剖检胆囊切除标本,发现胆囊息肉 3例,其中 2例息肉直径>1.0 cm,1例 <1.0 cm,但基底部均宽而无柄;胆囊结石 34例,其中胆囊肿大、胆囊壁增厚 23例;与胆囊床周围肝脏组织形成实质性肿块 2例;腹腔广泛转移 2例。 2例 I期、1例 II期、4例 IV期和 2例V期患者,因经济等原因拒绝二次手术,仅行 LC。有27例中转开腹或二次手术行胆囊癌根治术 (Radical cholecystectomy,RC)或扩大根治术。术中明确诊断后直接中转开腹行手术治疗 5例,III期 2例,IV期 2例,V期 1例。术后明确诊断后再次开腹行手术治疗22例,I期 2例,II期 11例,III期 9例。 1例 V期患者行姑息性手术,为胆囊切除+胆总管切开+T管引流。RC切除标准:包括切除胆囊及胆囊床周 2cm内的肝组织,清扫肝十二指肠韧带内淋巴结(胆囊、肝门和胆总管周围)、神经纤维和结缔组织,即肝十二指肠韧带的血管“骨骼化”。淋巴结清扫范围尚包括后腹膜淋巴结、胰十二指肠后上淋巴结、肝动脉旁淋巴结、腹腔动脉旁淋巴结、肠系膜上动脉旁淋巴结。胆囊癌扩大根治术标准:在 RC的基础上,再扩大淋巴清扫范围和肝脏切除范围,如:部分肝段切除,特别是毗邻的肝 IVa、V或 IVa、V、VI的肝段切除术,扩大右半肝或肝右三叶切除术等;同时还要切除其他邻近受侵犯或转移的组织脏器,如受侵犯的胆总管切除重建,门静脉切除重建,结肠部分切除,十二指肠部分切除重建,甚至是部分肝切除加胰十二指肠切除,即肝胰十二指肠切除术(HPD)。
4 统计学处理 采用 SPSS10.0统计软件进行统计分析。并发症发生率的比较用i2检验;Kaplan-Meier法绘制生存曲线 Log-rank检验分析生存率有无统计学差异。以 P<0.05为有显著性差异,以 P<0.01为有极显著性差异。
结 果
1 术前临床特点分析 本组 37例患者中,年龄> 50岁者共有 33例 (89.2%),> 60岁者共有 22例(59.5%);病史> 5年者共有 26例 (70.3%);合并胆囊结石 34例 (91.9%);胆囊肿大 19例 (51.4%);胆囊壁增厚 23例 (62.2%);胆囊息肉 3例,其中 2例息肉直径>1.0 cm,1例 <1.0 cm,但基底部均宽而无柄。以上情况均符合胆囊癌的高危因素。
2 术后并发症的发生率 27例接受 RC或扩大根治术治疗的患者中有 19例患者共发生各类并发症共 29例次。其中切口感染 3例,肺部感染 5例,腹腔感染 6例,真菌感染 3例,胆漏 2例,腹腔出血 2例,右侧胸腔积液 2例。有 1例患者术后并发心衰伴心律失常,急性肝、肾功能衰竭及呼吸衰竭和肺不张。9例仅行LC治疗的患者中未出现严重并发症,仅有 1例发生胆囊窝积液,1例发生轻度胆漏,经对症保守治疗后均缓解。计算两组并发症的总体发生率:总体发生率=该组所有发生并发症的患者例数/该组患者总人数,其中 1例患者若发生多种并发症只记作 1例。RC组并发症的总体发生率为 70.4%(19/27),LC组并发症的总体发生率为 22.2% (2/9),比较两组并发症发生率的差异,i2=6.44,P<0.05,提示具有显著性差异,LC组患者术后并发症的总发生率显著低于 RC组(见附表)。
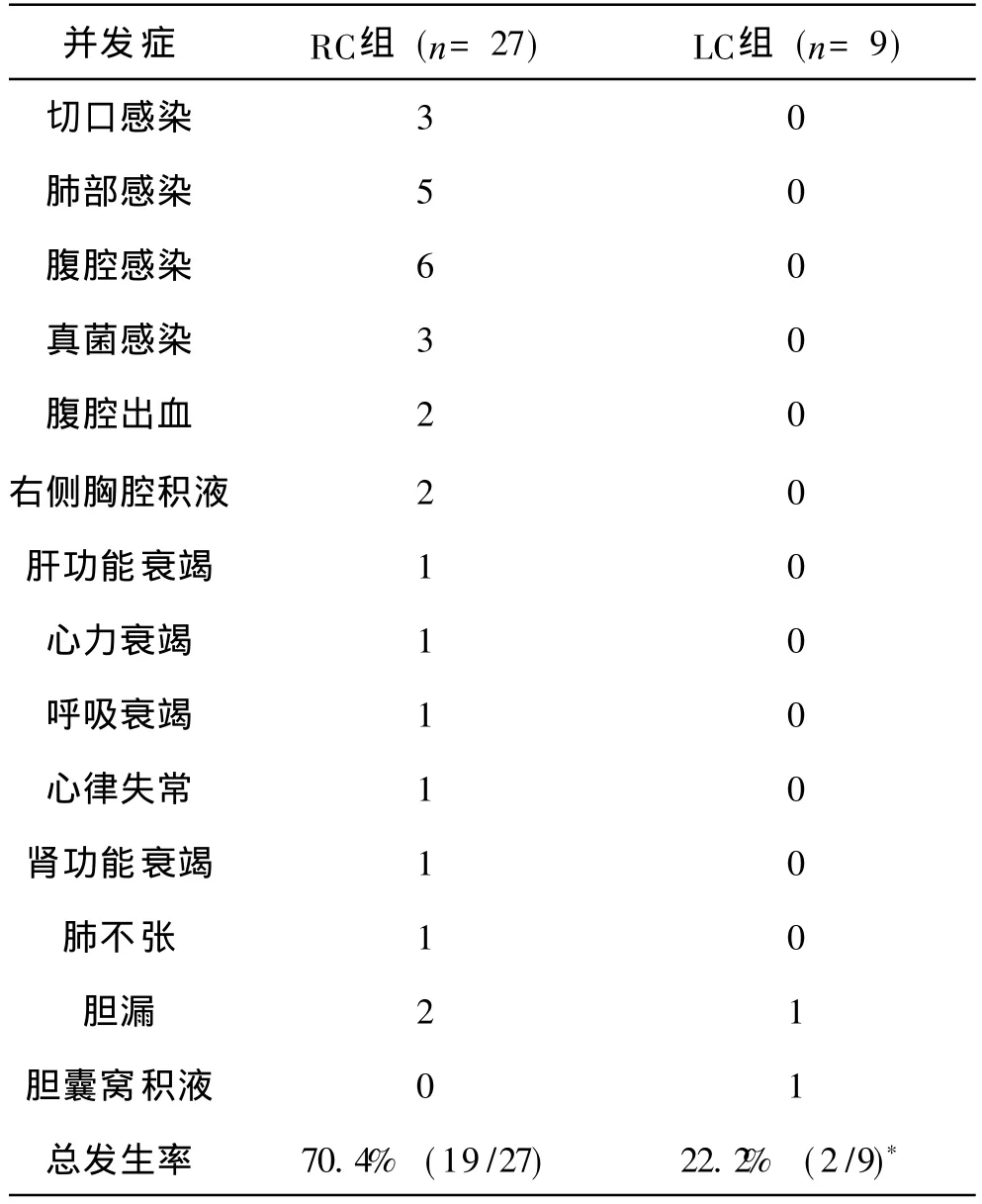
附表 两组患者术后并发症的发生情况 (n)
3 术后生存分析 全组无手术死亡,共诊断LC中 UGC 37例,发生率为 0.27%(37/13547)。所有患者均进行术后随访,随访期为 2~ 61个月,中位随访期为 31个月。至研究结束时,共有 29例患者死亡,8例患者存活,总病死率为 78.4%。生存时间最长者为 61个月,其原发肿瘤为 Nevin I期。行 RC或扩大 RC治疗的患者中位生存时间为 35个月,平均生存时间为 33±4个月,95%可信区间为 (26,40)个月;行 LC治疗的患者中位生存时间为 19个月,平均生存时间为 20±5个月,95%可信区间为(11,29)个月。行 RC或扩大RC治疗的 27例患者,术后第 1、2、3年累积生存率分别为 85.2%、66.7%、48.1%;仅行腹腔镜胆囊切除术的 9例患者,术后第 1、2、3年累积生存率分别为 55.6%、44.4%、22.2%。以 Kaplan-Meier法绘制生存曲线,采用 Log-rank检验比较生存率的差异,i2=4.00,P<0.05,提示有显著性差异,RC治疗组的生存率优于 LC治疗组 (见附图)。

附图 两组患者的术后生存率曲线
4 术后肿瘤种植转移情况 至研究结束时,共出现术后 Trocar切口处种植转移 3例,发生率为 8.1%,分别发生于术后第 1.7月、第 8.7月和第 12.5月。共有 5个 Trocar切口处出现转移,其中 2个为非标本取出孔。再次手术切除种植肿瘤及腹壁其余Trocar切口后,分别存活 9个月、14个月和 20个月后死亡。
讨 论
目前 75%的胆囊切除术是由腹腔镜技术完成的[1],故 LC术中或术后 UGC的发现率明显增加,大约为 0.3%~1.5%[2],本组的发现率为 0.27%。胆囊癌是一种恶性程度很高的肿瘤,发病率约为 0.8%~1.2%[3],早期诊断比较困难,易发生转移,临床发现后往往已失去手术时机,因此预后很差。如何有效避免LC术中和术后 UGC的漏诊、减少术后种植转移和提高临床疗效值得总结和探讨。
UGC发生的主要原因是:①胆囊癌早、中期常缺乏特异症状,通常以反复发作右上腹疼痛或不适为首发症状,易与结石性胆囊炎或胆囊息肉等相混淆,诊断较为困难。有 15%~20%的胆囊癌患者是在术中探查或术后病检中意外发现的,而在胆囊癌得到确切诊断时,只有 20%的患者胆囊病变局限在胆囊内,80%的病变已侵犯邻近组织器官或已有远处转移[4];②胆囊癌大多伴有胆囊结石,医务人员常注意结石,而忽视了对胆囊壁的观察。胆囊结石及胆囊壁的炎症改变是胆囊癌术前诊断困难的主要障碍[5];③B超、CT对充满型和黏膜增厚型胆囊癌在伴有结石的情况下,与常见的萎缩性胆囊炎不易鉴别;④对于小的息肉型胆囊癌,B超、CT均无法与胆囊良性息肉病变相区别;⑤缺乏特异性血清肿瘤标志物。结合文献报道,分析本组 37例 UGC的可能相关高危因素有:①年龄>50岁,反复发作的胆囊炎病史>5年;②胆囊结石直径>3.0 cm或伴胆囊萎缩;③胆囊颈部嵌顿结石及 Mirizzi综合征;④胆囊结石伴胆囊壁增厚且僵硬;⑤胆囊造瘘术后;⑥单个无蒂或迅速增大的胆囊息肉,基底部较宽且质地硬者;⑦其他还包括女性、肥胖、伤寒携带者、糖尿病等[6]。对于提高胆囊癌诊断率和避免 UGC漏诊,我们的经验是:高度重视可能引起胆囊癌发病的高危因素,对有高危因素的患者,应做到术前结合 B超、CA19-9、CA125、CEA等进行初步筛选,然后采用 CT等进行定位诊断,显示肿瘤的大小与部位,及与胆总管、肝动脉、门静脉的相互关系,以实现早期诊断;术中切出胆囊后应常规解剖胆囊,观察浆膜及黏膜变化,对胆囊壁的局部色泽、质地及增厚情况进行初步判断,对于疑似病例应行快速冰冻切片检查以明确诊断。Akyurek等[7]研究表明术中通过简单的标本观察和触摸胆囊黏膜可有效的避免漏诊 UGC。Aoki等[8]研究表明术中冰冻切片检查能有效诊断 III期以上的胆囊癌。本组中有 11例经术中冰冻获得诊断,但还有 26例经术后常规病理检查才获得诊断。因此思想上重视UGC,术前仔细分析病历资料,术中仔细探查和冰冻切片检查,及术毕病理检查,是有效避免漏诊 UGC的方法。 LC是否促进 UGC的切口种植转移,至今仍有较大争论。 Lundberg等[9]比较了 60例 LC和 210例OC中 UGC的切口转移情况;前者发生率为 15%,主要与术中胆囊破裂、胆囊癌分期、手术操作有关;后者发生率 6.5%,可发生在切口上、T管和胆囊造瘘口;统计结果提示 LC与 OC相比,并未增加切口种植转移的发生率。但更多的学者认为 LC术后 UGC易发生腹腔或戳孔转移。LC术后 UGC发生腹腔或戳孔转移主要还是由于肿瘤细胞污染腹腔或戳孔组织引起的。目前认为,术中胆囊抓钳引起的胆囊壁的细小穿孔和气腹的高压雾化作用,是导致肿瘤细胞污染腹腔,促进肿瘤细胞腹腔转移的主要原因;而戳孔处排气,器械接触和胆囊取出时的挤压,均易导致戳孔处肿瘤的生长、转移;此外,CO2气腹造成免疫力下降和戳孔处炎性渗出液积聚,也是造成肿瘤转移的高危因素。因此,对术前已明确诊断或高度怀疑为胆囊癌的患者,还是应进行开腹手术。
对于 LC是否影响 UGC的疗效和预后也有不同的报道。Goetze等[3]比较了 201例 LC和 119例 OC的UGC预后,两者无显著性差异,表明 LC不会影响意外胆囊癌的预后。 Kang等[10]通过比较 57例经 LC治疗和 162例未经 LC治疗的胆囊癌患者的预后,发现I、II期胆囊癌可仅行 LC,而无须根治性手术治疗,因为 I、II期胆囊癌的淋巴结转移率非常低。但也有学者认为,早期 UGC行胆囊癌根治术的生存率明显高于LC组,仅行单纯 LC治疗是达不到根治目的[11,12]。本组病例中,行 RC或扩大 RC治疗的 26例患者,术后第1、2、3年累积生存率分别为 85.2%、66.7%、48.1%,生存时间最长为 61个月;而仅行腹腔镜胆囊切除术的9例患者,术后第 1、2、3年累积生存率分别为 55.6%、44.4%、22.2%。从两组生存时间对比来看,根治术的近期效果要好于 LC治疗。因此,对于 UGC患者,无论是术中还是术后发现的,都应尽可能早期行胆囊癌根治术治疗,以延长患者的生存时间。
总之,如果术前未诊断出胆囊癌,LC术中又未能仔细检查标本并采取相应的补救措施,那么将造成病人再次手术的痛苦,或使病人因肿瘤短时间内复发而死亡。因此,普外科的医护人员应有 UGC的意识,对每一例行 LC的病人都要注意 UGC的问题。术前应仔细询问病例和仔细体格检查,对有胆囊癌高危因素的患者,术前应联合影像学和血清肿瘤学指标检查,以排除UGC。
[1]WolffS, Kuhn R, Lippert H. Zufallsbefund-Gallenblasenkarzinom nach laparoskopische cholezystektomie-wann operieren [ J ].Viszeralchirurgie,2002,37(4):305-308.
[2]Tomotaka A,Masakazu U,Motohide S,et al.Long term survival of patients with gallbladdercancer detected during or after laparoscopic cholecystectomy[J].Worrd J Surg,2005,29(9):1106-1109.
[3]Goetze T,Paolucci V.Does laparoscopy worsen the prognosis for incidental gallbladder cancer[J].Surg Endosc,2006,20(2):286-293.
[4]Misra S,Chaturvedi A,Misra NC,et al.Carcinoma of the gallbladder[J].Lancet Oncol,2003,4(3):167-176.
[5]Roa I,Araya JC,Villaseca M,et al.Gallbladder cancer in a high risk area: morpohological features and sperad patterns[J]. Hepatogastrology,1999,46(27):1540-1546.
[6]Pavlidis T E,Marakis GN,Ballas K,et al.Risk factors influencing conversion of laparoscopic to open cholecystectomy[J].J Laparoendosc Adv Surg Tech A,2007,17(4):414-418.
[7]Akyurek N,Irkorucu O,Salman B,et al.Incidental gallbladder cancer during laparoscopic cholecystectomy[J].J Hepatobiliary Pancreat Surg,2004,11(5):357-361.
[8]Aoki T,Tsuchida A,Kasuya K,et al.Is frozen section effective fordiagnosisof unsuspected gallbladder cancer during laparoscopic cholecystectomy[J].Surg Endosc,2002,16(1):197-200.
[9]Lundberg O, Kristoffersson A. Open versus laparoscopic cholecystectomy for gallbladder carcinomaJ Hepatobiliary[J].Pancreat Surg,2001,8(6):525-529.
[10]Kang CM,Choi GH,Park SH,et al.Laparoscopic cholecystectomy only could be an appropriate treatment for selected clinical R0gallbladder carcinoma[J].Surg Endosc,2007,21(9):1582-1587.
[11]邹声泉,徐立宁.重视意外胆囊癌的诊治问题 [J].中华外科杂志,2005,43(13):833-834.
[12]Kapoor V K.Incidental gallbladder cancer[J].Am J Gastroenterology,2001,96(3):627-629.

