B7-H4分子在非小细胞肺癌组织中的表达及临床意义
江苏省南通市中医院外科(南通 226001)秦旭东 丁 伟 姚祖仁 陆海舟
肺癌是严重危害人类健康的疾病,根据世界卫生组织(W HO)2003年公布的资料显示,肺癌无论是发病率(120万 /年 )还是病死率(110万 /年),均居全球癌症首位。肿瘤发生发展与转移实质上是人体免疫功能失常所致。大量的研究证明免疫功能失调、特别是 T细胞免疫功能失常,使肿瘤细胞在发生早期能够逃逸免疫监控和免疫攻击,从而发展至临床阶段。近年来,T细胞共刺激分子 B7家族有了很大的扩展。最新发现B7家族成员 B7-H4在体外通过抑制 T细胞增殖和细胞因子产生,负性调节 T细胞反应[1]。免疫组化分析显示,B7-H4在正常外周组织中几乎没有阳性表达,而在一些卵巢癌和乳腺癌中有丰富表达[2~4]。所以,推测B7-H4具有减轻炎性反应和下调抗肿瘤免疫应答的作用。为探索一种新的诊断和治疗食管癌的靶目标,本研究应用免疫组织化学染色对 B7-H4在非小细胞肺癌组织中的表达进行了研究。
资料与方法
1 临床资料 南通市中医院普外科于 2004年6月至 2008年 6月诊治原发性非小细胞肺癌患者 80例。其中男 52例,女 28例,诊断时平均年龄 57.2岁,腺癌 38例,鳞癌 42例;13例高分化,45例中分化,22例低分化。根据手术和病理发现及美国联合会癌症分期手册进行分期:Ⅰ期 18例,Ⅱ期 26例,Ⅲ期 34例。根据 1999年修正的最新分类法确定细胞分化程度。
2 主要试剂 兔抗人 B7-H4多克隆抗体为北京博奥森生物技术有限公司产品。Vltra Sensitive S-P超敏试剂盒和 DAB显色试剂盒为福州迈新生物技术开发有限公司产品。
3 免疫组织化学染色 采用 SP法。按照福建迈新生物技术有限公司 SP即用型试剂盒说明书进行。具体操作步骤:福尔马林固定手术标本,石蜡包埋,切片厚度 4 μ m,二甲苯脱蜡,阶梯酒精内水化。切片经3%H2O2孵育 15min,然后置于柠檬酸钠缓冲液(CBS,0.01mol/L,pH6)中,微波(850W)修复抗原至沸腾即止,待缓冲液自然冷却后取出切片,依次滴加 A液(过氧化物酶阻断剂 )孵育 15min,B液 (正常羊血清)孵育15min,兔抗人 B7-H4多克隆抗体(1∶100)4℃孵育过夜,C液 (生物素标记的羊抗兔 IgG)孵育 15min,D液(链霉菌抗生物素蛋白-过氧化物酶溶液)孵育 15min,以上各步骤之间用 PBS洗,DAB显色,苏木素复染,常规脱水透明,中性树胶封片。实验组切片染色同时分别用 PBS、正常羊血清代替一抗,以上述步骤处理同样切片作为空白对照和替代对照染色。
4 B7-H4的表达分析 用 SP-2000病理图文报告系统进行图像采集。通过计数在胞膜上或 P和胞浆内有阳性染色的细胞个数进行组织学分析 B7-H4的表达。在 400倍镜下随机选择的 5个肿瘤区域进行细胞计数。 B7-H4的染色强度根据阳性细胞的百分比进行半定量分级:0: < 10%;(+):10%~40%;(⧺):40%~80%;(⧻):> 80%。结果判断:<10%为阴性;10%~100%为阳性。
5 统计学处理 用 SPSS12进行数据分析。进行i2检验和 Fisher精确检验分析 B7-H4的表达及其与各临床参数之间的关系。以P <0.05为有显著性差异,P <0.01为有极显著性差异。
结 果
1 B7-H4在非小细胞肺癌组织中的表达 非小细胞肺癌组织中 B7-H4呈弥漫性表达,在胞浆和胞膜均有表达(见图 1),80例非小细胞肺癌组织中,B7-H4表达的阳性率为 37.5%(30/80)。阳性者表达强度大部分在 (⧺ )以上 (见图 1)。
2 在非小细胞肺癌中 B7-H4的表达及其与病理特征的关系 见附表。鳞癌和腺癌患者 B7-H4阳性表达率间无显著性差异(P> 0.05);不同年龄、性别、吸烟史或分化程度患者 B7-H4阳性表达率间均无显著性差异(P>0.05);发生淋巴结转移和未发生淋巴结转移患者 B7-H4的阳性表达率间有显著性差异(P<0.05)。

图1 免疫组织化学染色(SP×100)非小细胞肺癌组织B7-H4阳性表达(⧻)
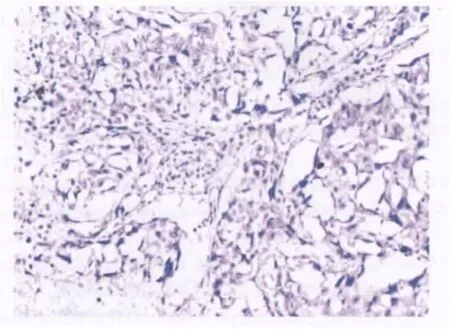
图2 免疫组织化学染色(SP×100)非小细胞肺癌组织B7-H4阴性表达
讨 论
肺癌是严重威胁人类健康与生命的恶性肿瘤,治疗方面目前主张以手术为主的多学科综合治疗,尚无更确切有效的治疗方法,而且影响预后的因素不甚明确。非小细胞肺癌是肺癌常见的类型,预后较差,肺癌化学治疗虽能降低癌症病死率,但现有的抗肿瘤药具有杀伤肿瘤细胞的同时对正常细胞也有较大的杀伤性副作用,同时易出现耐药。免疫治疗是近年来科学工作者广泛认同的较为理想的肿瘤治疗方法,其疗效提高的关键有赖于对肿瘤局部免疫微环境的深入了解。大量的分子生物学研究证实,免疫功能失调,特别是 T细胞免疫功能失常,使肿瘤细胞在发生早期能够逃逸免疫监控和免疫攻击,进而发展至临床阶段。寻找有价值的分子标志物或者非小细胞肺癌相关基因将有助于揭示非小细胞肺癌发生与发展的分子机制。
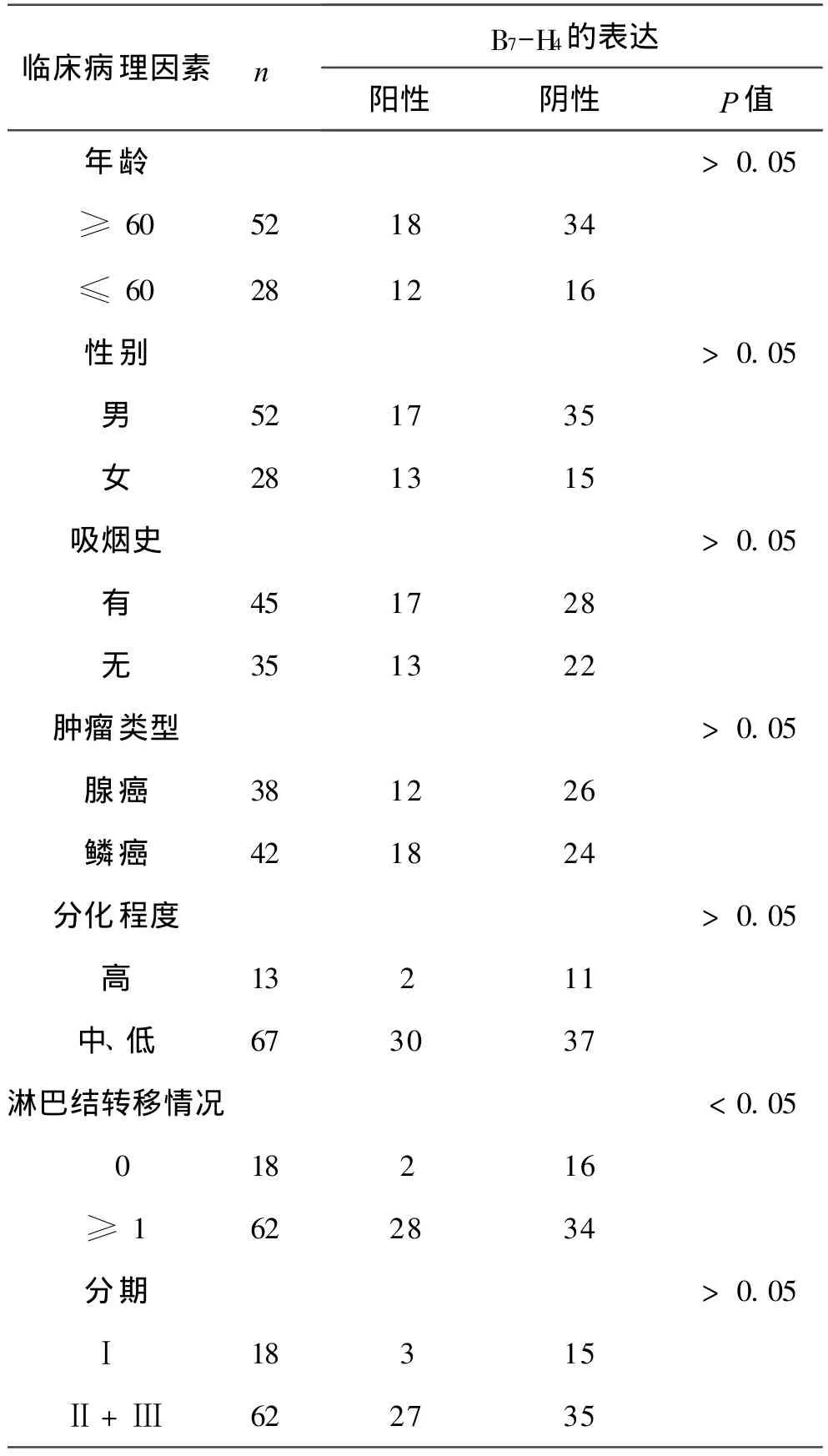
附表 不同临床病理因素影响下 B7-H4的表达情况
20世纪 80年代以来,人们认识到 T淋巴细胞的活化需涉及多种细胞间大分子物质的相互作用。随着T细胞活化信号传导途径研究的不断深入,与 B7分子有关的共刺激通路及抑制通路在感染性疾病、自身免疫性疾病、肿瘤和移植排斥反应中的作用越来越受到人们的关注[7]。
B7-H4(又称 B7s1和 B7x)是 B7家族中的最新发现的一个新成员[5~7],它能通过抑制 T细胞的增殖、细胞因子的产生和细胞周期的进程来负性调控 T细胞的免疫应答。
2003年,Chen等[5~7]三个实验室利用生物信息学的方法相继发现了 B7-H4分子。 B7-H4表达在专职APC和广泛分布在非淋巴组织上[5]。Northern Blot分析示 h B7-H4mRNA在脾、肺和胸腺组织表达丰富。有RT-PCR显示,在所有鼠组织中均检测到 m RNA[5]。在某些肿瘤组织(如卵巢癌、乳腺癌、子宫肿瘤和肺癌等)中发现 B7-H4的组成性高表达[2~4,8~14]。在肿瘤相关巨噬细胞上表达的 B7-H4可以抑制抗肿瘤免疫反应。大部分的人类肿瘤的肺癌[15],卵巢癌[13],乳腺癌[16]细胞表面表达 B7-H4。
Zhang等[6]证实细胞表面表达的 B7-H4可以抑制T细胞反应。此外前期研究工作还发现,B7-H4的调控作用能使 T细胞的细胞周期停滞在 G0/G1期[5],体内输入 B7-H4Ig抑制同种反应性 CTL活性。 B7-H4Ig在体内能抑制 CD8+ CTL的增殖和成熟[5]。内源性 B7-H4可以抑制同种性 CT L的产生,支持内源性 B7-H4在抑制细胞介导的免疫反应中的作用[5]。另外李文桦实验证实[17],如果将不表达或低表达 B7-H4mRNA的肿瘤细胞株接种小鼠,形成的肿瘤组织不仅高表达其mRNA,而且高表达 B7-H4蛋白分子。
Sica等人发现 B7-H4抑制了 T细胞反应。B7-H4Ig也明显抑制了 IL-2和 IL-10的产生。 B7-H4Ig能抑制B7-1共刺激的 T细胞分泌 IL-2、4、10和 IFN-γ。 结果显示 B7-H4诱导的 T细胞增殖抑制不能被 CD28共刺激所逆转[7]。 Kryczek等在研究中发现肿瘤微环境中IL-6、IL-10含量的升高,刺激了巨噬细胞 B7-H4的表达,与之相对应,CSF、IL-4抑制了巨噬细胞 B7-H4的表达[18]。B7-H4的异常表达,使正常的巨噬细胞具有了抑制功能。因而 B7-H4阳性的巨噬细胞在卵巢癌中构成了一个新的抑制性细胞群。
综上所述,非小细胞肺癌组织表达 B7-H4对机体的抗肿瘤免疫发挥抑制作用,参与免疫逃逸。由于肿瘤类型、发生部位以及肿瘤微环境中诸多因素共同影响着肿瘤细胞逃避机体免疫系统的攻击,因而深入研究B7-H4参与肿瘤免疫逃逸的机制对肿瘤免疫治疗具有十分重要的指导意义,通过干预肿瘤细胞上 B7-H4的表达,将成为肿瘤免疫治疗的新靶点。
[1]Flies DB,Chen L.The new B7s:playing a pivotal role in tumor immunity.J Immunother,2007,30(3):251-260.
[2]M ugler KC,Singh M,TringlerB,et al.B7-h4 expression in a range of breast pathology:correlation with tumor T-cell infiltration. Appl Immunohistochem Mol Morphol,2007,15(4):363-370.
[3]Kryczek I,Wei S,Zhu G,et al.Relationship between B7-H4,regulatory T cells,and patient outcome in human ovarian carcinoma.CancerRes,2007,67(18):8900-8905.
[4]Zheng Y, Katsaros D, Shan SJ,etal. A multiparametric panelforovarian cancer diagnosis,prognosis,and response to chemotherapy.Clin Cancer Res,2007,13(23):6984-6992.
[5]Sica GL,Choi IH,Zhu G,et al.B7-H4,a molecule of the B7family,negatively regulates T cell immunity.Immunity,2003,18(6):849-861.
[6]Zang X,Loke P,Kim J,et al.B7x:a widely expressed B7family member that inhibits T cell activation.Proc Natl Acad Sci U S A,2003,100(18):10388-10392.
[7]Prasad DV,Richards S,Mai XM,et al.B7S1,a novel B7 family member that negatively regulates T cell activation.Immunity,2003,18(6):849-861.
[8]Salceda S, Tang T, KmetM,etal. The immunomodulatoryprotein B7-H4is overexpressed in breast and ovarian cancers and promotes epithelial cell transformation.Exp Cell Res,2005,306(1):128-141.
[9]Miyatake T,Tringler B,Liu W,et al.B7-H4(DDO-110)isoverexpressed in high risk uterine endometrioid adenocarcinomas and inversely correlated with tumor T-cell infiltration.Gynecol Oncol,2007,106(1):119-127.
[10]Simon I,Katsaros D,Rigault de la Longrais I,et al.B7-H4is over-expressed in early-stage ovarian cancer and is independent ofCA125expression. Gynecol Oncol,2007,106(2):334-341.
[11]Simon I,Liu Y,Krall KL,et al.Evaluation of the novel serum markers B7-H4,Spondin 2,and DcR3for diagnosis and early detection of ovarian cancer.Gynecol Oncol,2007,106(1):112-118.
[12]Simon I,Zhuo S,Corral L,et al.B7-H4is a novel membrane-bound protein and a candidate serum and tissue biomarker for ovarian cancer.Cancer Res,2006,66(3):1570-1575.
[13]TringlerB, Liu W, CorralL,etal. B7-H4overexpression in ovarian tumors.Gynecol Oncol,2006,100(1):44-52.
[14]Sun Y,Wang Y,Zhao J,et al.B7-H3and B7-H4 expression in non-small-cell lung cancer.Lung Cancer,2006,53(2):143-151.
[15]Choi IH,Zhu G,Sica GL,et al.Genomic organization and expression analysis of B7-H4,an immune inhibitory molecule of the B7family. J Immunol,2003,171(9):4650-4654.
[16]Tringler B,Zhuo S,Pilkington G,et al.B7-H4is highly expressed in ductal and lobular breast cancer.Clin Cancer Res,2005,11(1):1842-1848.
[17]李文桦,刘瑞梓,杨秀利.肿瘤模型中 B7-H4和 BTLA的异常表达.中国癌症杂志,2005,15(4):313-316.
[18]Suh WK,Wang S,Duncan GS,et al.Generation and characterization of B7-H4/B7S1/B7x-deficient mice.Mol Cell Biol,2006,26(17):6403-6411.

