真空碳热还原固相合成磷酸铁锂的正交实验
周环波,林 丽,程 凡,龚春丽,王 丽
(1.孝感学院化学与材料科学学院,湖北 孝感 432100;2.孝感学院新技术学院,湖北 孝感 432100)
磷酸铁锂(LiFePO4)作为锂离子电池正极材料具有良好的发展前景,该材料具有极好的热稳定性,制造的电池具有极好的安全性。LiFePO4过充电时的分解反应温度最宽、在充放电过程中该材料的体积变化较小(约为9.6%),而且这种变化刚好与碳负极在充放电过程所发生的体积膨胀相当[1];LiFe-PO4具有较高的理论比容量和较高的工作电压;合成LiFePO4的原料丰富、价格便宜、无环境污染。因此,LiFePO4成为化学电源相关领域研究的热点,是具有广泛应用前景的锂离子动力电池正极材料之一[2-6]。
目前主要有惰性或高纯氮气保护下的固相反应法[7-9]和热液法[10-11]制备LiFePO4。惰性或高纯氮气保护以抑制Fe(Ⅱ)的氧化、通过控制晶粒生长来控制材料的粒径大小、提高材料的比表面积的方法来提高其离子传导性能等。该方法合成磷酸铁锂电化学性能较差,产品的一致性也较低,生产技术成本较高。
本文采用真空条件下的碳热还原固相方法,以Fe2O3、Li-OH和P2O5为原料合成LiFePO4,活性碳为还原剂,选取真空度、原料配比、反应温度、恒温保持时间(反应时间)和升温速率等5个影响因素,设计了一组5因素4水平L16(45)的正交实验,较系统地研究了合成LiFePO4的工艺参数及电化学性能。
1 实验
1.1 样品的正交设计
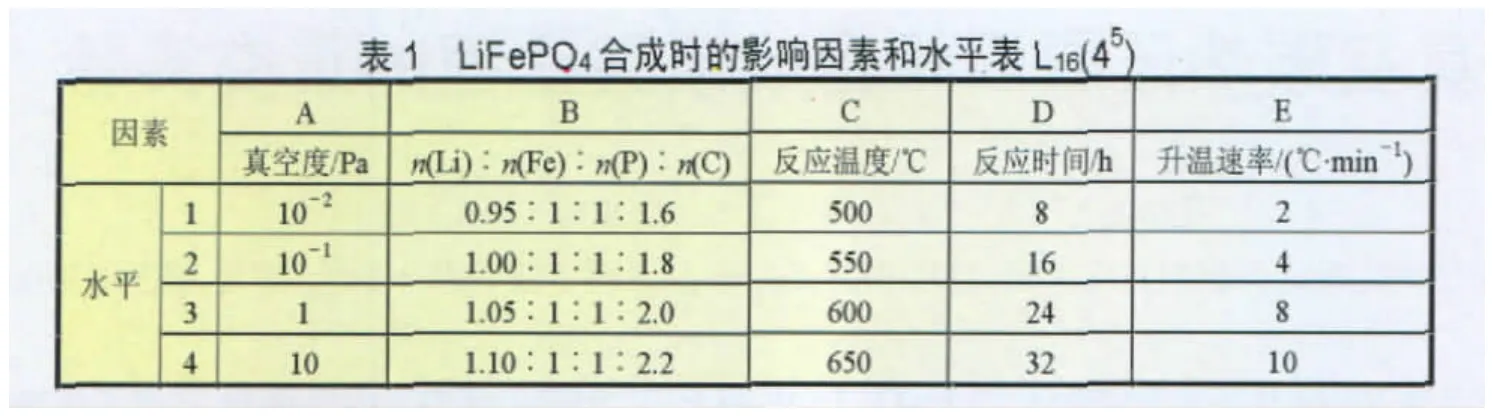
在10~10-2Pa真空条件下,以活性炭为还原剂,以Fe2O3、LiOH 和 P2O5为原料合成 LiFePO4,选择真空度(Pa)、原料配比(摩尔比)、反应温度、恒温保持时间(反应时间)和升温速率等5个影响因素,按照表1所列的因素及水平,设计了一组5因素4水平L16(45)的正交实验。
1.2 LiFePO4的充放电性能实验
以合成LiFePO4样品为正极活性物质,正极物质的质量组成为:LiFePO4∶乙炔黑∶聚四氟乙烯(固含量20%)为90∶5∶5,金属锂为负极、聚丙烯无纺布为隔膜、2 mol/L LiPF6/碳酸乙烯酯(EC)+碳酸二甲酯(DMC)(体积比1∶1)为电解液,将正极活性物质滚压在铜箔上制成厚度约为0.1 mm的正极片,在真空手套箱中组装成实验锂离子电池。用CT2001A型蓝电(LAND)系列电池测试系统(武汉金诺电子有限公司)进行充放电循环测试,均以0.2 C的充放电倍率进行充放电试验,充电终止电压为4.2 V(对Li/Li+电极),放电截止电压为2.8 V。
2 结果与讨论
2.1 正交实验结果分析
对LiFePO4正极材料而言,主要考虑合成工艺条件对其电化学性能、微观结构的影响。在确定了合成方法以及选定了反应原材料的基础上,应主要考虑的条件有:真空度、原料配比、反应温度、恒温(反应)时间以及升降温速率等对样品电性能的影响。由表1可知,这是个5因素4水平的正交实验,在不考虑各因素交互影响的前提下,按表2所示的L16(45)正交表安排实验。对正交实验结果的评价,我们以所制备的LiFePO4正极材料的前10次平均放电比容量作为衡量指标。按照表1所示的因素、水平安排实验,实验结果也列在表2中。
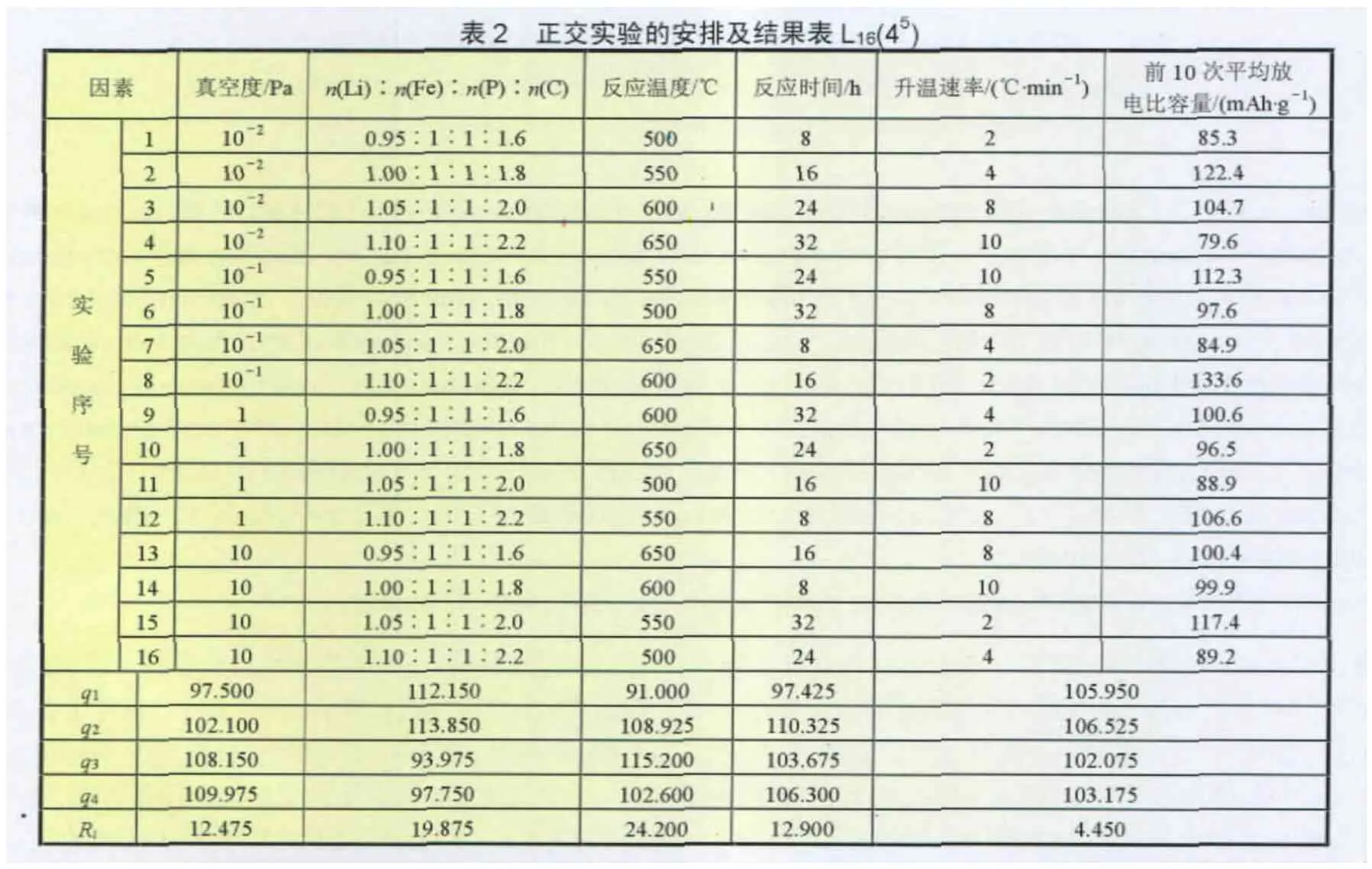
正交实验结果的直观分析采用计算每一种水平所得实验结果的总和(因素在i水平的实验结果的总和),再计算出其平均值,记为qi,再计算出极差Ri(因素各水平的平均实验结果的最大与最小的差值),根据不同因素的极差大小不同,来衡量各因素的影响程度,结果及分析列于表2中。
从表2的实验结果即样品前10次平均放电比容量 (第7列)可以看出,8号实验所得样品的前10次平均放电比容量最高,为133.6 mAh/g。此外,第2、5、15号实验所得样品的前10次平均放电比容量也比较高。为了估计哪些因素比较重要,根据每次实验结果先计算出各因素每一种水平的前10次平均放电比容量的总和,再计算出其平均值qJ。从计算出的各因素的极差RJ值可以看出,反应温度的极差最大为24.200,因此反应温度对合成LiFePO4正极材料的放电比容量的影响最大;原料配比和反应时间的极差分别为19.875、12.900和12.475,三者对材料的放电比容量的影响次之;升温速率对材料的电化学性能也有一定的影响,但其影响最小。所以5个因素对LiFePO4放电比容量的影响大小的顺序为:反应温度>原料配比反应时间>真空度>升温速率。
2.2 反应温度对LiFePO4电化学性能的影响
从上述对表2所示的正交实验结果分析可看出,反应温度对LiFePO4样品电化学性能的影响最大。因为在LiFePO4合成过程中,晶体的形成、晶粒的生长、残留原料的分解等都是发生在反应温度区间。温度控制不当,可能发生各种类型的副反应,从而影响合成样品的晶体结构和电化学性能[8]。
为了进一步考察反应温度对样品电性能和晶体结构的影响,按物质的量比1∶1∶1∶1.8称取一定量的Fe2O3、LiOH、P2O5和活性炭,球磨4 h,将球磨好的原料置于真空反应炉中(控制真空度为1~3 Pa),以4℃/min的升温速率从室温升至250~300℃恒温6 h,再以4℃/min的升温速率分别升至500、550、600、650 ℃,恒温 24 h,以 4 ℃/min 降温速率冷却至室温、球磨30~120 min即得LiFePO4。所得LiFePO4样品的充放电循环性能如表3所示。

从表3可以看出,随着反应温度的升高,样品的第10次循环充放电比容量先增加后有所降低,充放电库仑效率也是先增大后有所减小。在600℃时所得样品的充放电比容量最大,第10次循环放电比容量达到132.2 mAh/g,库仑效率为94.5%。当反应温度650℃时,样品的第10次循环充放电比容量均明显降低(103.9 mAh/g),但充放电库仑效率却略有增加(95.9%)。
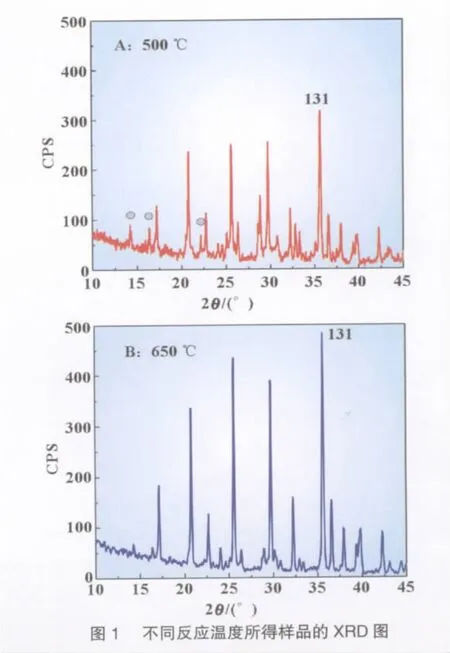
用XRD技术分析了500、650℃反应所得样品的晶体结构,以进一步考察不同反应温度对所得样品晶体结构的影响,结果如图1所示。
从图1可以看出,随着反应温度的升高,所得LiFePO4样品各晶面衍射峰的强度增加,不同温度下各晶面衍射峰的相对强度不尽一致,但衍射峰最强的晶面均为131晶面。在500℃下反应所得样品131晶面的衍射峰的相对强度较650℃反应所得样品131晶面的衍射峰相对强度明显弱;此外,500℃反应所得样品晶体结构中的杂相很明显[图1(a)三个标记衍射峰],可能为Li3PO4、Fe3(PO4)2等杂质。原因可能是LiFePO4晶核的形成和晶体生长与温度有更密切关系,温度升高有利于晶核的形成、晶体的生长。可见,反应温度升高,有利于生成电化学性能更优的完美LiFePO4晶体。
2.3 原料配比对LiFePO4电化学性能的影响
为了进一步研究原料配比对所得样品电化学性能的影响,按不同物质配比的LiOH、Fe2O3、P2O5和活性炭,球磨混料4 h,将球磨好的原料置于真空反应炉中(真空度为1~3 Pa),以4℃/min的升温速率从室温升至250~300℃、恒温6 h,再以 4℃/min的升温速率升至 600℃并恒温 24 h,以4℃/min降温速率冷却至室温、球磨30~120 min得LiFePO4样品。LiFePO4样品的充放电循环数据列在表4中。
由表 4可以看出,当 n(Li)∶n(Fe)∶n(P)∶n(C)小于1.05∶1∶1∶1.8时,随着Li量的增加样品的放电比容量逐渐增加;当 n(Li)∶n(Fe)∶n(P)∶n(C)为 1.05∶1∶1∶1.8 时,第10次循环放电比容量最高,达136.1 mAh/g,库仑效率达92.5%;当原料中 n(Li)∶n(Fe)∶n(P)∶n(C)大于 1.05∶1∶1∶1.8时,所得的放电比容量有显著下降的趋势,n(Li)∶n(Fe)为1.10∶1时,其第10次放电比容量为118.7 mAh/g,前10次循环平均放电比容量降为102.7 mAh/g;锂含量过大,样品的库仑效率降低。因为锂是最轻的金属元素,在加热时可能有一定量的锂以Li2O的形式挥发[8]。因此,在原料配比时锂与铁和磷的比值较小(如<1.0)时,由于锂挥发,锂量不足,形成的磷酸铁(Ⅱ)锂晶体结构中氧八面体的4 a位会产生一定的Li+缺陷,产物为缺陷型化合物(LixFePO4,其 x<1.0),使亚铁(Fe2+)离子周围的电子云密度有所增大,Fe2+形成Fe3+的趋势就增大[12]。当 n(Li)∶n(Fe)∶n(P)∶n(C)小于 1.05∶1∶1∶1.8时,所得LiFePO4样品的放电比容量、充放电库仑效率都较高。

2.4 反应时间对LiFePO4电化学性能的影响
为了考察反应时间对样品电性能的影响,以4℃/min的升温速率升温至250~300℃恒温6 h,接着以相同的升温速率升温至 600℃,分别恒温 6、12、18 h和 24 h,最后以4℃/min的降温速率冷却至室温、球磨得LiFePO4样品,各样品的第10次循环放电曲线如图2所示。

从图2可以看出,反应时间为18 h时,合成LiFePO4的第10次放电比容量最高,为135.8 mAh/g;反应时间为6 h时,LiFePO4的第10次放电比容量仅为120 mAh/g;反应时间为24 h时,合成LiFePO4的第10次放电比容量也只有124 mAh/g。这可能是因为反应时间过短,原料分解不彻底,反应过程中 Li+、Fe2+和 PO43-来不及重排,而杂质离子 CO32-、OH-和H+也来不及脱离体系,从而影响LiFePO4晶核的形成或生成其他类型的非活性磷酸盐[10],影响合成样品的电性能;反应时间过长也可能由于LiFePO4晶体生长过于完美、结晶颗粒较大或者过多的碳被消耗使得材料的电化学性能产生变化而影响材料的放电容量。因此,合成LiFePO4的最佳反应时间应控制在12~18 h。
2.5 真空度对LiFePO4电化学性能的影响
为了二次优化真空度对合成LiFePO4电化学性能的影响,选定 LiOH、Fe2O3、P2O5和活性炭比例为 1.05∶1∶1∶1.8,球磨4 h混料,将球磨原料置于真空反应炉中,控制真空度分别为 10-2、10-1、1、10 Pa 以及 100 Pa,以 4 ℃/min 的升温速率从室温升至250~300℃恒温6 h,再以4℃/min的升温速率升至600℃并恒温24 h,以4℃/min降温速率冷却至室温,球磨30~120 min得LiFePO4样品。LiFePO4样品的充放电循环性能如表5所示。
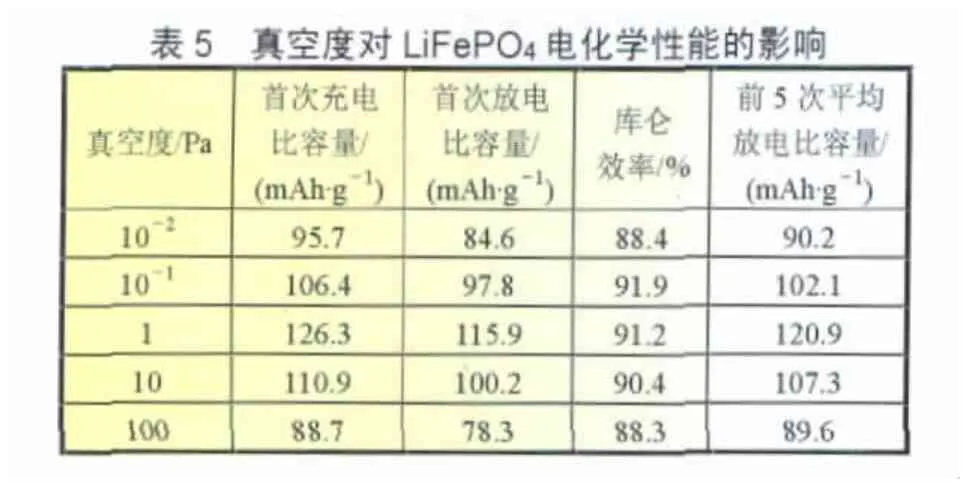
由表5可以看出,随着真空度的降低,合成LiFePO4样品的首次放电比容量、前5次充放电循环平均放电比容量明显先增加后降低;真空度为10-2Pa时,合成LiFePO4样品的首次放电比容量为84.6 mAh/g,库仑效率为88.4%,前5次循环平均放电比容量仅为90.2 mAh/g;真空度为100 Pa时,LiFe-PO4的首次放电比容量只有88.7 mAh/g,库仑效率为88.3%,前5次循环平均放电比容量仅为89.6 mAh/g;真空度为1 Pa左右时,LiFePO4的电化学性能最好,首次放电比容量为115.9 mAh/g,库仑效率为91.2%,前5次循环平均放电比容量为120.1 mAh/g;真空度为 10-1~10 Pa时,合成 LiFePO4的电化学性能也较好。可能原因是:在较高真空度条件下,反应物接触不良,反应完成的程度较低,反应生成的LiFePO4纯度、结晶较差,因而其电化学性能较差;真空度较低时,较多的空气可能有一定量的FePO4生成,同样影响LiFePO4的纯度及电化学性能,因此,从对设备技术要求及节能等因素综合考虑,真空度控制在10-1~10 Pa为宜。
3 结论
正交实验及二次优化实验结果表明:真空碳热还原法合成LiFePO4工艺参数因素对材料电化学性能影响的大小顺序为:反应温度>原料配比>反应时间>真空度>升温速率;反应温度控制在600~650℃时所合成的LiFePO4材料的晶体结构和电性能较好;原料LiOH、Fe2O3、P2O5和活性炭比例为1.05∶1∶1∶1.8,反应时间为12~18 h,真空度控制在10-1~10 Pa时,所得LiFePO4材料的综合电化学性能较好。
[1]YAMADA A,HOSOYA M,CHUNG S C,et al.Olivine-type cathodes:Achievements and problems[J].Journal of Power Sources,2003,119-121:232-238.
[2]刘旭恒,赵中伟,李洪桂.锂离子蓄电池正极材料LiFePO4的改性研究[J].电源技术,2008,32(5):296-298.
[3]李军,赖桂棠,黄慧民,等.高比能LiFePO4的制备及性能研究[J].电化学,2007,13(4):403-406.
[4]YAMADA A,CHUNG S,HINOKUMA K.Optimized LiFePO4for lithium battery bathodes[J].J Electrochem Soc,2001,148(3):A224-A229.
[5]ANDERSSON A,THOMAS J O S.The source of first-cycle capacity loss in LiFePO4[J].J Power Sources,2001,97-98:498-502.
[6]FRANGER S,LE C F,BOURBON C.Comparison between different LiFePO4synthesis routes and their influence on its physicochemical properties[J].J Power Sources,2003,119-121:252-257.
[7]熊学,戴永年,易惠华,等.合成条件对LiFePO4正极材料性能的影响[J].电池,2008,38(2):67-69.
[8]CHEN Z H,DAHN J R.Reducing carbon in LiFePO4/C composite electrodes to maximize specific energy,volumetric energy and tap density[J].J Electrochem Soc,2002,149(9):A1184-A1189.
[9]李冰,王殿龙.蜂窝结构球形LiFePO4/C的制备及性能[J].电池,2008,37(6):422-424.
[10]SHIGEHISA T,YOSUKE I,KAZUYOSHI U,et al.Enhanced electrochemical performance of LiFePO4prepared by hydrothermal reaction[J].Solid State Ionics,2004,175:287-290.
[11]张俊玲.水热合成磷酸铁锂粉体的形貌控制[J].化工新型材料,2008,36(6):74-76.
[12]BEWLAY S L,KONSTANTINOV K,WANG G X,et al.Conductivity improvements to spray-produced LiFePO4by addition of a carbon source[J].Materials Letters,2004,58(1):1788-1791.

