枯草芽孢杆菌诱变株发酵羽毛工艺条件的研究
吉林工商学院 张 昕
禽类羽毛中含75%~85%的硬质角蛋白,羽毛角蛋白中的氨基酸大部分为疏水性氨基酸,其中胱氨酸二硫键很难被蛋白质水解酶打开,使羽毛角蛋白性质极其稳定,在稀酸、稀碱溶液中不易水解,如果仅靠动物自身消化道中的消化酶基本上无法将其消化吸收。因此,要利用家禽羽毛作饲料,必须经过一定的处理。目前国内外现有的羽毛加工方法有:酸(碱)水解法、高温高压水解法、膨化法、酶法。现有的物理、化学加工方法效果不理想,直接加入酶制剂的方法成本太高。生物发酵技术现在处于研究阶段,在生产实际中的应用鲜见报道(蔡成岗和郑晓冬,2006;吴小伦等,2001)。因此,笔者通过多年研究,对枯草芽孢杆菌进行紫外线和亚硝酸钠复合诱变,筛选出产角蛋白酶活力强的诱变菌株FUN 30.2,本试验优化了发酵培养基和发酵工艺条件,为工业发酵生产生物降解羽毛粉提供科学依据。
1 材料
1.1 菌种 枯草芽孢杆菌紫外线和亚硝酸钠复合诱变菌株FUN 30.2(实验室保留的诱变种)。
1.2 培养基 优化羽毛粉培养基成分:羽毛粉5.5%,青贮玉米秸秆粉0.8%,K+浓度0.018 mol/L,Mg2+浓度 0.065 mol/L,Ca2+浓度 0.072 mol/L,Fe2+浓度 0.010 mol/L,Na+浓度 0.088 mol/L。 pH:7.0 ~8.0。
2 试验方法
2.1 菌种培养及酶活力测定方法
2.1.1 菌种培养方法 培养18 h的斜面菌种转接到50 mL牛肉膏-蛋白胨液体培养基中,(36±1)℃培养 18 h。
2.1.2 酶活力测定方法 发酵液过滤离心后,取其上清液 1 mL,加 2 mL Tris-HCl buffer(50 mmol/L Tris-HCI,pH 8.0),然后加入 10 mg 羽毛粉,置于40℃水浴保温振荡反应6 h,然后加入2 mL 10%TCA终止反应。30 min后,4℃离心15 min,离心机转速为8000 r/min,上清液于280 nm处测定OD值。对照试验先加TCA终止液,其他试验过程同上(张寒俊等,2004)。
酶活力定义为:以试验组与对照组在280 nm处测定的吸光度OD值的差值表示,吸光度值每增加1所需的酶量为1 U。
羽毛角蛋白降解率=(加入羽毛粉干重-发酵后滤渣干重)/加入羽毛粉干重×100%。
2.2 培养基优化试验设计 选择对微生物生长繁殖及产酶有影响的7因素16水平,以菌体产生的角蛋白酶 活力为响应值,Fe2+、Na+、K+、Mg2+、Ca2+、青贮玉米秸秆粉和羽毛粉加入量为因变量,对培养基成分进行优化,采用U*16(1610)使用表设计和安排试验。
三角瓶中装液量150 mL/500 mL,接种量5%, 摇床转数 150 r/min,(36±1)℃恒温摇床培养48 h,取上清液过滤离心,离心机转速为8000 r/min,4℃离心15 min取上清液测定酶活力。
2.3 菌株发酵及产酶条件的优化试验 通过测定不同发酵条件下枯草芽孢杆菌诱变种产酶的酶活力来优化发酵条件,为工业化生产生物降解羽毛粉提供工艺参数。
2.3.1 发酵温度的优化 配制均匀设计的优化羽毛粉培养基,分别在设定温度的摇床里进行发酵,其他发酵条件为,培养基装液量150 mL/500 mL、摇床转速150 r/min发酵48 h,接种量为5%(V/V),发酵结束后分别测定酶活力。
2.3.2 接种量的优化 分别以设定的接种量,在优化的温度下发酵48 h后测定酶活力。
2.3.3 摇床转速的优化 设定不同的摇床转速,在上面试验中确定的温度和接种量条件下进行发酵,发酵48 h结束后分别测定酶活力。
2.3.4 发酵液装液量的优化 分别设定发酵液的装液量,在前面试验确定的条件下发酵48 h,发酵结束后测定酶活力。
2.3.5 发酵液初始pH值的优化 初始pH值对菌体生长的影响:配制完全培养基,把培养基的pH 值分别调到 5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0。其他发酵条件为优化后的条件,24 h发酵结束后,培养液用无菌生理盐水稀释10倍,于660 nm测定吸光度值。
初始pH值对菌体产酶的影响:配制均匀设计优化羽毛粉培养基,把培养基的pH值分别调到 5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0。 其他发酵条件为优化后的条件,48 h发酵结束后分别测定酶活力。
2.3.6 培养时间的优化 培养时间对菌体细胞生长的影响:配制优化羽毛粉培养基,设定不同培养时间,每隔6 h测定一瓶发酵液中活细胞数。
培养时间对菌体产酶的影响:配制优化羽毛粉培养基,设定不同培养时间,每隔6 h测定一瓶发酵液的酶活力及羽毛降解率。
3 结果与分析
3.1 显微镜观察结果 见图1和图2。

图1 显微镜下观察未降解羽毛粉

图2 显微镜下观察已降解羽毛粉
3.2 培养基优化试验结果 见表1。
由表1可见,条件(6)菌体产生的角蛋白酶活力高达1.117 U/mL,所以选择优化羽毛粉培养基成分配比为:羽毛粉5.5%,青贮玉米秸秆粉0.8%,K+浓度 0.018 mol/L,Mg2+浓度 0.065 mol/L,Ca2+浓度 0.072 mol/L,Fe2+浓度 0.010 mol/L,Na+浓度0.088 mol/L。在优化培养基之前,测定菌体角蛋白酶活力为0.889 U/mL;培养基优化后,菌体产酶活力提高了25.65%。

表1 各因素水平的角蛋白酶活力测定结果
3.3 菌株发酵及产酶条件的优化试验结果

图3 发酵温度对菌体产酶活力的影响
3.3.1 发酵温度的优化 见图3。由图3可见,温度为27~33℃时,随着温度的升高,酶活力明显提高,超过33℃以后,随着温度的升高酶活力下降。FUN 30.2菌株在33℃发酵,酶活最高达到了1.121 U/mL。因此选择最佳发酵温度为33℃。比诱变前菌体生长的适宜温度略低。
3.3.2 接种量的优化 见图4。

图4 接种量对发酵过程中酶活力的影响
由图4可见,接种量对菌体降解角蛋白的能力影响不大,适当增加接菌量,可以缩短发酵的适应期,减少杂菌污染的几率。接种量从2%增加到6%,酶活力呈上升趋势,接种量从6%增加到9%,酶活力变化不明显,因此确定接种量为6%。
3.3.3 摇床转速的优化 见图5。

图5 摇床转速对菌体产酶活力的影响
由图5可见,摇床转速直接影响发酵液中的溶氧,摇床转速从90 r/min升到170 r/min,酶活力随着摇床转速的升高而明显增加,超过170 r/min后,酶活力变化不大。确定摇床转速170 r/min。
3.3.4 发酵液装液量的优化 见图6。

图6 装液量对发酵过程中酶活力的影响
由图6可见,装液量加大,发酵液的酶活力明显降低。装液较多影响了发酵液中的溶氧,从而影响菌体的正常生长。装液量在100 mL时,发酵液酶活力最大。最大值为1.163 U/mL,确定最适合的装液量为100 mL/500 mL。
3.3.5 发酵液初始pH值的优化
3.3.5.1 初始pH值对菌体生长的影响:见图7。
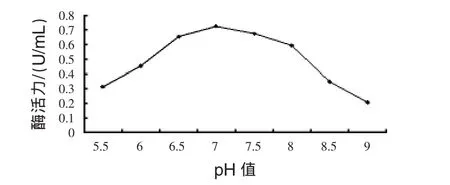
图7 发酵液初始pH值对菌体生长的影响
由图7可见,菌体生长适宜的培养基初始pH值范围是6.5~7.5,最适pH值为7.0。
3.3.5.2 初始pH值对菌体产酶的影响:见图8。

图8 发酵液初始pH值对菌体产酶活力的影响
由图8可见,pH值为5.5~7.5时,酶活力迅速增大,pH值为7.5时酶活力达到高峰,pH值大于8.0时,酶活力逐渐下降,选择菌体产酶的发酵液最适宜pH值为7.5~8.0。
3.3.6 培养时间的优化 见图9。

图9 发酵液中的活细胞生长曲线
由图9可见,培养时间对菌体细胞生长的影响:培养时间0~18 h,菌体处于适应期,培养时间18~36 h,菌体处于对数期,培养时间36~54 h,菌体处于稳定期,培养时间54 h后,菌体处于衰亡期。从菌体的生长曲线分析,在以羽毛和玉米秸秆为碳、氮源的培养基中,菌体的适应期较长,可能是细胞进行代谢的调整,包括诱导酶的产生,据资料报道,角蛋白酶是诱导酶,这可能与菌体的适应期较长有关。
培养时间对菌体细胞产酶活力的影响:由图10可见,每隔6 h测定一瓶优化羽毛粉发酵液的酶活力及羽毛降解率。发酵时间从0~60 h,菌体的酶活力不断上升,其中24~60 h菌体酶活力的提高较快,60 h菌体酶活力最高达1.267 U/mL;60 h以后酶活力迅速下降,90 h以后酶活力略有回升趋势,可能与菌体生长及发酵液的pH值变化有关。同时,羽毛降解率在持续上升,36~72 h阶段羽毛降解率上升较快,72 h降解率已经达到了69.61%,72 h以后降解率变化不明显。综合分析发酵过程中酶活力和羽毛降解率的变化规律,选择最佳发酵时间为72 h。

图10 发酵时间对酶活力和羽毛降解率的影响
3.4 发酵液氨基酸含量测定 由吉林大学测试中心测定,结果见表2。

表2 羽毛粉发酵液的氨基酸含量测定结果mg/mL
4 结论
4.1 羽毛发酵培养基优化试验结果表明,该菌株最佳羽毛培养基成分配比为:羽毛粉5.5%,青贮玉米秸秆粉 0.8%,K+浓度 0.018 mol/L,Mg2+浓度0.065 mol/L,Ca2+浓 度 0.072 mol/L,Fe2+浓 度0.010 mol/L,Na+浓度 0.088 mol/L。培养基优化后,菌体产酶活力提高了25.65%。
4.2 应用单因子试验设计法对影响菌株发酵过程的发酵条件进行了优化,得到最优的发酵条件为:培养温度33℃,培养时间72 h,摇床转速170 r/min,接种量 6%,装液量 100 mL/500 mL,菌体生长适宜的培养基初始pH值范围是7.0左右,菌体产酶的发酵液最适宜pH值为7.5~8.0。在培养时间因素试验中,发酵液中活细胞数在48 h达到高峰,为3.9×109CFU/mL;60 h菌体产酶活力最高达1.267 U/mL;在发酵时间达到72 h时,羽毛降解率达到了69.61%。
3.5.3 经该菌株发酵,羽毛角蛋白大量转化为氨基酸、短肽和菌体蛋白,发酵液的氨基酸含量高达22.66 mg/mL。
[1]蔡成岗,郑晓冬.角蛋白酶的来源、理化性质与生物工程研究进展[J].食品与发酵工业,2006,32(4):111 ~ 113.
[2]吴小伦,闵航,马晓航.羽毛角蛋白的生物降解 [J].环境污染与防治2001,23(1):66 ~ 68.
[3]张寒俊,刘大川,杨国燕.紫外光谱法定量测定不同种蛋白酶活力的研究[J].粮食与饲料工业,2004,9:44 ~ 45.

