基于碳纳米管修饰石墨电极测定槲皮素
刘登友,罗启枚,王辉宪,周 华
(湖南农业大学理学院应用化学系,湖南长沙410128)
0 引言
槲皮素(Quercetin,Qu)是一种具有多种生物活性的黄酮类化合物,具有很高的药用价值。它具有较好的祛痰止咳平喘作用,还具有降低血压,增强毛细管抵抗力及降血脂的作用,对冠心病及高血压患者也有辅助治疗作用[1],此外还具有抗肿瘤、抗炎、抗衰老等广泛的药理作用[2~4]。目前对槲皮素的测定方法主要有:高效液相色谱法[5~6]、高效毛细管电泳法[7]、紫外光度法[8]、荧光光度法[9]、卡尔曼滤波光度法[10]、极谱法[11]、电化学方法等。
虽然色谱法测定槲皮素应用较广,但该方法繁琐、仪器昂贵、尤其不便现场测试。而电化学方法(尤其是结合化学修饰电极)具有灵敏度高、分析速度快、仪器低廉、操作简便和成本低廉的特性,有望实现对饮料、食品等样品中的槲皮素进行实时在线检测。近年来,电化学在对槲皮素的测定方法研究中备受关注[12~13]。
碳纳米管(CNTs)是1991年发现的一种碳的新型结构,具有明显的量子效应、高的比表面积、高的稳定性、强的吸附特性以及优良的电催化性能等优点,目前已成为化学修饰电极和电化学生物传感器等领域的研究热点[14~15]。
该文首次以石墨为基体,采用化学气相沉积法直接生长于石墨基体上的碳纳米管修饰电极(CNTs/C),对槲皮素进行检测研究,发现该电极制备简单、响应快、能够用于槲皮素的测定。
1 实验部分
1.1 仪器和试剂
760C型电化学工作站 (上海辰化仪器有限公司);MEC-12B型搅拌器 (江苏江分电分析仪器有限公司);测试系统;三电极体系:碳纳米管修饰石墨电极(CNTs/C)为工作电极,饱和的甘汞电极(SCE)为参比电极,铂电极(Pt)为辅助电极。碳纳米管的制备参照文献[16]:利用化学气相沉积法直接生长在以石墨(长 1.7 cm,宽 1.0 cm,高0.5 cm)为基体上;槲皮素(国药集团化学试剂有限公司):用无水乙醇配制成1.0×10-2mol/L的溶液,备用。芦丁(国药集团化学试剂有限公司)、布列顿-罗宾逊广泛缓冲液 (B-R):用正磷酸、乙酸、硼酸、氢氧化钠配制成不同的pH值;实验用水都是二次蒸馏水。
1.2 CNTs/C修饰电极的制备
首先以过渡金属铁作为催化剂,将其电镀在石墨基体上,分别以N2、H2作为稀有气体和保护气体,以化学性质较活泼的含有不饱和键的C2H2作为碳源,使C2H2在高温状态下裂解得到碳纳米管,制备出直接生长于石墨基体上的碳纳米管。然后将制备好的CNTs依次用30%的硝酸浸泡10 h,用二次蒸馏水清洗,晾干后再用玻璃胶固定在铜导线上,室温干燥,即得碳纳米管修饰石墨(CNTs/C)电极。
1.3 实验方法
实验采用三电极体系,以修饰电极为工作电极,饱和的甘汞电极(SCE)为参比电极,铂电极(Pt)为辅助电极。 以 B-R 缓冲溶液(pH1.81)为支持电解质,采用循环伏安法(CV法,扫速为100 mV/s)对槲皮素的电化学行为进行研究。实验均在室温下进行。
2 结果与讨论
2.1 槲皮素(Qu)在CNTs/C电极上的循环伏安曲线(CV曲线)
槲皮素在CNTs/C电极上的循环伏安曲线(CV)图(图1)。
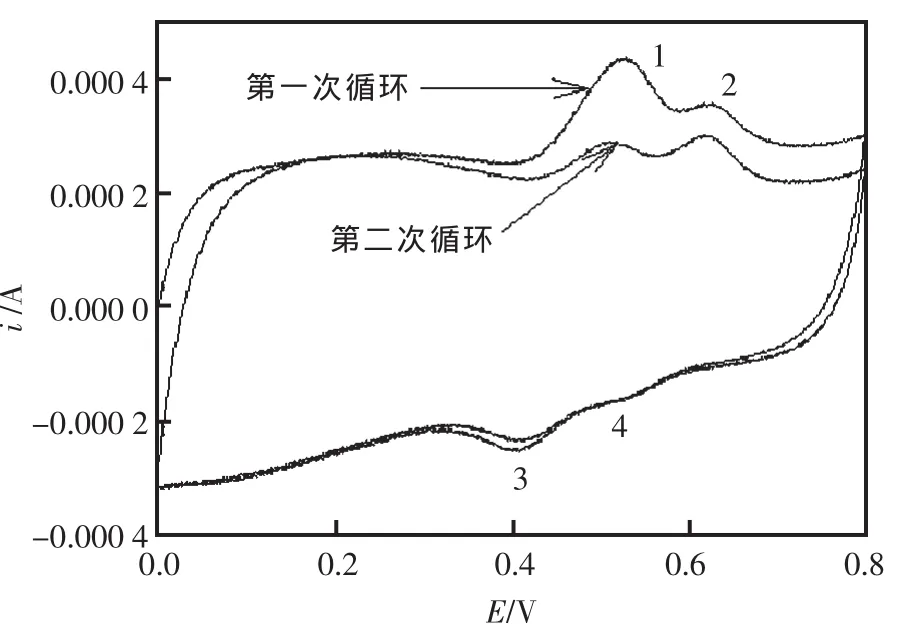
图1 槲皮素在CNTs/C上的CV曲线(循环2次)图Fig.1 Cyclic voltammograms of 0.01mmol/L Qu at CNTs/C(two circles)The scan rate is 100 mV/s; enrichment time is 900 s;pH is 1.81
由图1 可见,第一次循环分别在 0.53 V、0.63 V处呈现了两个氧化峰,峰1和峰2。反向扫描时,在0.47 V处出现了一个较为明显的还原峰3与氧化峰 1对应,ΔE1=60 mV;在 0.56 V 处出现了一个不太明显且峰形较宽的还原峰4与氧化峰2对应,ΔE2=70 mV,显示出可逆反应的性质。氧化峰1的峰形最好、峰电流最大,是槲皮素的主氧化峰。一般认为在槲皮素的5个羟基中,B环上的儿茶酚3,4-双羟基供电子基团具有很高的电活性[17],能够在较低的电势下被氧化并显示较高的峰电流,所以氧化峰1的反应式可能如图2所示。
氧化峰1与还原峰3对应,氧化峰2与还原峰4对应。文献[18]指出,氧化峰2在芦丁的电氧化过程中没有出现,所以应归属于槲皮素的3-羟基的氧化(芦丁的C-3位上是没有电活性的芦丁糖苷,其它结构与槲皮素相同)。
2.2 底液和pH的影响
分 别 以 0.10 mol/L 的 NaC1、NaAc、KNO3、Na2SO4、Na2HPO4-NaH2PO4和B-R为支持电解质,研究其对修饰电极的影响。实验结果表明,在B-R缓冲溶液中,修饰电极具有良好的电化学行为。因此,实验中选择B-R溶液为支持电解质。
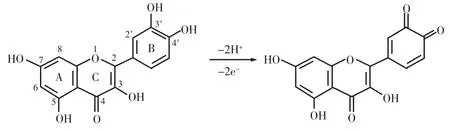
图2 氧化峰1的反应式Fig.2 The oxidation peak 1 of the reaction
考察了介质 pH(1.50~6.80)对该修饰电极电化学行为的影响。实验发现,当体系pH<1.60和pH>2.50时,修饰电极的电化学行为较差,峰电流较小。当pH为1.81左右时,峰电流响应值大且稳定,电极表现出良好的电化学行为。因此,实验选用pH1.81的B-R缓冲溶液。
2.3 扫描速度的影响
用循环伏安法研究了槲皮素与扫描速度的关系。图3是在不同扫描速度下测得的CV曲线。由图可以看出,槲皮素在CNTs/C电极上,氧化峰电流ipa1,ipa2随着扫描速度的增大而增大。当扫描速度较慢时,ipa1<ipa2。并且随着扫描速度的增加,氧化峰1峰电流的增长速度比氧化峰2要快。从图中还可以看出峰电流随扫描速度的增大而线性增加,表明Qu在CNTs/C修饰电极上的氧化过程及电子迁移受到吸附作用的控制。另外,还可以发现,两个氧化峰电位随扫描速度的增大而正移。然而,当扫描速度过高时,基线噪声增大且峰形变差,速度大于400 mV/s时氧化峰2几乎消失,当扫描速度为100 mV/s时,信噪比(S/N)最好,因此,实验选择扫描速度为100 mV/s。
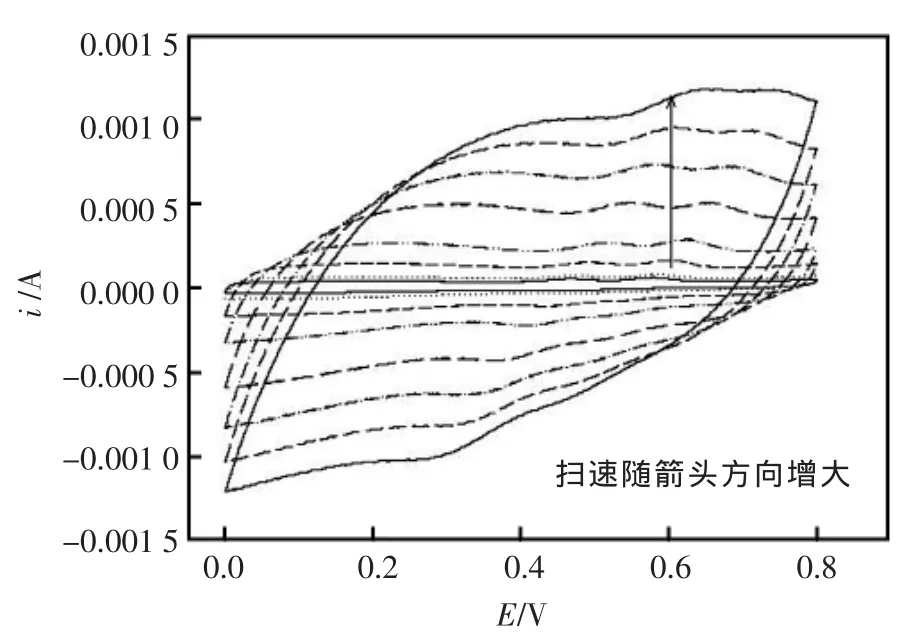
图3 槲皮素的各扫描速度循环伏安曲线图Fig.3 CV curves of 0.01mmol/L Qu at CNTs/C with different scan rates The scan rate is respectively(arrow direction):10,20,50, 100, 200,300,400,500 mV/s
2.4 富集时间的影响
图4是槲皮素在不同富集时间的循环伏安曲线图,由图可以发现,随着富集时间的延长,槲皮素的各个峰电流明显增大。当富集时间从30 s延长至900 s时,峰电流随富集时间的延长在增大,表明碳纳米管具有很大的比表面积,且对槲皮素具有很强的吸附作用。 当富集时间延长到1 800 s时,峰电流基本上与900 s时重合,到3 600 s时,达到吸附平衡。因此,从峰电位差、峰电流、峰形及检测周期长短综合考虑,实验选择富集时间为900 s。
2.5 循环伏安法检测槲皮素
在优化的实验条件下,用循环伏安法考察了5.0×10-8~5.0×10-4mol/L 不同浓度下槲皮素的CV曲线。从图5中可以看出:分别在0.53 V和0.63 V处出现了氧化峰 1和氧化峰 2,在 0.47 V、0.56 V处出现了两个与之相对应的还原峰3和还原峰4。并且随着槲皮素浓度的增大,氧化峰、还原峰的电流不断增大。 在 1.0×10-7~5.0×10-4mol/L之间槲皮素的氧化峰电流与浓度呈线性关系, 线性回归方程为:ipa1=88.977+34.203 c,r2=0.998 0。 检测下限为 1.5×10-8mol/L,可用于槲皮素的微量检测。
2.6 其它共存物质的干扰实验
在最佳体系中研究了一些常见的金属离子和有机物对槲皮素测定的干扰,结果表明,在l×10-2mol/L 的 Zn2+、K+、Ca2+、Cu2+、Fe3+、Na+、Mg2+存在时,其峰电流基本上无变化,因此可以忽略对槲皮素测定的干扰。这可能是由于在阳极施加电压时,上述金属离子不会发生氧化还原反应的原因。在100倍的葡萄糖、蔗糖,10倍的维生素C中,槲皮素的主峰电流只改变了1.99%、1.32%、-1.15%。当10倍的抗坏血酸和尿酸存在时,槲皮素的氧化峰几乎保持不变;但是当1 000倍的抗坏血酸和尿酸存在时,却能让槲皮素的氧化峰消失,这是可能由于抗坏血酸、尿酸在电极上发生了氧化还原作用或吸附作用。在l×10-4mol/L的十二烷基苯磺酸钠、十六烷基三甲基溴化铵和Trinton-X100等对槲皮素的测定产生严重干扰(误差>5%)。当其它黄酮类(如芦丁)存在时,因为它的氧化峰与槲皮素的有部分重叠,所以它严重影响到槲皮素的测定,因此,当它们共存时,在测定前要先进行分离。
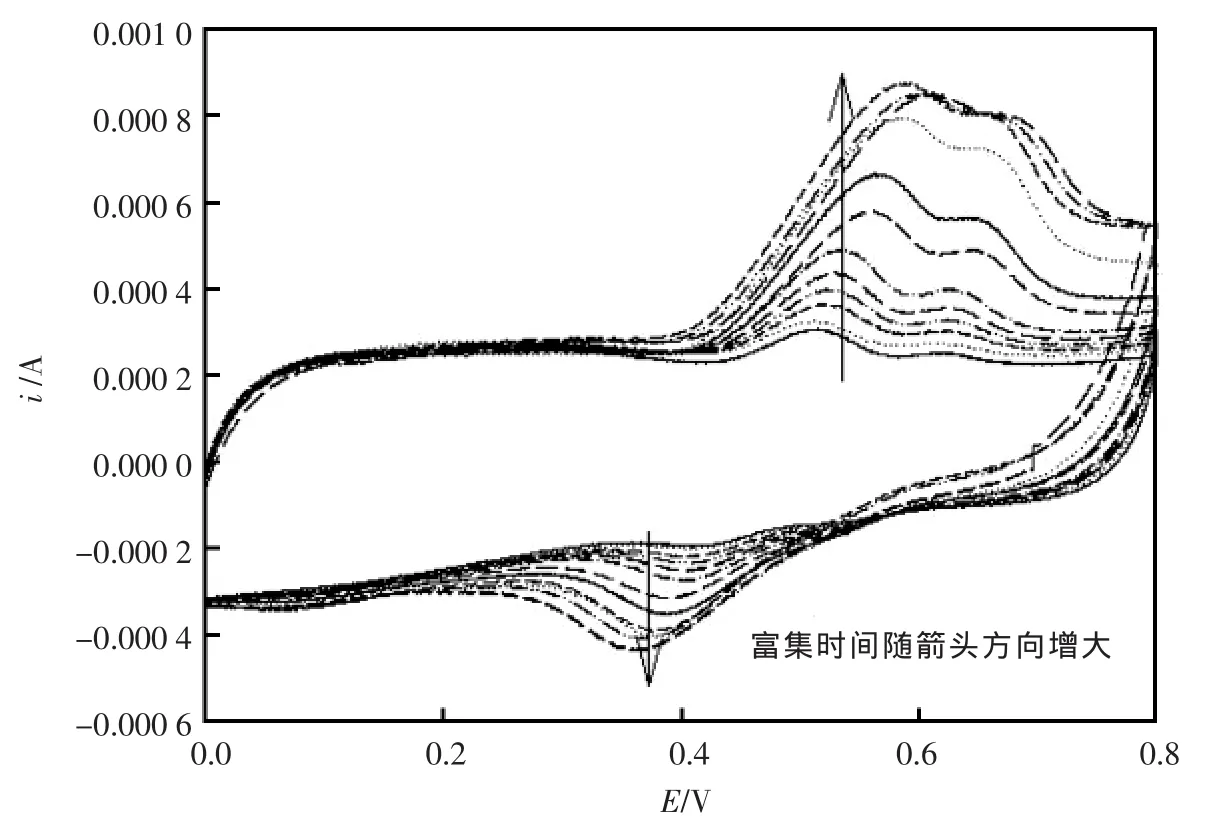
图4 槲皮素各富集时间的循环伏安曲线图Fig.4 CV curves of 0.01mmol/L Qu at CNTs/C with different enrichment time.The scan rate is 100 mV/s.Enrichment time is respectively(arrow direction):30,60,90,120,180,240,300,360,600,900,1 800,3 600 s
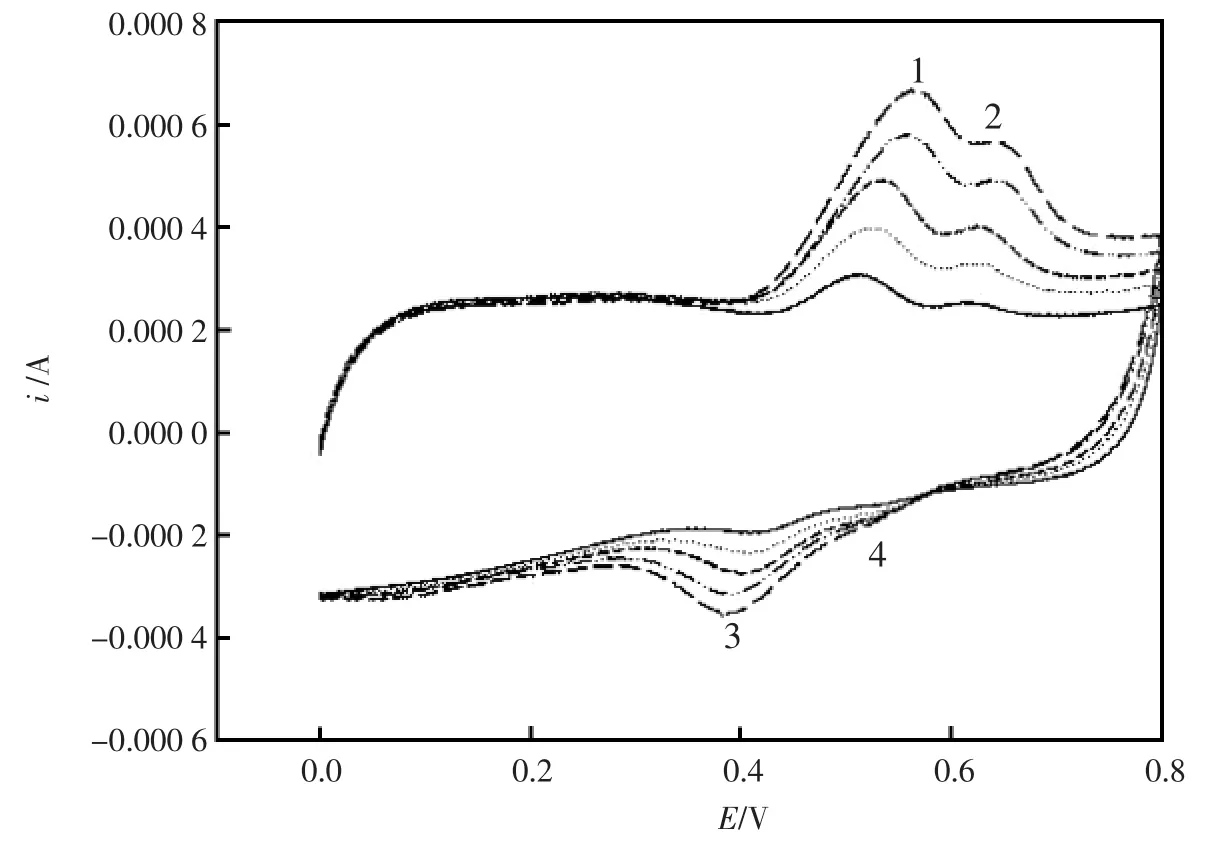
图5 不同浓度下的槲皮素的循环伏安图Fig.5 CV curves of Qu at CNTs/C in different concentrations.The scan rate is 100 mV/s.The B-R pH(1.81).c(Qu)(from inner to outer):1.0×10-6,5.0×10-6,1.0×10-5,5.0×10-5,1.0×10-4mol/L
2.7 电极的再生和重现性
每测定槲皮素后,对CNTs/C电极进行表面再生,以消除电极的表面记忆,方法如下:将电极于 0.1mol/L KOH 溶液中,在-0.3~0.8 V 间循环扫描2~3圈,用二次蒸馏水洗净,再将CNTs/C电极置于 pH=1.81 的 B-R 缓冲液中, 在-0.3~0.8 V间循环扫描2~3圈,使修饰电极得以活化,用于下一次测定。例如,在最佳实验条件下,对1.0×10-5mol/L的槲皮素采用循环伏安法测定10次,每次测定后再生,峰电流的相对标准偏差(RSD)为 1.9%。
在最佳实验条件下,运用循环伏安法对1.0×10-5mol/L槲皮素进行测定,一天中每隔3 h测一次,峰电流的相对标准偏差(RSD)为 2.3%(n=5),峰电位则基本稳定。将电极从溶液中取出,再生活化后,用二次蒸馏水洗涤,在干燥器中放置10 d,然后重新活化进行循环伏安扫描,RSD为2.6%。表明CNTs/C电极有很好的稳定性和重现性。
2.8 芦丁水解样品分析及回收实验
称取0.001 3 g芦丁于小烧杯中,用20mL无水乙醇溶解,转移至50mL容量瓶中,加入15mL 6%的HCl,超声2 h后,冷却至室温,再加入无水乙醇定容。
分别移取1.0mL芦丁水解产物,加入含有20.0mL的B-R缓冲液的电解池中,在最佳实验条件下进行测定(n=4),将氧化峰电流的平均值ipa=5.043×10-4A带入线性回归方程,得到芦丁的水解产物槲皮素的浓度为1.07×10-5mol/L。用标准加入法,加入一定量的槲皮素标准液(浓度为1.0×10-2mol/L)100 μL,150μL,计算添加回收率。结果见表1。
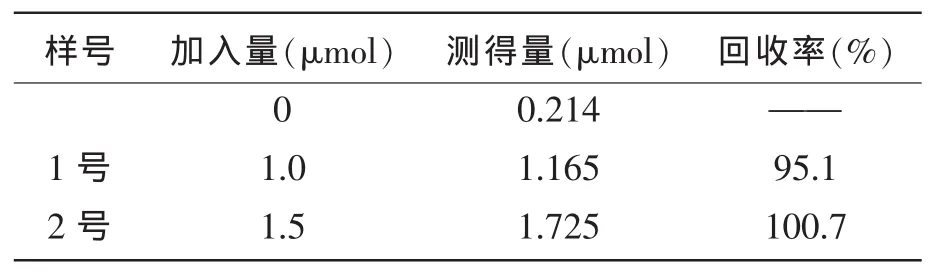
表1 芦丁水解产物中槲皮素的测定(n=4)Tab.1 DeterminationofhydrolyzaterutinofQu
3 结论
该电极由于碳纳米管是直接生长在石墨基体上的,无需粘结剂,比间接法制备的CNTs/C电极上滴涂的碳纳米管粉末要稳定得多,而且价廉、可批量生产,能多次反复用于槲皮素的检测研究。测定过程操作简单,方法灵敏准确。
[1]Mvaria W.Polyphenolic compounds from sedum aizoon[J].Acta Pol,Pharm, 1996 ,53(3):2 251.
[2]Manach C,Morand C,Crespy V,et a1.Quercetin is recovered in human plasma as conjugated derivatives which retain antioxidant properties[J].FEBS Lett,l998,426:331~336.
[3]Verma A K,Johnson J A,Gould M N,et a1.Inhibition of 7,12-dimethylbenz(a)anthracene-and N-nitrosomethylurea-induced rat mammary cancer by dietary flavonol quereetin[J].Cancer Res,1988,48:5 754~5 758.
[4]Rauha J P,Remes S, Heinonen M,et a1.Antimicrobial effects of finnish plant extracts containing flavonoids and other phenolic compounds[J].Int J Food Microbiol,2000,56:3~12.
[5]董文庚,邓晓丽,苗凤智.HPLC法测定银杏叶中黄酮的含量[J].理化检验-化学分册,2005,41(8):563~565.
[6]胡秋芬,杨光宇,黄章杰,等.微柱高效液相色谱法测定金银花中的多酚类物质[J].分析化学,2005,33(1):69~72.
[7]张兰,刘远环,何聿,等.毛细管电泳-电化学检测法用于中药石韦中绿原酸和槲皮素的同时测定[J].分析测试技术与仪器,2005,11(1):22~27.
[8]周含英,周方钦,白祖海,等.分光光度法测定中草药中槲皮素[J].光谱实验室,2004,21(2):293~295.
[9]姚本林,时小波.槲皮素铝的络合反应及槲皮素的荧光光度测定[J].理化检验-化学分册,2002,38(4):186~187.
[10]王丽琴,党高潮,顾莹.卡尔曼滤波光度法同时测定槐米中芦丁和槲皮素[J].药物分析杂志,2000,20(1):60.
[11]刘进邦,孟昭仁.示波极谱滴定法测定芦丁中总槲皮素含量[J].分析科学学报,2006,22(5):617~618.
[12]Brett AMO Ghica ME.Electrochemical oxidation of quercetin[J].Electroanalysis,2003, 15:1 745~1 750.
[13]Jin G P,He J B,Rui Z B,et al.Electrochemical behavior and adsorptive stripping voltammetric determination of quercetin at multi-wall carbon nanotubes-modified paraffin-impregnated graphite disk electrode[J].Electrochimica Acta,2006,51:4 341~4 346.
[14]Lijima S.Helical microtules of graphite carbon[J].Nature,1991,354(6348):56~58.
[15]Kong J,Franklin N R,Zhou C W,et al.Nanotube molecular wires as chemicai sensors[J].Science,2000,287:622.
[16]Liu D Y,Chen J H,Deng W,et al.Simple catalyst for the direct growth of carbon nanotubes onto substrate by chemical vapor deposition.Mater Letter[J].Mater Letter, 2004,58: 2 764~2 767.
[17]Xiao P,Zhao F Q ,Zeng B Z.Voltammetric determination of quercetin at a multi-walled carbon nanotubes paste electrode[J].Microchemical Journal,2007,85:244~249.
[18]Ghica M E,Brett A M O.Electrochemical oxidation of rutin[J].Electroanalysis,2005, 17:313~318.

