胰腺侵袭性纤维瘤的诊断和治疗策略(附3例报告)
陈景熙 陈福真 李滨 苏旭 李志民 庄严阵 付莉
(厦门大学附属厦门第一医院肝胆胰血管外科,*病理科,福建 厦门 361003)
胰腺肿瘤有多种病理类型,其临床症状大多相近,影像学表现也多有相似之处,这使胰腺肿瘤的确切诊断相当困难;而诊断不明常给治疗方式的选择带来困难,进而给患者带来不必要的伤害。笔者报告3例胰腺侵袭性纤维瘤病例的诊治经过,以此提高对胰腺少见肿瘤诊治的认识。
1 临床资料
病例1,男性,36岁,因“右上腹持续性胀痛1个多月。”于2004年12月6日入院。2个月前在外院诊断“胰腺肿瘤”,行剖腹探查,见肿物位于右上腹,不能切除,行胃空肠及胆囊空肠吻合术,并行活检,病理报告为胰腺纤维组织增生性病变。本院B超检查示胰头下方9 cm×8 cm的囊实性混合型肿块,内部可见不规则液性暗区及多发条索状分隔。腹部CT提示(图1-1)十二指肠降部内侧囊实性肿块,与胰头相贴,增强后实质部分呈部分中度强化。CT及临床均诊断“胰头癌”。于2004年12月14日再次手术,术中可见肿瘤位于十二指肠降部内侧,约8 cm×9 cm×10 cm大小,外侧浸润升结肠,上界为肝脏面及胃窦部,下极为横结肠系膜,底部为胰头,行肿瘤切除、胰十二指肠切除及右半结肠切除术。病理检查报告:十二指肠黏膜外可见肿物,大小10 cm×9 cm×8 cm,切面灰白色,质地中等,有多个囊腔,似有包膜与胰腺相连。镜下见肿瘤组织为纤维母细胞和肌纤维母细胞,未见核分裂,无纤维包膜形成,考虑胰腺侵袭性纤维瘤。CD34(-),Actin(+)。患者术后恢复好,随访至今患者已参加工作,复查腹部CT无复发。
病例2,男性,42岁,因“右侧腹部闷胀不适1个多月”于2006年2月入院。查体无明显异常。腹部B超:胰头囊实性占位,大小约6.3 cm×5.6 cm×7.2 cm,边界不清,内见强回声斑聚集,主胰管呈串珠样扩张。腹部CT(图1-2)提示胰头囊实性占位,6 cm×8 cm大小,增强期强化明显,内可见钙化。考虑肿块型胰腺炎可能,癌症不能排除。临床诊断胰头占位,慢性胰腺炎可能。2006年2月4日施行胰十二指肠切除术,术中见胰头区1个长约5.5 cm的肿物,形状不规则,质地韧,部分与腹膜后肌肉粘连。切除肿物冷冻病理报告为慢性炎症伴有纤维组织增生及钙化灶。术后病理报告:胰腺切面6.8×6.2 cm的肿物,切面灰白,可见0.7~3.1 cm大小的囊腔,部分区域钙化,肠壁淋巴结及胆囊旁淋巴结肿大。镜下见胰腺-十二指肠侵袭性纤维瘤病(深部纤维瘤病),肿瘤浸润胰腺及十二指肠肌层,伴有慢性炎性反应及钙化。区域淋巴结反应性增生。免疫组化:CD117(-),Des(-),B-catenin(+++),Actin(+),支持上述诊断。患者术后恢复良好,随访至今无复发。
病例3,女性,20岁,因后腹膜肿瘤在外院行剖腹探查发现为胰头肿物,约17 cm×12 cm×10 cm大小,与肠系膜上动静脉明显粘连,无法切除,取肿物及肠系膜淋巴结活检,病理诊断胰头肿物为纤维结缔组织,肠系膜淋巴结为反应性增生,为进一步治疗于2008年3月1日入我院。查体:腹部可扪及17 cm×12 cm×10 cm的肿物,质地韧,边界不清,有压痛。腹部CT提示(图1-3)上腹部(胰头)囊实性肿块,大小119 mm×59 mm,实性占位49 mm×57 mm,液性占位 48 mm×58 mm,来源于胰腺。考虑为胰腺囊腺癌可能。术前诊断为胰头肿物,囊腺癌可能。于2008年3月6日行胰腺肿物切除术。术中冷冻病理提示慢性炎症纤维化组织增生。术后病理报告为胰腺侵袭性纤维瘤;免疫组化:Actin(+)。术后患者恢复情况正常。目前在随访中,尚无复发。
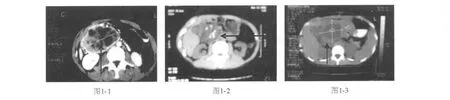
图1 胰腺侵袭性纤维瘤计算机体层成像图像
2 讨 论
2.1 概述 侵袭性纤维瘤病于1832年由Farlane首先报道,1838年Muller首次命名为韧带瘤,系临床少见肿瘤。一般认为其起源于肢体和韧带的肌筋膜结构,可累及骨骼、心肌、肺和胃肠道平滑肌等。根据发病部位分为:(1)表浅或筋膜纤维瘤病,包括手掌、足跖纤维瘤病、阴茎纤维瘤病及婴儿指、跖纤维瘤病。(2)深部纤维瘤病,包括腹壁纤维瘤病、腹壁外纤维瘤病、腹腔和肠系膜纤维瘤病和婴儿纤维瘤病。发生于腹部的侵袭性纤维瘤病可发生在腹壁(50%)、肠系膜(41%)和腹膜后(9%)[1-2]。其中发生于腹腔实质脏器者临床上少见,发生于胰腺的侵袭性纤维瘤更为罕见。其病因目前尚不明确,多认为与物理、遗传及内分泌等因素相关,外伤可能为较明显的诱发因素。约有10%家族性腺瘤样息肉患者同时伴发本病。Hyodo等[3]认为病变与表皮生长因子水平升高有关,也有报道[4]认为与β链蛋白基因突变有关。胰腺侵袭性纤维瘤病系少见的胰腺肿瘤,临床上罕见,常被误诊为胰腺癌,国内尚无报告。胰腺侵袭性纤维瘤又称胰腺良性非上皮性纤维瘤(begign nonepithelial fibroma in pancreas)[5],是一种发生于胰腺的富于胶原纤维成分的纤维组织肿瘤,组织形态良性,但是呈缓慢的浸润性生长,生物学行为介于良性的纤维性疾病和纤维肉瘤之间。
2.2 临床诊断及鉴别诊断 侵袭性纤维瘤病临床上罕见,每年新发病例3~4例/100万人,通常见于25~45岁的成人(70%),少数发生于婴儿及儿童[2]。发生于胰腺的侵袭性纤维瘤病因肿块位置深在,生长缓慢,早期可无症状,随着肿瘤增大或者累及相应脏器则可出现相应症状,临床上常不易识别,易被误诊为慢性胰腺炎或者胰腺癌。本组3例均未考虑胰腺侵袭性纤维瘤的诊断。影像学检查一般可以清晰的显示肿块的部位及范围,但常不能完全确定病变性质。本组3例患者均有腹部包块或者腹部闷胀,病例1术前CT诊断胰头癌可能性大,但B超可见肿块内多发分隔;病例2术前CT考虑胰头癌可能,但临床上考虑胰腺炎可能性大,因有胰腺纤维化样改变,伴有钙化;病例3则诊断胰腺囊腺癌可能。以上3例患者的CT或B超影像学均表现为:(1)肿块为囊实性,常伴有分隔或者钙化,有较明显强化。(2)胰腺组织表现为类似慢性胰腺炎改变。胰腺癌常为实性包块,在CT上表现低密度病灶,强化不明显,胰头癌病灶通常出现双管征。而胰腺囊腺癌病例亦可有分隔及钙化,但一般无胰腺纤维化改变。此2项影像学特征可为临床上诊断胰腺侵袭性纤维瘤提供帮助,亦可为其与胰腺癌或胰腺囊腺癌鉴别提供参考。因胰腺侵袭性纤维瘤和胰腺其他肿瘤的治疗方式明显不同,特别是胰头癌和胰头侵袭性纤维瘤,前者常规行胰十二指肠切除术,后者则可能行局部切除术,所以临床上应注意排除存在侵袭性纤维瘤的可能,上述影像学特点应在临床诊断时应引起重视。当然本病诊断主要依靠病理。有报道[6]细针穿刺检查能作出迅速而可靠的诊断。但因为肿瘤位置深在,穿刺困难,而且常有假阴性结果。其典型的病理形态为肿物通常较大,质地硬,境界不清楚,无包膜,切面呈灰白色,光镜下见纤维母细胞增生明显,其间胶原纤维丰富,其细胞中心和胶原周围有分化良好的成纤维细胞和肌成纤维细胞组成,缺乏恶性的细胞学特征和有丝分裂相。在病变边缘,常见有淋巴细胞浸润血管周围,可有钙化。多处切片即可显示本病的典型病理形态,免疫组化和电镜示丰富的胶原网包绕多形细胞增生,波形蛋白和肌动蛋白阳性。据此可与纤维肉瘤鉴别。
2.3 治疗及预后 完整的手术切除术是治疗胰腺侵袭性纤维瘤唯一有效的方法。手术时要注意切除的广度和深度。Plukker[7]认为至少3 cm的手术安全边缘才有可能免于复发。Rao[8]则认为大于5 cm的完整切除是不现实的。术中可以通过冷冻切片来明确手术范围以获得完整的切除。我们认为根据肿瘤的部位及范围采取相应的手术方式:肿瘤如果局限且位于胰腺表面,则可行局部肿瘤切除术,如例3就行局部肿瘤切除术;如局限于胰腺体尾部则可考虑行肿瘤及胰腺体尾部切除术;如肿瘤局限于胰头且范围较大,则可行胰十二指肠切除术,例2就施行胰十二指肠切除术,例1肿瘤侵犯右侧结肠,故而一并行右半结肠切除。近年来保留十二指肠的胰头肿瘤切除得到不断推广(主要术式为Beger式及改良术式),其手术并发症发生率低,体现一定的优越性。如能明确本病的诊断,侵袭性纤维瘤可以在手术中尽量保留器官和控制损伤,避免过多的施行胰十二指肠切除术,以减轻患者的创伤与心理压力。
对于姑息切除者或者侵犯重要脏器无法切除者可试用放化疗或者生物治疗(化疗可选用长春花碱、甲氨蝶呤和阿霉素等;部分肿块雌激素受体阳性,可选用他莫昔芬等药物治疗)。有报道放疗可能导致局部恶变,需引起重视。本病预后相对较好,主要问题是局部复发,并且随着复发次数的增加而侵袭性更强,一般无远处转移。一旦发现复发,应尽早处理,如复发病变范围不大者,能再次完整切除依然可获得治愈。本组病例均获得完整切除,随访例1至今已存活63个月,例2及例3分别已存活49个月及24个月,均未发现复发,预后明显优于胰头癌。
总之,胰腺侵袭性纤维瘤病系胰腺罕见的肿瘤,临床上对于影像学符合上述特征的胰腺肿瘤病例需要警惕本病。术中冷冻病理及与有经验的病理科医师沟通是明确诊断的关键。完整的手术切除是治疗本病的唯一方法。术式的选择与肿瘤的部位及大小有关。通过完整切除肿瘤,本病预后相对乐观。
1 Einstein DM,T agliabue JR,Desai RK,et al.Abdominal desmoids:CT findings in 25 patients[J].Am J Roentgenol,1991,157:275.
2 王坤,尹望平.腹壁外侵袭性纤维瘤病的手术治疗[J].中国临床医学,2007,14(2):265-266.
3 Hy odo M,Yumoto E,Wakisaka H,et al.Gastric scirrhous carcinoma as a rare cause of gg ressive bromatosis in the neck[J].Am J Otolaryngol,2001,22(1):38-42.
4 Saito T,Oda Y,Kawaguchik M,et al.Possible association between higher beta-catenin mRNA expression and mutated betacatenin in sporadic desmoid tumors:real-time semiquantitative assayassay by TaqMan polymerage chain reation[J].Lab Invest,2002,82(1):97-103.
5 Michito M,Kohji M,Kentaro M,et al.Benign nonepithelial fibroma in the pancreas.[J].Hepathobiliary Pacreat Surg,2002,9:646-649.
6 Kurtycz DF,Logrono R,Hoerl HD,et al.Diagnosis of fibromatosis coil by fine-needle aspiration[J].Diagn Cytopahtol,2000,23(5):338-342.
7 Plukker JT,Van Oort I,Vermey A,et al.Aggressive fibromatosis(non-familial desmoid tumour):therapeutic problems and the rile of adjuvant radiotherapy[J].Br J Surg,1995,82(4):510-514.
8 Rao BN,Horowitz ME,Parham DM,et al.Challenges in the treatment of childhood fibromatosis[J].Arch Surg,1987,122(11):1296-1298.

