DMN诱导的肝纤维化模型伴肾损害的实验观察
胡志峰,李 忻,何 燕,李 平△,肖 诚,潘 琳,郭景珍,张浩军,路晓光,杨 鑫,张 韫
(1.中日友好医院临床医学研究所,北京 100029;2.江西中医学院,江西南昌 330006)
中医学认为“肝肾同源”、“肝肾互补”,肝肾两脏关系至为密切,但相关的物质基础目前尚不清楚。为了深入研究“肝肾同源”的病理生理机制,我们首次建立了二甲基亚硝胺(DMN)诱导的大鼠肝纤维化伴肾损伤复合动物模型。DMN具有明确的致肝纤维化作用,但是在肾损伤中的研究国内还未见报道。本实验旨在研究复合动物模型的同时,探讨肝肾相关的可能物质基础,为指导临床治疗提供科学的实验依据。
1 材料与方法
1.1 动物
雄性SD大鼠16只,SPF级,体重80g±10g,购自北京维通利华实验动物技术有限公司,动物合格证号SCXK(京)2002-0003号。
1.2 药物与试剂
DMN购自日本东京化成工业株式会社。透明质酸(hyaluronicacid,HA)、层黏连蛋白(laminin,LN)和Ⅳ型胶原(Ⅳ-C)检测试剂盒购自北方生物技术研究所。
1.3 仪器
全自动生化分析仪(美国CD-1600);BFG0152型放射免疫λ计数仪(北京核仪厂);滑走式切片机(日本SAKURA公司);显微镜(日本OLYMPUS公司);Image Pro Plus(IPP)Version 5.0图像分析软件。
1.4 分组及模型制备
将动物随机分为2组,正常组、模型组各8只。参照金树根等[1]的方法,DMN用生理盐水稀释成0.5%的浓度,以2 ml/kg的用量腹腔注射,每日1次,每周2次,共4周。正常组给予等剂量的生理盐水腹腔注射。实验结束用3.5%的水合氯醛腹腔注射麻醉大鼠,腹主动脉取血,离心获得血清待测;取大鼠肝、肾组织,4%中性多聚甲醛缓冲液固定备用。
1.5 检查项目
全自动生化仪检测血清AST、ALT、BUN、SCr含量,放免试剂盒检测纤维化指标HA、LN和Ⅳ-C水平。
1.6 病理染色
肝、肾组织经4%多聚甲醛缓冲液固定,石蜡包埋,制备成4μm厚度切片。肝脏做HE、MASSON、天狼星红染色,肾脏做HE、PAS、天狼星红染色。采用IPP5.0软件对肝肾天狼星红染色的图像分析定量。
1.7 免疫组化
肝、肾组织石蜡切片,用Envision二步法检测TGF-β1、α-SMA的分布与表达,采用 IPP5.0软件对图像分析定量。
1.8 图像分析
显色结果采用IPP5.0图像分析软件,肾组织TGF-β1免疫组化染色每个切片随机取10个肾小球,图像放大400倍,测量阳性表达和肾小球面积,计算其比值并取平均值[2]。其他图像分析指标每张切片随机取5个视野,图像放大200倍,测量阳性染色面积,取平均值并计算其占视野面积的百分数。
1.9 统计学处理
采用SPSS 13.0统计软件,所有计量资料以均数±标准差(s)表示,组间均数差异用单因素方差检验进行分析,以P<0.05作为判定有显著性差异的标准。
2 结果
2.1 对血清肝肾功能的影响
表1显示,模型组大鼠血清ALT、AST含量明显上升,与正常组相比差异显著(P<0.01,P<0.05);Scr、BUN含量亦明显增高,与正常组相比有显著差异(P<0.05,P<0.05)。
2.2 血清纤维化放免检测结果
表2显示,模型组LN、Ⅳ-C和HA水平明显升高,与正常组相比差异显著(P<0.05,P<0.05,P<0.01)。

表1 DMN对大鼠血清肝肾功能的影响(n=8)
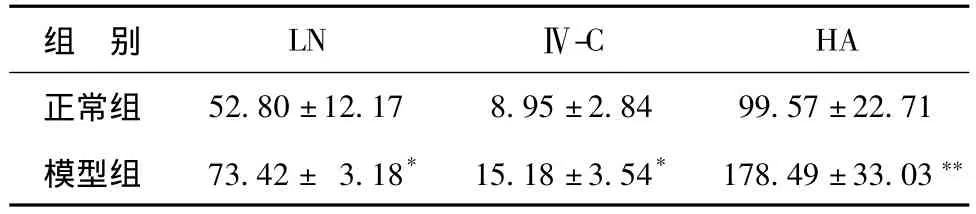
表2 DMN对大鼠血清LN、HA、Ⅳ-C水平的影响(ng/ml,n=8)
2.3 对组织的影响
肝组织:正常组肝小叶结构完整,无变性、坏死,无炎性细胞浸润及纤维增生。模型组可见,肝细胞索排列紊乱,炎症比较明显,肝小叶结构破坏,汇管区及中央静脉纤维组织增生,汇管区-中央静脉区形成宽大的纤维间隔,假小叶形成(见图1~3)。
肾组织:正常组肾小球形态、结构正常。模型组在血管间质可见小灶状炎细胞浸润,特别是在大的血管周边部,并可见散在点状坏死灶,基底膜轻度增厚,肾小管间质可见胶原增生明显(见图4~6)。
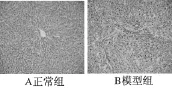
图1 肝脏HE染色(×200)
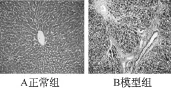
图2 肝脏MASSON染色(×200)

图3 肝脏MASSON染色(×200)
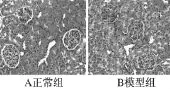
图4 肝脏天狼星红染色(×200)
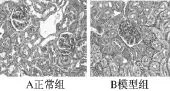
图5 肾脏PAS染色(×400)

图6 肾脏天狼星红染色(×400)
2.4 天狼星红染色胶原面积图像分析结果
表3显示,在肝脏和肾脏,模型组较正常组胶原增生明显(P<0.01)。
2.5 免疫组化图像分析定量结果(见表4)

表3 天狼星红胶原面积图像分析结果(n=8)

表4 TGF-β1,α-SMA 免疫组化结果(%,n=8)
2.5.1 TGF-β1的表达 肝组织:正常组仅见于汇管区、中央静脉周围细胞有表达,且着色较浅、范围窄。模型组则在汇管区、中央静脉周围及纤维间隔内有大量表达,呈棕黄色颗粒状,范围广,着色深(P<0.01)(见图7)。
肾组织:正常组在肾小球有一个较弱的阳性表达,而模型组肾小球阳性表达明显增多(P<0.01)(见图8)。
2.5.2 α-SMA的表达 肝组织:正常组只在汇管区、小叶中央静脉及分散在组织间的成纤维样细胞中出现。模型组在肝实质损伤区域大量出现,包括汇管区、肝纤维隔及肝窦等(P<0.01)(见图9)。
肾组织:正常组只在血管壁上有表达,模型组在血管壁及小管周边间质部分均有表达,局部有的阳性表达彼此连结成一些小的不完整的网状结构,呈细丝状,甚至包绕肾小球(P<0.01)(见图10)。

图7 肝脏 TGF-β1免疫组化(×200)
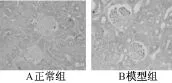
图8 肾脏 TGF-β1免疫组化(×400)

图9 肝脏α-SMA免疫组化(×200)
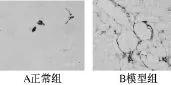
图10 肾脏α-SMA免疫组化(×400)
3 讨论
肝肾同源是中医的藏象理论,数千年来一直指导临床的辨证和治疗。早在《内经》中就有“肾生骨髓,髓生肝”的论述,明代医家李中梓结合自己的临床经验在《医宗必读》中首次提出著名的“乙癸同源”、“肝肾同治”的观点。“乙癸同源”是指肝、肾的结构和功能虽有差异,但其起源相同,密切相关。在先天,肝肾共同起源于生殖之精;在后天,肝肾共同受肾所藏的先后天综合之精的充养,“肾生骨、髓,髓生肝”。“肾生骨、髓”,即肾生“骨”和“髓”,“髓”又分“骨髓”、“脊髓”、“脑髓”、“精髓”等,它们均由肾精化生,“藏真下于肾,肾藏骨髓之气也”(《素问·平人气象论》);肾为肝之母,肝为肾之子。“髓生肝”,即肾通过“髓”生养肝而发生母子联系。“源”又可理解为事物之间相关联的中心环节,故“乙癸同源”又即肝肾的结构和功能体系通过某些中心环节而密切相关。“肝肾同源于精血”,意即肝肾的结构和功能体系通过“精血”这一中心环节而密切相关。简而言之,“乙癸同源”即“肝肾相关”,是人体内肝肾结构和功能协调统一的整体调控机制[3]。中医“肝肾同源”反映了肝肾两脏生理、病理和物质属性的同一性,预示了肝肾两脏可能有相同生物活性物质和靶细胞[4、5]。近年来不少学者对这一理论进行了深入研究。
DMN常用来建立肝纤维化模型,具有肝毒性、基因毒性和免疫毒性,其活性代谢产物使核酸、蛋白质等重要的生命物质发生甲基化反应,随后导致肝细胞坏死或凋亡,细胞外基质(ECM)进行性增加[6]。由于肝、肾纤维化具有一些内在的共同发病规律和病理形态学特征,如均表现为致纤维化的细胞因子表达上调,ECM合成增多或降解减少,纤维过度增生等[7],由此我们在腹腔注射DMN诱导动物肝纤维化的同时,观察了其对肾损伤的影响。实验结果表明,模型组大鼠血清转氨酶酶活性增强,血清肝纤维化指标LN、HA和IV-C水平显著升高,肝组织结构破坏,假小叶形成。同时还首次发现,DMN能够诱导大鼠肾功能改变,血清SCr、BUN水平升高,肾小管间质可见炎性浸润,胶原增生明显。
我们进一步采用免疫组化方法对肝肾α-SMA、TGF-β1的表达进行了研究,探讨肝纤维化伴肾损伤时的作用机制。大量文献证实,肝脏中α-SMA是肝星状细胞(HSC)活化、指示病程进展的重要标志[8]。而TGF-β1为公认的致肝纤维化最主要的细胞因子之一,主要通过自分泌和旁分泌方式参与活化、促进合成、抑制基质降解来参与肝纤维化发展过程[9]。在肾脏中,α-SMA阳性的肌成纤维细胞是导致ECM过度沉积的主要细胞来源。TGF-β1表达升高与多种原因引起的肾纤维化密切关系,它与受体结合通过细胞内信号转导活化靶基因产生一系列靶蛋白,使肌成纤维细胞增多,促进肾小球硬化和间质纤维化的发生[10~11]。本研究显示,模型组大鼠肝肾α-SMA和TGF-β1表达显著升高。
综上所述,本文首次在DMN模型大鼠中观察到肝纤维化并伴有肾损害,其机制可能是通过上调α-SMA和TGFβ1的表达而引起。这一方面为肝肾同源的病理相关性提供了实验依据,另一方面似可认为α-SMA和TGF-β1可能是肝肾相关的重要物质基础,为临床和科研提供了有效的药物筛选方法与治疗思路。
[1]金树根,王灵台,任家维,等.二甲基亚硝胺至大鼠肝纤维化的造模研究[J].中西医结合肝病杂志,1994,4(1):28-32.
[2]司晓芸,贾汝汉,黄从新,等.宽叶缬草对高胆固醇血症大鼠肾组织内TGF-β1表达的影响[J].中国中药杂志,2003,28(9):845-848.
[3]李瀚旻.“肝肾同源”的理论体系.中医药管理杂志,2007,15(3):203-206.
[4]崔丽安,邵凤珍,张俊富.补肾药对复合性免疫损伤大鼠肝纤维化转化生长因子β1及其受体的影响[J].河北中医,2003,25(11):878-880.
[5]李瀚旻.“肝肾同源”现代研究进展、评述与展望[J].中国中医基础医学杂志,2002,8(11):75-76.
[6]陈波.肝纤维化动物模型的建立[J].华西医学,2005,20(4):796-797.
[7]沈维增,谢峥伟,蔡军红,等.复方鳖甲软肝片对慢性肾衰竭大鼠肾组织TGF-β1表达的影响[J].中国中西医结合肾病杂志,2006,7(10):570-573.
[8]陈源文,李定国,吴建新,等.粉防己碱上调Smad7表达抑制大鼠肝星状细胞活化[J].中国药理学通报,2005,21(5):563-567.
[9]Lewindon PJ,Pereira TN,Hoskina AC,et al.The role of hepaeic stellate cells and transforming growth factor-β in cystic fibrosis liver disease[J].Am J Pathol,2002,160(5):1705-1715.
[10]蒋素华,丁小强,张晓丽,等.不同预缺血时间对肾小管间质纤维化的影响[J].中国病理生理杂志,2008,24(1):119-123.
[11]LIU FY,LI XZ,PENG YM,et al.Arkadia-smad7-mediated positive regulation of TGF-beta signaling in a rat model of tubulointerstitial fibrosis[J].Am J Nephrol,2007,27(2):176-183.
——紫 苏

