脑溢安对大鼠GAP-43表达的作用研究*
罗 云,黎杏群,唐 涛,罗杰坤,智屹惠,万赛英
(中南大学湘雅医院中西医结合研究所,湖南长沙 410008)
生长相关蛋白43(growth-associated protein-43,GAP-43)是一种与轴突生长相关的蛋白质,主要存在于生长锥,其作用是促进轴突生长及神经细胞分化,参与神经系统损伤后的修复与功能重塑,脑缺血时在缺血半暗区GAP-43表达增加,参与缺血后神经重塑。
最近10 多年来,我国采用脑血康[1]、清开灵[2]等中药对轻中度脑出血进行基础和临床研究,结果表明能降低致残率,提高患者的生活质量。脑溢安颗粒是我所研制的用于脑出血急性期的中药三类新药。研究表明,脑溢安颗粒具有促进神经营养因子(neurotrophin,NT)尤其是NT-3表达的作用。实验证实,NT-3促进GAP-43的表达,由此推测通过使用脑溢安颗粒促进脑出血时NT-3的表达后,也会促进GAP-43的表达。因此,本次实验将运用免疫组织化学和原位杂交方法研究缺氧损伤大鼠神经干细胞GAP-43的表达状况以及脑溢安对GAP-43表达的影响,以期阐明脑溢安治疗脑出血的机制。
1 材料与方法
1.1 动物
健康Sprague-Dawley雄性大鼠,清洁级,体重200g~250g;Sprague-Dawley乳鼠,出生7d左右,雌雄不拘,由中南大学湘雅医学院实验动物学部提供。
1.2 主要试剂
脑溢安(NYA)浸膏(湘雅医院自制)、兔GAP-43多克隆抗体和兔抗Nestin多克隆抗体(Boster)、bFGF及EGF(Pepro Tech EC)、DMEM/F12干粉培养基(Sigma)、胰蛋白酶(Sigma)、胎牛血清(四季青)、SABC试剂盒、DAB试剂盒、GAP-43原位杂交试剂盒(武汉博士德)。
我所配制的神经干细胞培养相关液体包括配制神经干细胞培养基、0.05%胰酶-0.04%EDTA消化液、D-Hank's液、EGF(2μg/ml)、青霉素-链霉素双抗贮存液、bFGF贮存液(2μg/ml)、DNase I贮存液(0.05%),配制过程略。
1.3 方法
1.3.1 脑溢安(NYA)血清的制备 适应性喂养大鼠3d后,用脑溢安浸膏13.12g/(kg·d)灌胃,前3d于8am、4pm各灌药6.56g/kg,第4天于8 am灌药13.12 g/kg。给药1h后,心脏内采血取血清,-20℃冷冻备用。正常大鼠血清的制备过程除每次灌服等量生理盐水代替脑溢安浸膏外,其余过程同前。
1.3.2 海马神经干细胞的分离培养和传代参照Zhao[3]的方法取新生大鼠大脑并分离海马,剪碎后移入50ml离心管内,加入0.05%胰蛋白酶-0.04%EDTA消化液10ml及0.05%DNase I 1ml,37℃消化20min~25min,20%胎牛血清终止消化,200目筛网过滤,滤液1100rpm离心10min,去上清,沉淀用D-Hank's液洗3遍,加入神经干细胞选择培养基,吸管反复吹打制成单细胞悬液,调整细胞密度,按1×105个/ml接种于塑料培养瓶,置于细胞培养箱,在37℃ 5%CO2的条件下培养。每3d半量换液,待原代克隆形成后(约7d~10d),将培养液移入15ml离心管内,1100rpm离心10min,去上清。细胞沉淀用0.125%胰酶消化10min~15min,20%胎牛血清终止消化,离心后去上清,细胞沉淀用DHank's液洗3次,加入神经干细胞选择培养基,反复吹打成单细胞悬液,调整细胞密度,按1×105个/ml接种于塑料培养瓶,置于细胞培养箱,在37℃、5%CO2的条件下培养。
1.3.3 鉴定细胞克隆为神经干细胞 将细胞培养基吸入15ml离心管内,滴于预先用多聚赖氨酸(Poly-L-Lysine)包被的载玻片上,电风扇吹干后将载玻片置于4%的多聚甲醛中固定15min,进行nestin(1∶100)免疫细胞化学染色(参照SABC试剂盒说明)。
1.3.4 缺氧损伤模型的建立及分组 将神经干细胞克隆用0.125%胰酶消化后制成单细胞悬液,调节细胞密度为1×105个/ml接种至塑料培养瓶,待细胞快速生长期时,更换培养液后将其移入厌氧培养箱(37℃、95%N2、5%CO2)内培养6h造成缺氧损伤模型。实验分为4组:①空白组:正常培养,不造成缺氧损伤模型;②模型组:将神经干细胞放入厌氧培养箱内培养6h,造成缺氧损伤;③正常血清对照组:模型组基础上加入含5%正常大鼠血清的神经干细胞培养液培养12h;④脑溢安组:模型组基础上加入含5%脑溢安血清的神经干细胞培养液培养12h。
1.3.5 免疫细胞化学检测GAP-43蛋白的表达 分别取上述4组神经干细胞,滴加至预先用多聚赖氨酸包被的载玻片上,4%多聚甲醛室温固定30min,参照SABC试剂盒说明进行免疫细胞化学检测。
1.3.6 Western blot检测GAP-43蛋白的表达
分别取上述4组神经干细胞,加入细胞裂解液提取蛋白,Bradford法粗测定蛋白浓度,液氮保存。取样品(20μl)进行SDS-PAGE电泳,转入NC膜封闭,加一抗、二抗之后DAB显色成像。
1.3.7 原位杂交检测GAP-43 mRNA的表达
分别取前述4组神经干细胞,滴加至预先用多聚赖氨酸包被的载玻片上,4%多聚甲醛室温固定30min,按原位杂交试剂盒中操作说明进行GAP-43原位杂交。
1.3.8 结果观察与统计分析 免疫细胞化学染色和原位杂交的结果观察,每组取5个标本,每个标本取5个互不重叠的阳性反应视野,用 Motic Images软件分别测定各个视野阳性细胞的着色强度,用灰度值表示(着色强度越低,灰度值越高)。Western blot结果采用Bandlead3.0图像分析系统测定蛋白带的光密度,进行半定量分析。结果用SPSS11.0统计软件包进行分析,多组比较采用单因素方差分析,2组间比较采用t检验。
2 结果
2.1 神经干细胞的鉴定
原代细胞接种于培养瓶1d~2d后,大部分细胞死亡,少部分细胞贴壁形成2~4个细胞的细胞克隆,更换培养基,此后每3d半量换液,7d~10d形成大小不一由众多细胞组成的细胞团,形态类似圆球状,即神经球(见图1、图2)。将神经球用0.05%胰酶-0.04%EDTA进行消化传代,7d~10d仍出现新的神经球;原代培养和传代培养所形成的神经球,其nestin免疫细胞化学染色均为阳性(见图3)。

图1 神经球(×100)

图2 神经球(×400)
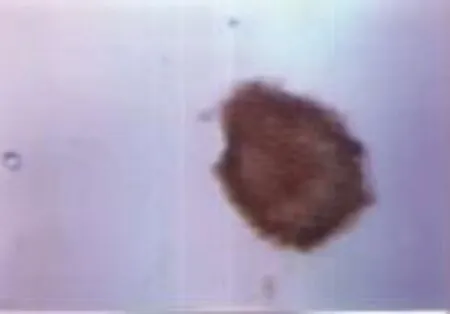
图3 神经球nestin染色阳性(×400)
2.2 缺氧损伤神经干细胞GAP-43蛋白表达
免疫细胞化学结果显示,各组均有GAP-43表达,与模型组相比较,正常血清对照组和脑溢安血清组神经干细胞GAP-43平均灰度值均较低(P<0.01),脑溢安血清组低于正常血清对照组(P<0.01)(见表1)。Western blot结果测得GAP-43蛋白表达的量与免疫细胞化学结果相似(见表2、图4)。
表1 缺氧损伤后各组神经干细胞GAP-43蛋白的灰度值(s,n=5)

表1 缺氧损伤后各组神经干细胞GAP-43蛋白的灰度值(s,n=5)
注:与模型组比较:△P<0.05,△△P<0.01;与正常血清对照组比较:**P<0.01
组平均灰度值空白组别61.2±8.775模 型 组 58.0 ±7.581**正常血清对照组 48.8±8.168△脑 溢 安 血 清 组 33.8±8.387△△**

图4 各组神经干细胞GAP-43免疫印迹图
表2 缺氧损伤后各组神经干细胞GAP-43蛋白的光密度值(s,n=5)

表2 缺氧损伤后各组神经干细胞GAP-43蛋白的光密度值(s,n=5)
注:与模型组比较:△P<0.05,△△P<0.01;与正常血清对照组比较:*P<0.05,**P<0.01
组光密度值空 白 组 164.0±6.453别△△**模 型 组 178.1±6.232*正常血清对照组 186.4±4.011△脑 溢 安 血 清 组 194.1±1.975△△*
2.3 缺氧损伤神经干细胞GAP-3 mRNA表达
原位杂交结果显示,各组均有GAP-43 mRNA表达,与模型组相比较,正常血清对照组和脑溢安血清组神经干细胞GAP-43 mRNA的平均灰度值均较低(P<0.01),脑溢安血清组较正常血清对照组低(P<0.01)。上述结果说明,正常血清对照组和脑溢安血清组神经干细胞GAP-43 mRNA的表达均较模型组多,脑溢安血清组神经干细胞GAP-43 mRNA的表达较正常血清对照组多(见表3、图5、图6)。
表3 缺氧损伤后各组神经干细胞GAP-43 mRNA的灰度值(平均灰度值/个细胞,s,n=5)
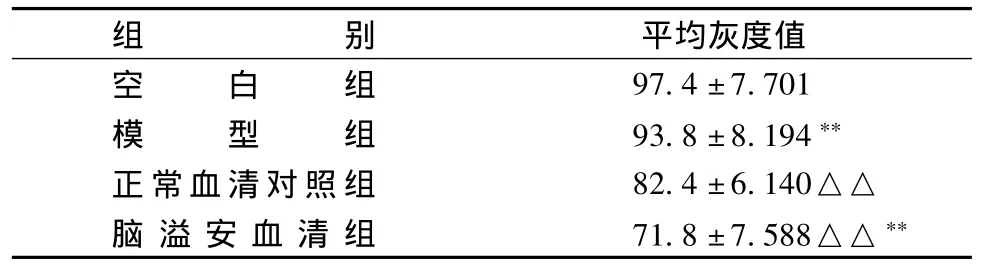
表3 缺氧损伤后各组神经干细胞GAP-43 mRNA的灰度值(平均灰度值/个细胞,s,n=5)
注:与模型组比较:△△P<0.01;与正常血清对照组比较:**P<0.01
组平均灰度值空白组别97.4±7.701模 型 组 93.8 ±8.194**正常血清对照组 82.4±6.140△△脑 溢 安 血 清 组 71.8±7.588△△**

图5 原位杂交:缺氧损伤神经球可见GAP-43 mRNA的表达(SABC×100)

图6 脑溢安血清促进缺氧损伤神经球GAP-43 mRNA的表达(SABC×100)
3 讨论
本实验对体外培养的神经干细胞进行厌氧培养,制成缺氧损伤细胞模型,模拟脑出血体内神经干细胞所处的病理环境,用免疫细胞化学、Western blot和原位杂交分别从蛋白和mRNA水平,观察缺氧损伤神经干细胞GAP-43的表达,以及脑溢安血清对缺氧损伤神经干细胞GAP-43表达的影响,以便从GAP-43和神经干细胞的关系的角度进一步阐明脑溢安治疗脑出血促进神经恢复的机制。结果显示,空白组(正常培养未造成缺氧损伤模型)和模型组均表达GAP-43,脑溢安血清组GAP-43的表达明显增加。提示神经干细胞和缺氧损伤神经干细胞均有GAP-43的表达,脑溢安促进缺氧损伤神经干细胞GAP-43的表达。
神经干细胞有两个特征:一是具有自我更新能力;二是具有多分化潜能,即神经干细胞可分化为神经元、星状细胞和少突胶质细胞[4]。它们主要存在于成年哺乳动物的管室膜、SVZ及海马[5]等区域。正常机体脑内神经干细胞处于静止状态,当机体受到诸如脑缺血、脑外伤、脑出血等疾病的损伤时,静止的神经干细胞被激活,发生增殖、迁移和分化,参与对损伤的修复。研究发现,脑缺血后海马、管室膜和SVZ等区域的神经干细胞发生增殖,向病灶处迁移,并可分化为神经元和星状细胞[6-7]。我们在以前的研究工作中也观察到,与脑缺血后情况相类似,脑出血后体内神经干细胞也会被激活而发生增殖,这些被激活的神经干细胞主要分布于血肿周围的基底节区、侧室管膜和相邻的SVZ[8]。至于脑损伤后其内源性神经干细胞被激活的机制目前尚不十分清楚。有研究提示,参与激活的因素有脑损伤部位表达增加的整合素配体、多聚唾液酸神经细胞黏附分子(polysialated neural cell adhesion molecule,PSANCAM)、生长因子bFGF、EGF、神经营养因子BDNF和NT-3[9],以及由损伤所致释放增加的兴奋性谷氨酸[10]等。在上述可激活神经干细胞的化学物质中,尤其值得注意的是兴奋性谷氨酸和神经营养因子。如果在脑缺血后即给予兴奋谷氨酸NMDA受体拮抗剂MK-801,可阻断海马神经干细胞的增殖[10],说明兴奋性谷氨酸参与了脑缺血后内源性神经干细胞的增殖过程,促进神经前体细胞向神经元方向分化;NT-3不仅可以促进内源性神经干细胞增殖,体外实验还证实,它还可促进体外培养的神经干细胞向神经元方向分化[11],促进与神经递质合成相关的酶基因表达(胆碱乙酰转移酶 mRNA和酪氨酸羟化酶mRNA)。激活的内源性神经干细胞可能通过以下机制参与神经修复[12]:①在受损神经元和由神经干细胞分化而来的神经元之间形成突触中继(synaptic relay),并通过突触中继这种“神经元桥(neuronal bridges)”的形成使轴突“主动”再生;②为轴突生长提供基质;③帮助无髓或新生轴突形成髓鞘。在上述第1种机制中,突触中继的形成需要受损神经元和由神经干细胞分化而来的神经元发出的神经纤维参与,涉及轴突再生,GAP-43是轴突生长必不可少的蛋白质[13],那么激活的内源性神经干细胞在参与对损伤的修复过程中一定伴随着 GAP-43的表达[14]。本实验观察到,脑出血大鼠脑内有GAP-43表达,缺氧损伤神经干细胞GAP-43有表达。因此可以认为,缺氧损伤神经干细胞表达的GAP-43参与突触中继的形成,有助于由神经干细胞分化而来的神经元的轴突生长。
如前所述,GAP-43除与轴突生长密切相关外,还可通过抑制细胞凋亡参与损伤的修复。人们通过以下两方面对GAP-43抑制细胞凋亡的作用进行了证实:①用一些给予措施抑制细胞凋亡后,GAP-43表达增加[15];②抑制GAP-43表达后,细胞凋亡增加[16]。我们在以前研究工作中观察到,脑出血大鼠内源性神经干细胞被激活而发生增殖[17]。本实验观察到缺氧损伤的体外培养神经干细胞有GAP-43的表达,既然GAP-43可通过抑制细胞凋亡参与损伤,那么我们认为缺氧损伤神经干细胞表达增加的GAP-43的作用在于抑制神经干细胞本身的凋亡,维持其存活状态,有利于损伤的修复。
本实验观察到,脑溢安促进缺氧损伤神经干细胞GAP-43的表达。结合我们以前工作的观察结果,脑溢安促进脑出血大鼠脑内神经干细胞的增殖[17],抑制体外培养的缺氧损伤神经干细胞Capase-3活性,抑制细胞凋亡。并根据其他研究者对于GAP-43的作用的研究结果,GAP-43促进轴突生长和通过抑制细胞凋亡参与损伤的修复[15、16]。我们认为,脑溢安促进缺氧损伤神经干细胞GAP-43表达的意义可能在于:①促进由脑出血大鼠内源性神经干细胞分化而来的神经元的轴突生长,以利于受损神经元建立突触中继,参与脑出血后的神经重塑;②抑制内源性神经干细胞的凋亡,维持其存活状态,有利于损伤的修复。这可能脑溢安防治脑出血的机制之一。
[1]郑国庆,王艳,王小同,等.脑血康对脑出血蛋白酶激活受体-1表达的影响[J].中国中西医结合急救杂志,2005,12(4):223-226.
[2]李鹏英,刘敏,鲁艺,等.清开灵注射液对大鼠脑出血后脑组织 TNF-α、SOD 的影响[J].中医药学报,2007,35(1):10-12.
[3]Zhao Y,Xie P,Zhu XF,Cai ZY.Neural stem cell transplantation and nerve growth factor promote neurological recovery in rats with ischemic stroke[J].Nan Fang Yi Ke Da Xue Xue Bao,2008,28(7):1123-1126.
[4]Modo M.Brain repair how stem cells are changing neurology[R][J].Bull Soc Sci Med Grand Duche Luxemb,2008,(2):217-257.
[5]Manganas LN,Zhang X,Li Y.Magnetic resonance spectroscopy identifies neural progenitor cells in the live human brain[J].Science,2007,318(5852):980-985.
[6]Okano H,Sakaguchi M,Ohki K.Regeneration of the central nervous system using endogenous repair mechanisms[J].J Neurochem,2007,102(5):1459-1465.
[7]Leker RR,Soldner F,Velasco I.Long-lasting regeneration after ischemia in the cerebral cortex[J].Stroke,2007,38(1):153-161.
[8]Tang T,Li XQ,Wu H,et al.Activation of endogenous neural stem cells in experimental intracerebral hemorrhagic rat brain[J].Chin Med J,2004,117(9):1342-1347.
[9]Mikami Y,Okano H,Sakaguchi M,et al.Implantation of dendritic cells in injured adult spinal cord results in activation of endogenous neural stem/progenitor cells leading to de novo neurogenesis and functional recovery[J].J Neurosci Res,2004,76(4):453-465.
[10]Shen L,Zhang J.NMDA receptor and iNOS are involved in the effects of ginsenoside Rg1 on hippocampal neurogenesis in ischemic gerbils[J].Neurol Res,2007,29(3):270-273.
[11]Cai C,Thorne J,Grabel L.Hedgehog serves as a mitogen and survival factor during embryonic stem cell neurogenesis[J].Stem Cells,2008,26(5):1097-1108.
[12]廖维靖,范明.神经干细胞及其对脑缺血的潜在治疗作用[J].中国神经科学杂志,2002,33(1):38-40.
[13]Donovan SL,McCasland JS.GAP-43 is critical for normal targeting of thalamocortical and corticothalamic,but not trigeminothalamic axons in the whisker barrel system [J].Somatosens Mot Res,2008,25(1):33-47.
[14]Dijk F,BergenAA,KamphuisW.GAP-43 expressionis upregulated in retinal ganglion cells after ischemia/reperfusioninduced damage[J].Exp Eye Res,2007,84(5):858-867.
[15]Demjen D,Klussmann S,Kleber S,et al.Neutralization of CD95 ligand promotes regeneration and functional recovery after spinal cord injury[J].Nat Med,2004,10(4):389-395.
[16]Gal A,Szilagyi G,Wappler E,et al.Bcl-2 or Bcl-XL gene therapy reduces apoptosis and increases plasticity protein GAP-43 in PC12 cells[J].Brain Res Bull,2008,76(4):349-353.
[17]Tang T,Li XQ,Wu H,et al.Activation of endogenous neural stem cells in experimental intracerebral hemorrhagic rat brain[J].Chin Med J,2004,117(9):1342-1347.

