环氧化酶-2在大鼠缺血再灌注脑损伤组织中的表达及与凋亡的关系
黄春刚 郭金栓 高丽霞
缺血再灌注脑(I/R)损伤发生机制十分复杂,很多机制尚未能明了。现已认识到脑I/R可激活一系列分子反应,从而导致脑组织的损伤。环氧化酶-2(COX-2)在I/R脑损伤组织中表达增强,但COX-2在I/R中作用即COX-2与神经元凋亡的关系研究不多。本研究通过大鼠I/R模型,分析脑组织COX-2的表达,探讨COX-2在I/R中的作用,寻找临床治疗I/R的新途径。
1 材料与方法
1.1 材料 主要试剂:COX-2特异性抑制剂 NS398(Sigma-Aldrich,USA);细胞凋亡检测试剂盒(武汉博士德公司);兔抗人COX-2单克隆抗体(福州迈新生物技术有限公司);DAB显色试剂盒(福州迈新生物公司)。
1.2 动物分组及模型的制备 实验动物为健康雄性SD大鼠,8~12周龄,体重250~300 g,购自河南省实验动物中心。随机分为对照组12只、假手术组12只、I/R组84只、I/R+NS39824 h组12只,其中I/R组分为脑缺血1 h再灌注15min、2 h、6 h、24 h、2 d、4 d、16 d。I/R 组:参照 Zea-Longa 等的颈外动物线栓法建立MCAO动物模型[1]。I/R+NS398组:术前30min腹腔注射NS398(5mg/kg,溶于5mg/ml DMSO);假手术组:假手术组线栓仅插入1cm;对照组:注射与抑制剂组等体积的DMSO。I/R模型制作完成后观察大鼠行为,采用Longa的5级神经缺陷评分法对大鼠进行神经功能评分,以判断模型是否成功。
1.3 标本采集 麻醉后的大鼠仰卧位固定,开胸,暴露心脏,行左心室穿刺入升主动脉,剪开右心耳,肝素0.9%氯化钠溶液经左升主动脉冲洗内脏血液,4%多聚甲醛的0.1 mol/L磷酸缓冲液经心灌流固定,待大鼠全身僵硬后,断头取出脑组织,置于4%多聚甲醛中固定24 h。固定脑组织标本,修块后进行常规脱水,石蜡包埋,标本取材范围为额极6mm处,行冠状面连续切片,切片厚度为5 μm。
1.4 TUNEL法 石蜡切片脱蜡。0.01 mol/L PBS冲洗后滴加蛋白酶 K胃蛋白酶复合消化液 1滴,4℃消化 30min。0.01 mol/L PBS冲洗后滴加 TUNEL标记反应混合液20 μl,37℃孵育1 h。0.01 mol/L PBS 冲洗后滴加 POD 20 μl,37℃孵育30min。0.01 mol/L PBS冲洗后滴加 DAB 显色剂 50 μl,显色。经脱水,透明,封片。
1.5 免疫组化SP法 常规脱蜡,用TBST洗3次;水浴法热修复;3%过氧化氢阻断内源过氧化物酶,TBST洗3次;用血清室温孵育10min;组织切片加入兔抗人COX-2单克隆抗体(1∶150),4℃过夜;TBST洗3次后,加入生物素标记第二抗体室温孵育20min;TBST洗3次,加入链霉素抗生物素蛋白-过氧化酶室温孵育20min,DAB显色,封片,应用Motic Med 6.0数码医学图像分析系统测定OD值。
1.6 蛋白免疫印迹法 大鼠麻醉后取脑,分离缺血再灌注组区的海马,置入细胞裂解液中,低温匀浆,取上清,-80℃保存备用。蛋白定量后,取20μg样品在聚丙烯酰胺凝胶上电泳完,电转至硝酸纤维素膜,取相应条带加入COX-2单抗,4℃过夜,与生物素标记的羊抗兔/小鼠IgG抗血清孵育2 h,TBST洗涤后,与卵白素-辣根过氧化物酶复合物孵育0.5 h,DAB显色。将特异性蛋白条带扫描,应用Motic Med 6.0数码医学图像分析系统测定平均灰度值。
1.7 统计学分析 应用 SPSS 11.0统计软件,计量资料以表示,采用单因素方差分析和Person方法相关分析,P<0.05为差异有统计学意义。
2 结果
2.1 MCAO动物模型复制成功 实验栓线鼠即刻出现右侧Horner综合症(右侧瞳孔缩小),麻醉清醒时出现左侧前肢或前后肢瘫痪,如规定缺血时限内未出现左侧肢体瘫痪或已死亡的动物被剔除。
2.2 TUNEL形态观察及计数结果 对照组、假手术组、I/R 15min偶见有TUNEL阳性细胞。I/R 2 h海马CA1区TUNEL阳性细胞开始增加,并于24 h达高峰;I/R+NS39824 h组TUNEL阳性细胞数明显减少,与I/R 24 h比较,差异有统计学意义(P <0.05)。见表1、2,图1~3。
表1 大鼠I/R损伤后不同时间海驱TUNEL凋亡数比较 n=12,

表1 大鼠I/R损伤后不同时间海驱TUNEL凋亡数比较 n=12,
注:与假手术组比较,*P <0.05
组别 TUNEL 凋亡数对照组1.8 ±1.9假手术组 2.7 ±2.2 IR组15min 3.7 ±1.52 h 18.8 ±3.8*6 h 53.3 ±5.3*24 h 106.8 ±7.4*2 d 41.2 ±4.1*4 d 31.7 ±4.9*16 d 20.0 ±5.1*

图1 TUNEL假手术组 24 h,海马CA1区凋亡的神经元偶见(×400)
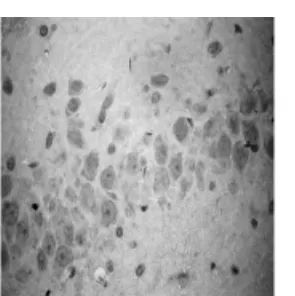
图2 TUNELI/R 24 h,海马CA1区凋亡的神经元达高峰(×400)
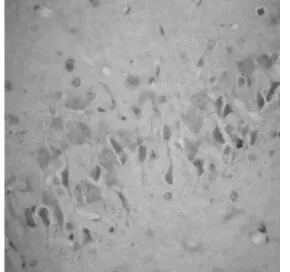
图3 TUNEL I/R+NS398组24 h,海马CA1区凋亡的神经元较I/R 24 h明显减少(×400)
表2 大鼠I/R损伤后不同组24 h海马区TUNEL凋亡数比较 n=12,
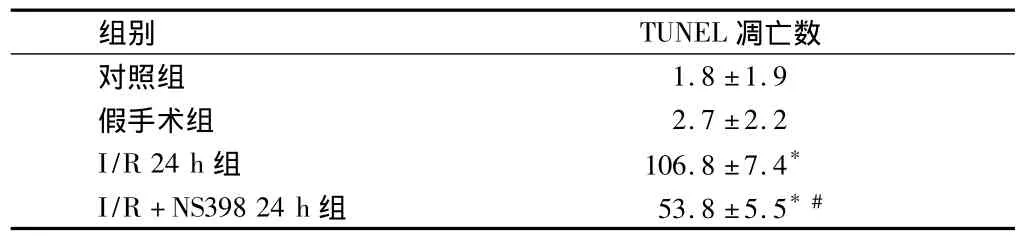
表2 大鼠I/R损伤后不同组24 h海马区TUNEL凋亡数比较 n=12,
注:与假手术组比较,*P <0.05;与 I/R 24 h 组比较,#P <0.05
组别 TUNEL 凋亡数对照组1.8 ±1.9假手术组 2.7 ±2.2 I/R 24 h 组 106.8 ±7.4*I/R+NS39824 h 组 53.8 ±5.5*#
2.3 COX-2免疫组化形态观察及定量分析结果 海马CA1区COX-2阳性细胞胞浆着棕黄色。对照组、假手术组、I/R 15min海马偶见COX-2免疫阳性细胞;I/R组COX-2免疫反应性在再灌后2 h开始升高,24 h达高峰;I/R+NS39824 h免疫反应性明显减弱,与I/R 24 h差异有统计学意义(P<0.05)。见表3、4,图4~6。
表3 大鼠I/R损伤后不同组不同时间海马区COX-2表达比较 n=12,

表3 大鼠I/R损伤后不同组不同时间海马区COX-2表达比较 n=12,
注:与假手术组比较,*P <0.05
组别OD对照组0.053 ±0.009假手术组 0.069 ±0.012 I/R组15min 0.081 ±0.0082 h 0.281 ±0.043*6 h 0.420 ±0.049*24 h 0.501 ±0.051*2 d 0.415 ±0.048*4 d 0.297 ±0.043*16 d 0.230 ±0.039*
表4 大鼠I/R损伤后不同组24 h海马区COX-2表达比较 n=12,

表4 大鼠I/R损伤后不同组24 h海马区COX-2表达比较 n=12,
注:与假手术组比较,*P <0.05;与 I/R 24h 比较,#P <0.05
组别OD对照组0.053 ±0.009假手术组 0.069 ±0.012 I/R 24 h 0.501 ±0.051*I/R+NS39824 h 0.308 ±0.033*#

图4 COX-2假手术组 24 h,海马CA1区偶见COX-2蛋白表达(SP×400)

图5 COX-2I/R 24h,海马CA1区COX-2表达达高峰(SP×400)
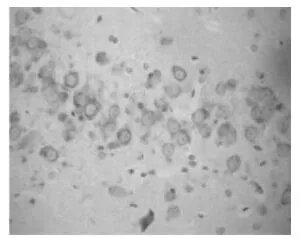
图6 COX-2 I/R+NS39824 h组,海马 CA1区COX-2表达强度比I/R组24 h减弱(SP×400)
3 讨论
COX-2是催化花生四烯酸和血栓素的限速酶,是一种膜结合的分子量为71ku的糖蛋白,催化花生四烯酸氧化为前列腺素G2(PGG2),再从PGG2还原为前列素H2(PGH2),最终生成一系列PGs,引起炎性反应和介导炎性细胞毒性。全脑缺血后,海马细胞死亡有许多细胞凋亡特征:如可被蛋白合成酶抑制剂所阻断;具有凋亡细胞的一些形态学特征;产生DNA碎片以及促凋亡基因在死亡细胞中的选择性表达等[2]。因此,全脑缺血后,在缺血神经元凋亡的病理机制中,COX-2的过度表达和激活可能起很重要的作用。为了明确COX-2的过度表达是否引起脑缺血性神经损害,该研究小组在此模型中应用了相对择性COX-2抑制剂NS398,此药物对动脉血压、血糖、血气和血红蛋白无影响。结果表明,注射此药物的实验组动物缺血性脑梗死体积明显小于对照组,有显著性差异。此保护作用甚至在延迟给药6 h后仍可观察到,说明COX-2在神经组织中的表达可直接损伤神经元,并引起组织损伤和脑水肿。有资料显示,COX-2参与I/R脑损伤区神经元凋亡:已有研究证实,人类脑I/R使COX-2 mRNA上调并加重脑损伤的程度,引起细胞凋亡[3];在 I/R 模型动物中 COX-2 可诱导大鼠神经元凋亡[4];使用COX-2特异性抑制剂,抑制海马CA1区的DND[5]。
本实验结果显示:在脑I/R模型中,缺血组再灌后15min偶见凋亡细胞,2 h海马区神经元凋亡开始增加,随时间延长凋亡细胞逐渐增多,并于24 h达高峰;于16 d时仍可见凋亡细胞;COX-2免疫组化及免疫印迹所显示的海马区COX-2免疫活性在缺血1 h再灌后15min偶见,2 h升高,6 h明显增强,24 h达高峰;于16 d时仍可见COX-2免疫活性;COX-2阳性细胞与TUNEL阳性细胞在分布区域上和细胞形态类型上有很大程度的重叠;使用COX-2的特异性阻制剂NS398,TUNEL阳性细胞数明显减少。本研究发现COX-2可能通过促进神经元凋亡参与I/R的发病,这为探索I/R的治疗新途径提供了理论基础。
1 Zea-Longa E,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats.Stroke,1989,20:84-91.
2 Chen J,Zhu RL,Nakayama M,et al.Expression of the apoptosis effector gene,Bax,is up-regulated in vulnerable hippocampal CA1 neurons following globle ischemia.J Neurochem,1996,67:64-71.
3 Iadecola C,Forster C,Nogawa S,et al.Cyclooxygenase-2 immuno reactivity in the human brain following cerebral ischemia.Acta Neuropathol(Berl),1999,98:9-14.
4 Takadera T,Yumoto H,Tozuka Y,et al.Prostaglandin E(2)in-duces caspase-dependentapoptosis in rat cortical cells.Neuros-ci Lett,2002,317:61-64.
5 Nakayama M,Uchimura K,Zhu RL,et al.Cyclooxygenase-2 inhibi-tion prevents delayed death of CA1 hippocampal neurons following global ischemia.Proc Natl Acad Sci USA,1998,95:10954-10959.

