外消旋体4-氯-3-羟基丁酸乙酯的化学合成
唐 功
(阿坝师范高等专科学校化学化工与生命科学系,四川 郫县 611741)
4-氯-3-羟基丁酸乙酯 (Ethyl-4-chloro-3-hydroxybutyrate,CHBE)是一种重要的有机中间体,分子中有多功能基团,其手性单一对映异构体(R)-和(S)-CHBE均是非常有前景的重要的手性砌块。通过氯基的置换、还原等反应,或导入其它基团,可生成所需的手性药物中间体。如(R)-CHBE可用于合成L-碱[1]、(-)-大内酰亚胺[2]和 (R)-γ-氨基-β-丁酸[3],还可以转化生成(+)-负霉素[4]和手性2,5-环己二烯酮的合成子[5]。但(R)-、(S)-CHBE不能直接通过商品获得,可由4-氯乙酰乙酸乙酯(COBE)还原得到。
作者在大量实践的基础上,用硼氢化钠来还原COBE合成外消旋体CHBE,并经红外光谱和质谱对其结构进行表征,为实现CHBE手性化合物的拆分奠定基础。
1 实验
1.1 主要试剂与仪器
4-氯乙酰乙酸乙酯(COBE),金坛市恒安化工厂;硼氢化钠(分析纯),中国医药(集团)上海化学试剂公司;其它试剂均为国产分析纯。
GC-14B型气相色谱仪(配有氢离子火焰检测器、C-R6A记录仪),日本SHIMADZU;Tensor27型傅立叶红外光谱仪,德国布鲁克公司;QP5050A型质谱仪,日本岛津公司;2XZ-1型旋片真空泵,浙江黄岩求精真空泵厂。
1.2 方法
1.2.1 合成原理
在碱性环境中,硼氢化钠还原COBE为CHBE的反应式如下:
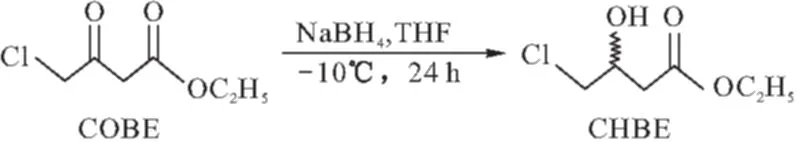
1.2.2 合成过程
(1)溶液A配制:称取1.89 g NaBH4,加入120 mL无水乙醇、10 mL 1%NaOH溶液,即得0.05 mol NaBH4溶液。
溶液B配制:用锥形瓶称取COBE 16.45 g,加入30 mL无水乙醇溶解完全,即得0.1 mol COBE溶液。
(2)将A溶液加到250 mL的三口烧瓶中,通过滴液漏斗将B溶液在15 min内滴加到A溶液中,在0~3℃的冰浴中反应3 h后,用纯乙酸中和至酸性,搅拌使反应完全。
(3)将反应液抽滤除去盐,再减压浓缩出乙醇(尽量浓缩完全,有盐析出),然后用饱和食盐水盐析,分出油层,装入另一干净的三口烧瓶中。
(4)用乙醚抽提水层2~3次,并用乙醚洗涤浓缩瓶。将乙醚与油层合并,用无水Na2SO4干燥过夜,抽滤,得淡黄绿色滤液。
(5)将滤液装入250 mL三口烧瓶,减压浓缩,用水浴加热,待乙醚蒸馏完全时,改用硅油浴进行减压蒸馏,并用50 mL圆底烧瓶收集馏分,馏出温度稳定在126℃。用气相色谱分析产物纯度。
1.2.3 结构表征
红外光谱分析采用溴化钾压片法。质谱分析采用加热进样法,样品汽化温度为280℃,离子源温度为230℃,电离方式EI,扫描质量范围(质量电荷比m/z)29~450。
2 结果与讨论
2.1 气相色谱分析
用硼氢化钠还原COBE得到外消旋体CHBE 13.6 g,收率为82.5%、纯度达96.779%。其色谱图及色谱数据见图1和表1。

图1 产物的气相色谱图

表1 产物气相色谱图数据
2.2 红外光谱分析(图2)

图2 产物的红外光谱
由图2可以看出,1728 cm-1处为C = O的伸缩吸收峰,1191 cm-1处为C-O的伸缩吸收峰,2984 cm-1处为C-H的伸缩吸收峰。
2.3 质谱分析(图3)
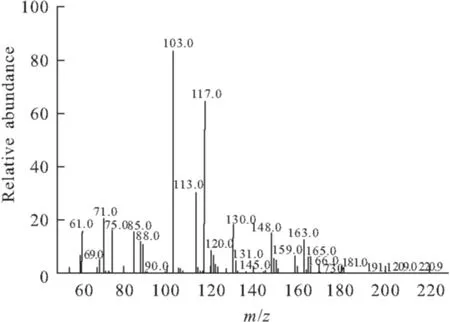
图3 产物的质谱图
由图3可以看出,CHBE的质谱图出现了M-1 (m/z165.0)峰,还出现了M-3 (m/z163.0)峰。另外,它的分子离子峰失去·OC2H5,形成了m/z103.0的峰;失去·Cl,形成了m/z113.0的峰;在羟基处失去一分子水,形成了m/z148.0的峰,失去·CH2Cl,形成了m/z117.0的峰。因此,可确定产物的分子量为166。
2.4 讨论
COBE分子中有两个羰基,属于β-二羰基化合物,具有较大的偶极距。由于羰基中氧原子吸电子的能力较强,而π电子的流动性较大,π电子强烈地被氧原子吸引,而使酮羰基氧原子上带有较多的负电荷。而酯基中虽然含有羰基,但因其中羟基的影响,并不具有醛酮羰基的性质。羰基的强极性结构简化了离子加成的定位问题[6]。COBE分子中的Cl-CH2-基团和C2H5OOCCH2-基团都是非手性的,而亲核试剂硼氢化钠是非手性化合物,则生成的产物一定是外消旋体。
3 结论
通过化学法合成得到4-氯-3-羟基丁酸乙酯,收率为82.5%、纯度达96.779%,产品后处理简便。为实现4-氯-3-羟基丁酸乙酯手性化合物的拆分奠定了基础。
[1] Zhou B N,Gopalan A S,VanMiddlesworth F,et al. Stereochemical control of yeast reductions. 1. Asymmetric synthesis of L-carnitine[J]. J Am Chem Soc,1983,105(18):5925-5926.
[2] Marino J P,McClure M S,Holub D P,et al. Stereocontrolled synthesis of (-)-macrolactin A[J]. J Am Chem Soc,2002,124(8):1664-1668.
[3] Kolb H C,Bennani Y L,Sharpless K B. Short and practical syntheses of (R)-(-)-carnitine and (R)-(-)-γ-amino-β-hydroxybutyric acid (GABOB)[J]. Tetrahedron:Asymmetry,1993,4(1):133-141.
[4] Davies S G,Ichihara O. Asymmetric synthesis of (+)-negamycin[J]. Tetrahedron:Asymmetry,1996,7(7):1919-1922.
[5] Hikichi S,Hareau G P-J,Sato F. Efficient and practical synthesis of optically active 5-t-butyldimthylsiloxy-2-cyclohexenone as a convenient chiral 2,5-cyclohexadienone synthon[J]. Tetrahedron Lett,1997,38(48):8299-8302.
[6] 伏明君.4-氯乙酰乙酸乙酯不对称合成[D]. 南京:南京工业大学,2005.

