转化生长因子-β1和神经生长因子对人牙周膜细胞增殖的生物学作用
张燕青,武云霞
(山西医科大学第一临床医学院口腔科,山西太原 030001)
牙周炎可导致牙周支持组织炎症及牙周袋形成,进而导致进行性附着表失,牙槽骨吸收,最后可导致牙松动、脱落。牙周炎的最终治疗目的是使被吸收的牙槽骨重建,牙周袋消失,使具有新附着能力的牙周膜细胞优点占领根面,从而在原已暴露于牙周袋内的根面上形成新的牙骨质,并有牙周膜纤维埋入,形成新附着[1]。牙周组织再生重建的关键是牙周膜细胞的增殖与分化。转化生长因子-β1(transforming factorβ1,TGF-β1)在机体内有多种调节功能[2-6],对牙周组织再生修复有重要影响,通过刺激牙周膜细胞增殖分化,促进牙周软组织的再生和牙周硬组织的形成,在牙周组织损伤修复中发挥着重要作用。TGF-β1作为重要的生物活性因子,具有广阔的应用前景。神经生长因子(nerve growth factor,NGF)广泛分布于全身器官,不但在牙齿发育和损伤修复中发挥着重要作用,而且对人牙髓和牙周膜的增殖和分化中也有重大作用[2]。本实验观察TGF-β1和NGF对体外培养的人牙周膜细胞(periodontal ligamentcell,PDLC)的单独以及联合应用的作用,为TGF-β1和NGF联合应用于牙周损伤后修复提供理论依据。
1 材料与方法
1.1 主要试剂和仪器
TGF-β1(Cytokine,美国);NGF(Cytokine,美国);低糖 DMEM培养液,胰蛋白酶(Sigma,美国);胎牛血清(FBS,浙江金华清湖犊牛利用研究所),用时加入100 mg/L链霉素和106 U/L青霉素;人牙周膜细胞(hPDLCs,山西口腔医院);噻唑盐(MTT,Sigma,美国);二甲基亚砜(DMSO,西安化学试剂厂)。 自动CO2孵箱(美国Forma Scientific公司);DG3022A型酶联免疫检测仪(华东电子管厂);UV-265FW型紫外可见分光光度计(日本Shimadzu公司)。
1.2 PDLC的传代培养和来源鉴定
将储存于液氮中的PDLC取出后立即放在37℃水浴箱中加热,不时摇动,使其急速融化,30 s~1 min后,等到完全溶解后移入离心管低速离心后,移入25 ml培养瓶中,加入5~8 ml含10%小牛血清的双抗DMEM培养液,混合均匀后移入温度为37℃、压力为950 ml/L且含5%CO2的恒温空气的标准孵箱中孵育,当培养液由红转黄后换液,直至细胞长满瓶底80%左右时,用25%的胰蛋白酶消化,在倒置显微镜下观察PDLC的生长状态、细胞形态以及细胞形态变化。显微镜下见大部分PDLC突起收缩,细胞变圆时,迅速用含10%FBS的DMEM终止消化,轻轻吹打后,移入离心管低速离心后分装为2瓶,等传代到第6代时,利用免疫组化法进行细胞来源鉴定,波形丝蛋白染色阳性,细胞角蛋白染色阴性。
1.3 TGF-β1和NGF对人PDLC增殖生物学作用的浓度效应比较
取生长良好的第6代人PDLC,胰酶消化,细胞计数,调整细胞浓度为 2×104/ml,接种于 96 孔板,每孔 200 μl,在37℃、5%CO2孵箱中培养,加入含10%FBS的双抗DMEM培养液,培养24 h后,弃去孔内培养液和未贴壁的细胞,换用含无血清的DMEM培养液培养24 h,使细胞相对同步化。对照组用含2%FBS的DMEM培养液,实验组采用含2%FBS的DMEM培养液,加入不同浓度的 TGF-β1,终浓度为 0.1、1.0、10.0、50.0、100.0 ng/ml;加入不同浓度的 NGF,终浓度为 0.1、1.0、10.0、50.0、100.0 ng/ml,每浓度组 4 孔,于标准环境的孵箱中培养3 d后,每孔加入MTT 20μl,培养4 h后,吸去孔内培养液,每孔加入150μl二甲基亚砜,于振荡仪上充分振荡10 min,用酶联免疫检测仪在490 nm波长下测定各孔的A值,取平均值进行统计学处理。
1.4 TGF-β1和NGF联合作用对人PDLC增殖的生物学作用
把已经测得最佳效应浓度的TGF-β1、NGF和TGF-β1+NGF按照上述方法加入96孔板,细胞浓度同“1.3”,每孔液量为200μl,加因子后第3天用MTT法检测细胞增殖,测定A值,进行组间及对照组比较。
1.5 统计学方法
数据以均数±标准差(x±s)表示,采用 SPSS 11.0进行分析,不同浓度的TGF-β1与NGF及两者的联用效果对人PDLC增殖的生物学作用的比较采用方差分析,P<0.05表示差异有统计学意义。
2 结果
2.1 TGF-β1对人PDLC增殖的生物学作用的浓度效应
见表 1。
表1 不同浓度的TGF-β1对人PDLC增殖的生物学作用(x±s)
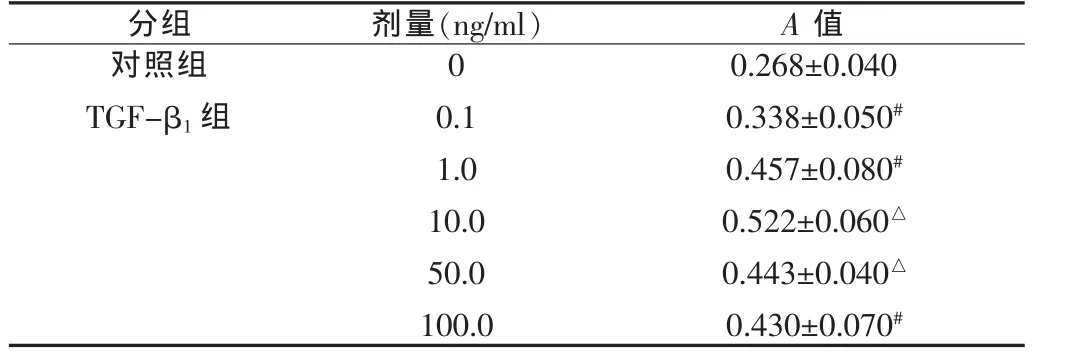
与对照组比较,#P<0.05,△P<0.01
与对照组比较,浓度为 0.1~100.0 ng/ml的TGF-β1单独应用均具有促进人PDLC增殖的生物学作用,但是促进增殖的效果不同,其中浓度为10 ng/ml的TGF-β1为最佳效应浓度。
2.2 NGF对人PDLC增殖的生物学作用的浓度效应
见表2。

表2 不同浓度的NGF对人PDLC增殖的生物学作用(x±s)
与对照组比较,浓度为1.0、10.0、100.0μg/ml的NGF单独应用具有促进人PDLC增殖的生物学作用,其中浓度为10.0μg/ml的NGF为最佳效应浓度。
2.2 TGF-β1和NGF联合应用对人PDLC增殖的生物学作用
最佳TGF-β1浓度与最佳NGF浓度以及两者联用时对人PDLC增殖的生物学作用见表3。两者联合应用所测得的A 值为(0.602±0.004),TGF-β1单独应用时所测得的 A 值为(0.522±0.060),NGF 单独应用测得的 A 值为(0.304±0.020),比其他两组高,说明联合应用具有协同作用。3讨论

表3 TGF-β1、NGF联合应用对人PDLC增殖的生物学作用(x±s)
PDLC是一类具有各种不同功能和分化潜力的细胞[3],是牙周组织再生修复的主要细胞群,其生物学特征包括:合成和分泌大量的胶原和非胶原蛋白,表达较高的ALPase活性[4-6]。现今牙周病治疗研究的主要问题是如何促进牙周膜来源的细胞转化为新的牙糟骨、牙周膜及牙骨质,恢复牙周组织原有的结构和功能。TGF-β1是一种多肽调节因子,能调节起源于间充质细胞,特别是成纤维细胞和成骨细胞的增殖功能,是组织损伤修复的主要调节因子[7-9]。NGF不仅对神经细胞的生长发育、分化、再生发挥调节作用,还参与调控牙齿的发育和损伤后的痛觉过敏及修复。研究发现,一定浓度的NGF可显著促进体外培养的人牙乳头间充质细胞DNA合成,刺激DNA合成前期的细胞向DNA合成期转变,促进体外培养的人牙乳头间充质细胞增殖。研究证实,NGF可显著促进人牙髓细胞及牙周膜细胞的增殖。Oates等[10]研究认为,生长因子的联合应用对细胞的增殖效应高于一种因子本身的作用,故TGF-β1和NGF的联合应用效应显著高于单独应用。本研究采用MTT比色法观察不同浓度的TGF-β1和NGF对PDLC的增殖作用,MTT被活细胞线粒体内的琥珀酸脱氢酶还原为不溶于水的蓝紫色物质,在二甲基亚砜的溶解下成蓝紫色液体,再用酶标仪测定A值,反应活细胞的数量。MTT法简单快速、准确,可重复性好,是目前被广泛采用的检测细胞增殖的方法[2]。本实验结果显示,10.0 ng/ml TGF-β1和 10.0 μg/ml NGF联用可显著促进PDLC的增殖,具有协同作用。
[1]曹采方,吴亚芬,李德懿.牙周病学[M].2版.北京:人民卫生出版社,2003:217-221.
[2]石瑾,武云霞.神经生长因子和重组形态蛋白对人牙周膜细胞增殖与分化作用的影响[J].山西医药杂志,2008,37(3):225-227.
[3]司晓辉,刘正.转化生长因子对人牙周膜成纤维细胞的生物学作用[J].中华口腔医学杂志,2001,36(1):53-55.
[4]吴织芬,董广英,万玲.转化生长因子-β1和胰岛素对人牙周膜细胞增殖的影响[J].中华口腔医学杂志,1997,32(5):300-302.
[5]董广英.转化生长因子-β1在牙周组织再生修复的作用[J].国外医学:口腔医学分册,1997,24(2):82-85.
[6]Kido JI,Ishida H,Nagta T,et al.Effects of parathyroid hormone 1,25-dihydroxyvitamin D3and prostaglandin E2on alkaline phosphatase activity in cultured dental pulp and gingiva cells of bovine calf[J].J Enodon,1991,17:161.
[7]Kurihara H,Shinohara H,Yoshino H,et al.Neurotrophins in cultured cells from periodontal tissues[J].J Periodontol,2003,74(1):76-84.
[8]Narayanan AS,Bartold PM.Biochemistry of periodontal connective tissues and their regeneration:a current perspective[J].J Connect Tissue Res,1996,34(3):191-201.
[9]Dennisn DK,Vallone DR,Pinero GJ,et al.Differential effect of TGF-β1and PDGF on periontal ligament cells and gingial fibroblasts[J].JPeriodontol,1994,65(7):641-648.
[10]Oates TW,Rouse CA,Cochran DL.Mitognic effects of growth factor on human periodontal ligament cells in vitro[J].JPeriodontol,1993,64(2):142-148.

