赭曲霉对16α,17α-环氧黄体酮的C11α-羟基化工艺研究
16α,17α-环氧黄体酮(16α,17α-Epoxyprogesterone,EP)全称为16α,17α-环氧孕甾-4-烯-3,20-二酮,又名沃式氧化物,白色结晶粉末,无臭,微溶于乙醇、甲醇、甲苯。利用微生物进行C11α-羟基化是甾体生物转化中的一个重要反应[1],得到的C11α-羟基化产物是合成地塞米松、强的松龙等药物的重要中间体。据文献报道,应用于16α,17α-环氧黄体酮C11α-羟基化的微生物生产菌种主要有黑根霉(Rhizopusnigricans)[2~4]、雅致小克银汉霉(Cunninghamellaelegans)[5]和绿僵菌(Metarhiziumsp.)[6]等,产率一般在45%~75%之间,对发酵条件及操作要求较高且副产物种类较多。
作者就赭曲霉(Aspergillusochraceus)405转化16α,17α-环氧黄体酮的C11α-羟基化工艺进行了研究,并将羟丙基-β-环糊精(HP-β-CD)应用于该反应中,提高了转化率。
1 实验
1.1 试剂和仪器
16α,17α-环氧黄体酮,天津津津药业有限公司;其它试剂均为市售分析纯。
Agilent1100型高效液相色谱仪,美国安捷伦公司;HP-β-CD(取代度6.52),西安德立生物化工有限公司。
1.2 菌种和培养基
菌种:赭曲霉(Aspergillusochraceus)405,天津科技大学微生物制药研究室保藏。
斜面培养基(g·L-1):土豆200,葡萄糖20,琼脂20,酵母膏1,pH值自然。
转化培养基(g·L-1):葡萄糖30,玉米浆40,蚕蛹粉2,硫酸铵1.5,pH值6.4。
1.3 16α,17α-环氧黄体酮的C11α-羟基化反应
将斜面菌种于28℃ 培养7 d,无菌水洗下孢子,制成浓度为5×107个·mL-1的孢子溶液,取一定量接种于50 mL/250 mL三角瓶发酵培养基中,28℃、200 r·min-1振荡培养28 h,加入10 g·L-1EP,继续转化48 h。
1.4 HP-β-CD的添加方式
称取与EP不同摩尔比的HP-β-CD,用紫外线灭菌30 min后分别加入到发酵液中。
1.5 相溶解度的测定
配制一系列浓度的 HP-β-CD 溶液,各取10 mL于具塞试管,加过量的EP,在摇床上28℃、200 r·min-1恒温振荡24 h。取上清液用0.45 μm微孔滤膜过滤,用高效液相色谱法测定其浓度,以EP浓度为纵坐标、HP-β-CD浓度为横坐标,绘制相溶解度图。
1.6 转化率测定
取2 mL发酵液加入4 mL乙酸乙酯进行萃取,离心,精确取上清液0.1 mL于1.5 mL的小离心管中,自然风干后加1 mL流动相,12 000 r·min-1离心10 min。然后用高效液相色谱仪检测,色谱柱为Phenomenex C18(5 μm,250 mm×4.6 mm);流动相为甲醇∶水=80∶20(体积比);流速1 mL·min-1;检测波长240 nm;柱温30℃;进样量20 μL;外标法检测。转化率依下式计算:

式中:X为液相测得的产物浓度,mg·L-1;d为稀释倍数;V为发酵液的体积,L;mEP为V体积内底物的质量,mg;MEP与M产物分别为底物与产物的摩尔质量,g·mol-1。
2 结果与讨论
2.1 摇床转速对转化率的影响
摇床转速对转化体系的影响主要包括溶氧和剪切力两方面,提高转速可以强化底物和氧气在菌体发酵体系中的传质,促进酶与底物的充分接触。但随着摇床转速的提高,剪切力也相应增大,会将菌丝打碎,反而不利于细胞的生长。考察摇床转速对转化率的影响,结果见图1。

图1 摇床转速对转化率的影响
由图1可知,当转速为200 r·min-1时,赭曲霉菌球大小一致,转化率最高,最适宜转化反应的进行。
2.2 接种量对C11α-羟基化反应的影响
配制浓度为5×107个·mL-1的赭曲霉孢子悬浮液,以不同接种量接种,考察接种量对C11α-羟基化反应的影响,结果见表1。
由表1可知,接种量较小,菌球大而数量少;随接种量增大,摇瓶内菌球变小、数量增加,发酵液逐渐呈粥状。转化率也随着接种量和摇瓶中菌球形态的不同而不同,接种量为2.0%时转化率最高达72.6%,此时,摇瓶中菌球呈小米状。
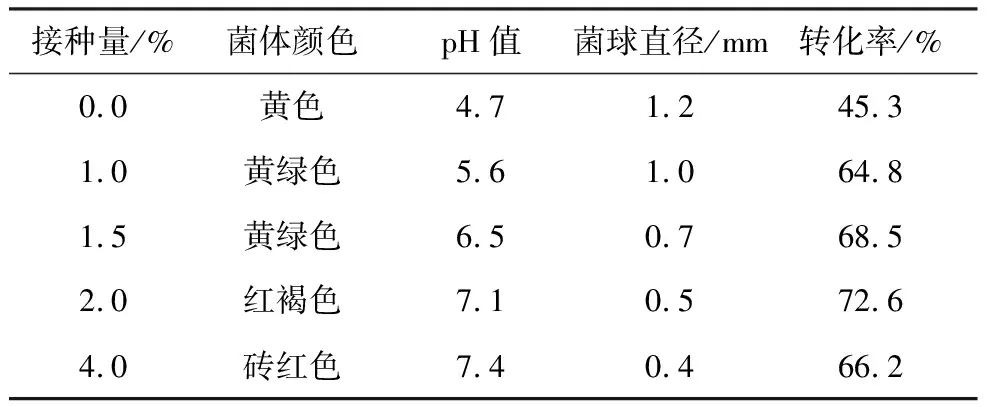
表1 接种量对EP C11α-羟基化反应的影响
2.3 底物投料方式对转化率的影响
考察了不同底物投料方式对转化率的影响,结果见图2。(1)有机溶剂助溶法:分别用甲醇、乙醇、丙酮、丙二醇、DMF、DMSO溶解EP,所有溶剂均按照4%的比例添加,然后超声振荡处理5 min以加速EP在溶剂中的分散,加入到已培养好的菌体中进行转化实验。(2)吐温80乳化法:用吐温80溶液高温乳化EP后,超声振荡5 min,然后加入到已培养好的菌体中进行转化实验。(3)干粉投料法:将EP紫外灭菌后直接加入到已培养好的菌体中进行转化实验。

图2 底物投料方式对转化率的影响
由图2可知,用乙醇溶解EP后进行超声振荡处理的投料方式的转化率最高,为74.2%。
2.4 转化培养基初始pH值对转化率的影响
赭曲霉转化EP,是利用胞内酶的作用,而酶与底物的作用必须有合适的pH值。另外,培养基初始pH值影响跨膜pH值梯度,影响膜的通透性,进而影响菌体生长与产物的生成,是生物转化的关键因素之一[4]。考察初始pH值对转化率的影响,结果如图3所示。

图3 转化培养基初始pH值对转化率的影响
由图3可知,转化培养基初始pH值为5.0时,转化率最高。
2.5 底物投加时间对转化率的影响
羟化酶为诱导酶,底物的添加时间往往对转化效果产生显著影响。选取在快速生长期内的不同时期加入EP进行转化实验,考察底物投加时间对转化率的影响,结果见图4。

图4 底物投加时间对转化率的影响
由图4可知,在28 h左右进行投料的转化率最高,达80.3%。
2.6 底物浓度对转化率的影响(图5)

图5 底物浓度对转化率的影响
由图5可知,转化率随底物浓度的增加而显著降低,底物浓度较低时(10 g·L-1)的转化率最高,达80.5%。
2.7 环糊精添加比例对转化率的影响
环糊精能显著增加EP等疏水化合物的水溶性,在一定范围内其溶解度的增加与环糊精的添加量呈线性关系(图6)。在转化过程进行4 h时添加与EP不同摩尔比的HP-β-CD,28℃、200 r·min-1反应48 h,结果见图7。

图6 EP在HP-β-CD溶液中的相溶解图

图7 HP-β-CD与EP摩尔比对转化率的影响
由图7可知,加入与EP摩尔比为(0.25~1.25)∶1的HP-β-CD时,底物转化率随着HP-β-CD加量的增大而上升;n(HP-β-CD)∶n(EP)为1.25∶1时,转化率最高,为93.1%,较未添加HP-β-CD的转化率提高了12.6%;继续增加HP-β-CD的量,转化率转而下降。
3 结论
确定了利用赭曲霉进行16α,17α-环氧黄体酮的C11α-羟基化的最佳转化条件如下:转化培养基初始pH值为5.0、接种量为2.0%、摇床转速为200 r·min-1、培养28 h时投加用乙醇溶解的EP、EP浓度为10 g·L-1,此条件下转化率达80.5%。在转化反应进行4 h时添加与EP摩尔比为1.25∶1的HP-β-CD,转化率达到93.1%,较未添加HP-β-CD的转化率提高了12.6%。
参考文献:
[1] Fernandes P,Cruz A,Angelova B,et al.Microbial conversion of steroid compounds:Recent developments[J].Enzyme and Microbial Technology,2003,32(6):688-705.
[2] 杜大庆,刘玲玲,张星元,等.黑根霉对甾体的C11α-羟基化反应[J].河南工业大学学报(自然科学版),2006,27(3):70-74.
[3] 万金营,杜连祥,巩培,等.双液相体系下对黑根霉C11α-羟基化16α,17α-环氧孕酮的研究[J].天津科技大学学报,2009,24(2):13-16.
[4] Roglic U, Znidarsic-Plazl P,Plazl I.The influence ofβ-cyclodextrin on the kinetics of progesterone transformation byRhizopusnigricans[J].Biocatalysis and Biotransformation,2005,23(5):299-305.
[5] 徐银,陈小龙,郑裕国.雅致小克银汉霉对16α,17α-环氧黄体酮C11α-羟基化的工艺研究[J].中国生化药物杂志,2009,30(4):239-242.
[6] 李安华,王艺军,王明道,等.绿僵菌羟基化16α,17α-环氧黄体酮的工艺研究[J].河南科学,2007,25(5):754-757.

