氯化-四(对羧基苯基)锰卟啉催化过亚硝酸根分解及硝化酪氨酸的研究
过亚硝酸根(ONOO-)是生物体的一类内源性细胞毒素,具有强烈的氧化和硝化作用,能够诱导蛋白质、脂质、DNA等生物大分子的损伤,与心血管疾病、糖尿病、神经退行性疾病、炎症及癌症密切相关[1,2]。如何抑制过亚硝酸根毒性一直是此领域的研究热点。在过亚硝酸根抑制剂的研究中,金属卟啉类抑制剂因其清除速度快、效率高等优点,受到广泛关注。
1996年,Stern等[3]首次发现水溶性铁卟啉能够有效催化过亚硝酸根的分解,从而抑制过亚硝酸根的毒性,引发了金属卟啉清除过亚硝酸根的研究热潮。近年来,各国学者开始研究以金属卟啉为代表的多种金属化合物催化过亚硝酸根分解的原理,并积极寻找和合成更多、更好的清除过亚硝酸根的大分子金属化合物。
作者在此以氯化-四(对羧基苯基)锰卟啉[T(p-COOH)PPMnCl]为对象,研究新型锰卟啉在生理条件下催化过亚硝酸根分解和硝化酪氨酸的反应动力学。对过亚硝酸根毒性抑制剂的研究及过亚硝酸根相关疾病药物的开发具有积极的意义。
1 实验
1.1 试剂与仪器
过亚硝酸根溶液按照1995年Uppu等[4]提出的两相反应体系过氧化氢与亚硝酸异戊酯的取代反应来制备。每次实验前用紫外可见分光光度计在302 nm测定过亚硝酸根的吸光度,根据ε302=1670 L·mol-1·cm-1计算过亚硝酸根浓度。
卟啉配体参照文献[5]合成。金属卟啉参照文献[6]合成,收率为90%~95%,合成的锰卟啉结构见图1。其它试剂均为国产分析纯,实验用水为二次去离子水。
U3010型紫外可见分光光度计,日本日立公司;SFM-300/MOS-250型停留动力学与光谱分析系统、Bio-Kine 32 V4.27动力学曲线模拟软件,法国比奥罗杰公司。

图1 锰卟啉结构图
1.2 方法
1.2.1 生理条件下,锰卟啉催化过亚硝酸根分解的动力学研究
在过亚硝酸根浓度为400 μmol·L-1、锰卟啉浓度为10 μmol·L-1、生理条件下,利用停留动力学装置研究锰卟啉催化过亚硝酸根分解的动力学。在302 nm处测定过亚硝酸根的吸光度[4],得到锰卟啉催化过亚硝酸根分解的动力学曲线,表观速率常数由动力学软件Bio-Kine拟合计算得出。每组实验平行进行7次。
在37℃,研究不同浓度的锰卟啉催化过亚硝酸根分解的反应动力学。锰卟啉的浓度分别为0 μmol·L-1、2 μmol·L-1、6 μmol·L-1、10 μmol·L-1、14 μmol·L-1,过亚硝酸根浓度为400 μmol·L-1。用动力学软件Bio-Kine模拟分解曲线得到表观速率常数。
分别在4℃、15℃、25℃、37℃、45℃测定10 μmol·L-1锰卟啉催化400 μmol·L-1过亚硝酸根分解的表观速率常数。通过Arrhenius定理lnk=lnA-(Ea/RT),求得活化能Ea。
1.2.2 生理条件下,锰卟啉催化过亚硝酸根硝化酪氨酸的动力学研究
利用紫外可见分光光度法,测定生理条件下不同浓度锰卟啉催化过亚硝酸根硝化酪氨酸生成3-NT的生成量,以此考察锰卟啉生理条件下催化过亚硝酸根硝化酪氨酸的效果。在37℃,将1 mmol·L-1酪氨酸和不同浓度(0 μmol·L-1、2 μmol·L-1、6 μmol·L-1、10 μmol·L-1、14 μmol·L-1)锰卟啉溶于pH值7.4的0.1 mol·L-1磷酸盐缓冲溶液中,37℃水浴,剧烈搅拌,分滴(间隔30 s)加入过亚硝酸根溶液,使过亚硝酸根终浓度为1 mmol·L-1,反应30 min,根据3-NT在480 nm处的吸光度值(ε480=2200 L·mol-1·cm-1)[7]计算3-NT的浓度。
在过亚硝酸根浓度为50 μmol·L-1、酪氨酸浓度为1 mmol·L-1、生理条件下,利用停留动力学装置研究不同浓度(0 μmol·L-1、2 μmol·L-1、6 μmol·L-1、10 μmol·L-1、14 μmol·L-1)锰卟啉催化过亚硝酸根硝化酪氨酸生成3-NT的动力学。在418 nm处测定3-NT的吸光度[7],得到锰卟啉催化过亚硝酸根硝化酪氨酸生成3-NT的动力学曲线,表观速率常数由动力学软件Bio-Kine拟合计算得出。每组实验平行进行7次。
分别在4℃、15℃、25℃、37℃、45℃测定10 μmol·L-1锰卟啉催化500 μmol·L-1过亚硝酸根硝化1 mmol·L-1酪氨酸生成3-NT的表观速率常数。通过Arrhenius定理,求得活化能Ea。
2 结果与讨论
2.1 生理条件下,锰卟啉催化过亚硝酸根分解的动力学研究
利用停留技术研究了37℃生理条件下锰卟啉催化过亚硝酸根分解的反应动力学,动力学衰减曲线如图2所示。

图2 生理条件下,锰卟啉催化过亚硝酸根分解的动力学曲线
由图2可见,生理条件下锰卟啉存在时,过亚硝酸根的分解显著加快。通过动力学软件,得到37℃下无锰卟啉时(图1a),过亚硝酸根分解的表观速率常数kobs为1.34 s-1,根据公式t1/2=ln2/kobs,计算得到过亚硝酸根自发分解的半衰期为0.52 s;有锰卟啉时(图1b),表观速率常数kobs为8.29 s-1,半衰期为0.08 s。与无锰卟啉相比,过亚硝酸根分解反应速率常数增大、半衰期缩短,说明锰卟啉促进了过亚硝酸根的分解。
在37℃生理条件下,不同浓度的锰卟啉催化400 μmol·L-1过亚硝酸根分解的表观速率常数如图3所示。

图3 37℃下不同浓度锰卟啉催化400 μmol·L-1过亚硝酸根分解的表观速率常数
由图3可见,在生理条件下,随着锰卟啉浓度的增加,锰卟啉催化过亚硝酸根分解的表观速率常数呈线性增大。表观速率常数kobs=k0+kcat[Catalyst],其中k0为空白时的表观速率常数、kcat为催化活性,由直线斜率即可得到锰卟啉的kcat为7.23×105L·mol-1·s-1。
分别在4℃、15℃、25℃、37℃、45℃下,测定锰卟啉催化过亚硝酸根分解的表观速率常数,绘制过亚硝酸根分解的阿伦尼乌斯曲线,如图4所示。

图4 10 μmol·L-1锰卟啉催化400 μmol·L-1过亚硝酸根分解的阿伦尼乌斯曲线
利用阿伦尼乌斯定理,求得锰卟啉催化过亚硝酸根分解的活化能Ea为27.6 kJ·mol-1,而过亚硝酸根自发分解的活化能为80.8 kJ·mol-1。说明锰卟啉使过亚硝酸根分解的活化能降低,加快了过亚硝酸根分解的速率。
2.2 生理条件下,锰卟啉催化过亚硝酸根硝化酪氨酸的动力学研究
不同浓度锰卟啉催化过亚硝酸根硝化酪氨酸的3-NT生成量如图5所示。

图5 不同浓度锰卟啉下3-NT的生成量
由图5可知,3-NT的浓度随着锰卟啉浓度的增加而增大,当锰卟啉浓度从0增加至14 μmol·L-1时,3-NT的浓度从0.09 μmol·L-1升至0.21 μmol·L-1,增加了133%。可见生理条件下,锰卟啉催化过亚硝酸根硝化酪氨酸的能力较大。
在37℃生理条件下,不同浓度锰卟啉催化过亚硝酸根硝化酪氨酸生成3-NT的表观速率常数如图6所示。
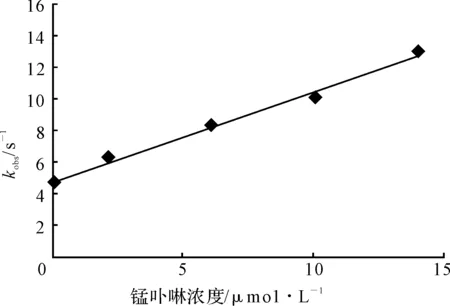
图6 37℃下不同浓度锰卟啉催化3-NT生成的表观速率常数
由图6可知,在生理条件下,随着锰卟啉浓度的增加,锰卟啉催化过亚硝酸根硝化酪氨酸生成3-NT的表观速率常数呈线性增大。表观速率常数kobs=k0+kcat[Catalyst],由直线斜率即可得到锰卟啉的kcat为5.24×105L·mol-1·s-1。
分别在4℃、15℃、25℃、37℃、45℃,测定锰卟啉催化过亚硝酸根硝化酪氨酸生成3-NT的表观速率常数,绘制锰卟啉催化过亚硝酸根硝化酪氨酸生成3-NT的阿伦尼乌斯曲线,如图7所示。

图7 10 μmol·L-1锰卟啉催化500 μmol·L-1过亚硝酸根硝化1 mmol·L-1酪氨酸的阿伦尼乌斯曲线
利用阿伦尼乌斯定理,通过动力学数据求得锰卟啉催化过亚硝酸根硝化酪氨酸生成3-NT的活化能Ea为40.1 kJ·mol-1;而过亚硝酸根硝化游离酪氨酸的活化能为75.3 kJ·mol-1。说明锰卟啉使过亚硝酸根硝化酪氨酸的活化能降低,加快了过亚硝酸根硝化酪氨酸生成3-NT的速率。
3 结论
利用停留技术和快速反应动力学方法,测定了生理条件下,锰卟啉催化过亚硝酸根分解的催化反应速率常数kcat为7.23×105L·mol-1·s-1,活化能Ea为27.6 kJ·mol-1,与空白实验比较,活化能显著降低,说明生理条件下,锰卟啉催化过亚硝酸根分解的效果明显;测定了生理条件下,锰卟啉催化过亚硝酸根硝化酪氨酸生成3-NT的催化反应速率常数kcat为5.24×105L·mol-1·s-1,活化能Ea为40.1 kJ·mol-1,与空白实验比较,活化能显著降低,说明生理条件下,锰卟啉催化过亚硝酸根硝化酪氨酸生成3-NT的效果明显。
参考文献:
[1] Szabo C,Ischiropoulos H,Radi R.Peroxynitrite:Biochemistry,pa-thophysiology and development of therapeutics[J].Nature Reviews Drug Discovery,2007,6(8):662-680.
[2] Szabo C.Peroxynitrite:Biochemistry,toxicology and development of therapeutics[J].Toxicol Lett,2009,189(S1):S22.
[3] Stern M K,Jensen M P,Kramer K.Peroxynitrite decomposition catalysts[J].J Am Chem Soc,1996,118(36):8735-8736.
[4] Uppu R M,Pryor W A.Synthesis of peroxynitrite in a two-phase system using isoamyl nitrite and hydrogen peroxide[J].Anal Biochem,1996,236(2):242-249.
[5] Adler A D,Longo F R,Finarelli J D,et al.A simplified synthesis for meso-tetraphenylporphine[J].J Org Chem,1967,32(2):476.
[6] Guo Can-Cheng,Gui Ming-De,Zhu Shen-Jie.Studied on synthesis of ironporphyrins and cyclohexane hydroxylation catalyzed by ironporphyrins[J].J Chin J Org Chem,1994,14(2):163-170.
[7] Greenacre S A,Ischiropoulos H.Tyrosine nitration:Localisation,quantification,consequences for protein function and signal transduction[J].Free Radic Res,2001,34(6):541-581.

